- •Лабораторна робота № 1 визначення відношення питомих теплоємностей повітря
- •Порядок виконання роботи
- •Контрольні запитання
- •Лабораторна робота № ____ визначення питомої теплоти пароутворення
- •Основні теоретичні відомості
- •Контрольні питання:
- •Лабораторна робота № ____ визначення площі поверхні теплообмінного апарату
- •Основні теоретичні відомості.
- •Порядок виконання роботи
Лабораторна робота № 1 визначення відношення питомих теплоємностей повітря
Питомою теплоємністю називається фізична величина, що вимірюється кількістю теплоти, яка необхідна для нагрівання 1 кг речовини на 1 оС.
Теплоємність газу залежить від умов його нагрівання. Якщо газ нагрівається ізохорично, тобто при V = const, то теплота, що підводиться до нього, йде тільки на збільшення внутрішньої енергії цього газу. Якщо газ нагрівається при ізобаричному процесі, тобто при Р = const, то частина теплоти йде на збільшення внутрішньої енергії газу, а частина затрачається на виконання роботи по розширенню цього газу. Тому розглядають види теплоємностей: питома теплоємність при постійному об’ємі Cv і питома теплоємність при постійному тиску Cp газу. При цьому Cp › Cv.
Відношення питомих теплоємностей газу Cp/Cv входить до рівняння Пуассона, яке зв’язує об’єм, і тиск ідеального газу при адіабатичному процесі.
Адіабатичним називається процес, що протікає без теплообміну з навколишнім середовищем.
Швидке стиснення, або розширення газу – процес, близький до адіабатичного. Перший закон термодинаміки являє собою закон збереження енергії стосовно теплових процесів: кількість теплоти dQ, що підводиться до системи, затрачається на зміну внутрішньої енергії системи CvdT і на виконання роботи PdV цією системою:
dQ = CvdT + PdV. (1)
Для адіабатичного процесу dQ = 0, тоді
CvdT + PdV = 0,
або
PdV = - CvdT. (2)
із рівняння (2) витікає, що при dV › 0 dT ‹ 0, тобто адіабатичне розширення газу відбувається за рахунок зменшення його внутрішньої енергії і температура газу підвищується.
Інтегрування рівняння (2) дає рівняння адіабати, або рівняння Пуассона:
PVγ = const, (3)
де γ = Cp/Cv.
З рівняння Пуассона (3) і закону Бойля-Маріотта PV = const, справедливого для ізотермічного процесу, можна визначити величину γ дослідним шляхом.
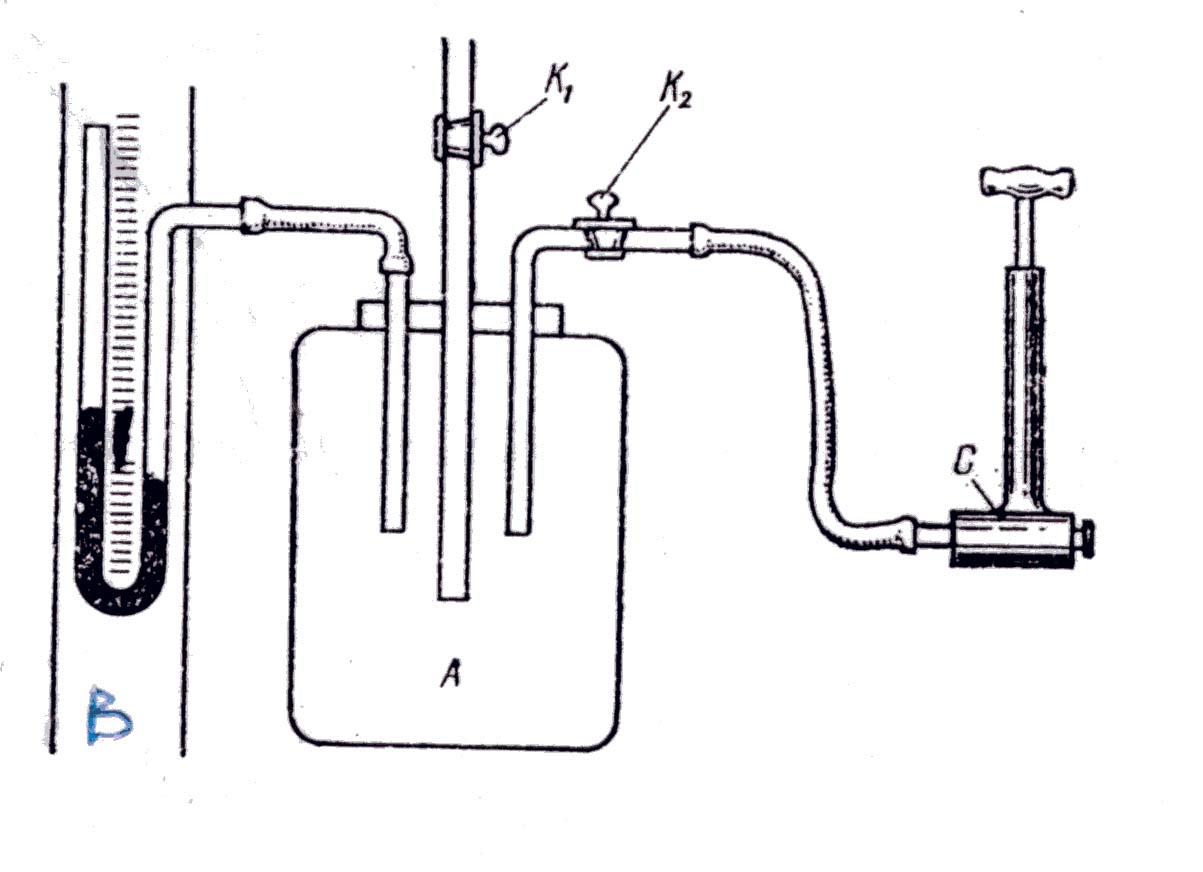
Посудина (скляний балон), що містить повітря при температурі Td і тиску Pd, герметично закривається спеціальним краном.
Потім насосом в посудину нагнітають повітря. При цьому температура і тиск підвищуються. Через деякий час температура повітря в посудині стає рівною температурі навколишнього середовища, і в посудині встановлюється тиск.
P1 = Pd + h1,
де h1 – надлишковий тиск у посудині (різниця рівнів рідини в водяному U-подібному манометрі)
Після того, як температура повітря в посудині стане рівною температурі навколишнього середовища, дуже швидко відкривають і закривають кран к1.
При відкриванні крану к1 частина повітря вийде з посудини і тиск в ньому зрівняється з атмосферним, а температура стане меншою порівняно з температурою навколишнього середовища. Через деякий час температура повітря в посудині знову дорівнюватиме температурі навколишнього середовища, а його тиск підвищиться:
P2 = Pd + h2,
де h2 – надлишковий тиск у посудині.
Припускаємо, що повітря у посудині до відкриття крану при температурі Td і тиску Pd займало об’єм V1. Після відкриття крану повітря буде займати об’єм V посудини.
Процес розширення повітря при відкриванні крану можна вважати адіабатичним, тому що протікає він швидко. Тоді на основі закону Пуассона можна записати
Р1V1γ = PdVγ,
або
![]() (4)
(4)
У початковому і кінцевому станах повітря в посудині його температура має однакове значення Т, тому відповідає до закону Бойля-Маріотта можна записати:
Р1V1 = PdV,
або
![]() (5)
(5)
З рівнянь (2) і (3) маємо

Про логарифмуємо цей вираз:
logPa-log(Pa+h1)= γ[log(Pa+h2) – log (Pa + h1)],
звідси одержимо
![]()
Через те що h1 ‹‹ Pa i h2 ‹‹ Pa, можна записати
![]() log(Pa+h1)
– logPa
=
h1;
log(Pa+h1)
– logPa
=
h1;
log(Pa+h1) - log(Pa+h2) = h1 – h2.
Тоді одержимо
![]() .
.
Прилади і приладдя
Посудина з краном (скляний балон з краном), водяний манометр, насос.