
- •2.2. Нормування якості атмосферного повітря
- •2.3. Очистка промислових газів
- •2.3.1. Очистка промислових газів від твердих включень (сепарація пилу)
- •3.3.1.3. Сепарація пилу за допомогою фільтруючих пристроїв
- •2.3.1.4. Сепарація пилу в електрофільтрах
- •2.3.2. Вловлювання крапельної рідини
- •2.3.3. Загальні методи очистки промислових газів від газоподібних сполук
- •2.3.3.1. Використання методу абсорбції для вловлювання газоподібних сполук
- •2.3.3.2. Використання методу адсорбції для вловлювання газоподібних сполук
- •2.3.3.3. Використання методу хімічних реакцій (хемосорбції)
- •2.3.3.4. Використання каталітичних методів перетворення газоподібних сполук
- •2.3.3.5. Термічні методи знешкодження газоподібних сполук
- •2.3.4. Методи очистки промислових газів від діоксиду сульфуру
- •2.3.5. Методи очистки промислових газів від оксидів нітрогену
- •2.3.6. Очистка промислових газів від оксиду карбону (со)
- •2.3.8. Очистка промислових газів від сірководню
2.3.5. Методи очистки промислових газів від оксидів нітрогену
Оксиди нітрогену NxOy є одними з основних забруднювачів атмосфери. Нітроген з оксиґеном утворює п'ять різних сполук, проте в повітрі зустрічаються тільки три. Деякі їх характеристики розглянемо нижче. -
N2O - оксид нітрогену(І), безбарвний газ, важчий за повітря. В значних кількостях у суміші з киснем має наркотичну дію. Оксид нітрогену (І) часто називають "веселячий газ". При систематичній дії на організм людини викликає запалення кори мозку.
NO - оксид нітрогену(П), за нормальних умов, безбарвний газ, малорозчинний у воді. Має руйнівну дію на нервову систему людини (вражає головний мозок і, як наслідок, викликає параліч та судоми), при потраплянні в кров викликає кисневе голодування. В присутності кисню повітря частково перетворюється в діоксид нітрогену, який у вологій поверхні легенів утворює нітратну кислоту:
NO + 1/2 O2 = NO2 + 113 кДж/моль;
З N02 + Н20 = 2 HNO3 + NO.
Збільшення вмісту оксиду нітрогену в атмосфері, в першу чергу в стратосфері, за рахунок викидів надзвукових літаків, які використовують як паливо гептил, може призводити до руйнування озонового шару Землі:
NO + O3 → N02 + 02;
N02 + О → NO + 02.
NO3 - діоксид нітрогену, буро-червоний газ із характерним запахом. За звичайних умов складається з двох компонентів: мономера N02 та димера N204, які знаходяться в рівновазі:
N204 = 2 N02 - 57 кДж/моль.
З водою діоксид нітрогену утворює нітратну кислоту чим і зумовлена його токсична дія на організм людини. В першу чергу вражаються дихальні шляхи, особливо альвеоли легенів.
Відчуття запаху та подразнення в роті відмічається при концентрації діоксиду нітрогену = 0,2 мг/м3. При концентрації діоксиду нітрогену в повітрі понад 50 мг/м3 спостерігаються важкі отруєння з смертельними випадками.
Небезпека потрапляння діоксиду нітрогену в атмосферу зумовлена тим, що при його взаємодії з парами води утворюється нітратна кислота, яка поряд із сульфатною кислотою є основною складовою "кислотних дощів".
Найстійкіший в атмосфері є діоксид нітрогену, в який переходять всі інші оксиди нітрогену. Тому ГДК встановлені для суми всіх оксидів нітрогену в перерахунку на N02. ГДК оксидів нітрогену в повітрі населених міст складає (ГДКМР=0,085 мг/м3, ГДКСД=0,04 мг/м3).
Слід зазначити, що середній вміст оксидів нітрогену в атмосфері: N02 -1,0 мг/м3, NO - < 0,002 мг/м3, N20 - 0,02 мг/м3. Під впливом сонячних променів оксиди нітрогену розкладаються з ут-воренням атомарного оксигену та, в присутності вуглеводнів, за сприятливих метеорологіч-них умов можуть викликати утворення фотохімічного смогу.
Баланс викидів оксидів нітрогену підприємствами різних галузей промисловості характеризується такими показниками: теплові електростанції - 72,5%, автотранспорт - 17,3%, чорна металургія - 6,1%, промисловість будівельних матеріалів - 1,8%, хімічна промисловість - 1,7%.
В промисловості набули поширення лише два метода очистки газів від оксидів нітрогену - лужний та каталітичний.
Лужні методи. Лужні методи базуються на взаємодії оксидів нітрогену з водними розчинами лугів. Внаслідок взаємодії утворюються солі ніратної та нітритної кислоти, які є товарними продуктами. Внаслідок цього лужні методи є економічно доцільними. Проходить наступна реакція:
2 NаОН + 2 NО2 = NаN0з + NаN02 + Н20.
Очистку промислових газів проводять в апаратах насадкового або барботажного типу. Недо-ліком лужних методів очистки газів від оксидів нітрогену є низька ступінь очистки газів, яка не відповідає санітарним вимогам викидів оксидів нітрогену в атмосферу.
Каталітичні методи. Найефективнішим способом знезараження оксидів нітрогену є каталітичне відновлення їх до елементарного азоту. Процес відновлення проходить на поверхні каталі-затора в присутності газу-відновника. Каталізаторами є сплави металів платинової групи та перехідних мг і злів.
Ефективність процесу каталітичного відновлення оксидів нітрогену визначається активністю каталізатора. Найвищою каталітичною активністю володіють каталізатори на основі платини, родію та паладію, вміст яких в каталізаторах (на основі А1203) є в межах 0,1-2,0%. Ці каталіза-тори забезпечують високу ступінь очистки газу - залишковий вміст оксидів нітрогену в газі не перевищує 5х10-5 %.
Як відновники використовують метан, оксид карбону (СО), водень, природний газ, аміак, нафтовий та коксовий гази, пари керосину тощо. Будь-який з газів-відновників не повинен містити сполук сульфуру, які є каталітичними "отрутами".
Як носій для каталізаторів використовують оксид алюмінію, кераміку, силікагель, металічну стрічку тощо.
Підновлення оксидів нітрогену проходить за схемою:
4 N0 + СН4 -> 2 N2 + С02 + 2 Н20
2 N02 + СН4 → 2 N2 + С02 + 2 Н20;
або
2 N0 + 2 СО → N2 + 2 С02
2 N02 + 4 СО → N2 + 4 С02
або
2 N0 + 2 Н2 → N2 + 2 Н20
2 N0 + 4 Н2 → N2 + 4 Н20
або
6 N0 + 4 NН3 →5 N2 + 6 Н20;
6 N02 + 8 NН3 → 7 N2 + 12 Н20;
Каталітичне відновлення починається при температурі 149°С (відновник - водень) або при 339°С (відновник - метан). Максимальна температура в шарі каталізатора - 800-900°С.
Залежно від концентрації оксидів нітрогену в очищувальному газі вибирають різні схеми очищення. При високих концентраціях оксидів нітрогену (>10%) використовують двохступінчасту очистку газу. Першою стадією очистки є поглинання оксидів нітрогену охолодженою 97-98% НN03 утворенням нітроолеума НN03ґпN02. Концентрація N0, в олеумі до 30 %.
Одночасно проходить окислення N0 до N02 за реакцією:
N0 + 2 НN03 = З N02 + Н20.
Частково очищені гази (або хвостові гази), які містять 1,0-2,0% оксидів нітрогену, доочищають каталітичним відновленням.
Відновлення оксидів нітрогену проходить за реакціями:
6 N0 + 4 NН3 = 5N2 + 6 Н2О + Q;
6N0 2 + 8 NН3 = 7 N2 +12Н2О + Q.
Для повнішого проведення реакцій вміст аміаку повинен перевищувати стехіометричну норму на 20-30%. Надлишок аміаку окислюється киснем за реакцією:
4 NН3 + 3 02 = 2 N2 + 6 Н20 + Q.
Можливе перетворення невеликої кількості аміаку, який пройшов через шар каталізатора в нітрат та нітрит амонію. Установка двохступінчастого очищення нітрозних газів представлена на рис. 3.14. в атмосферу
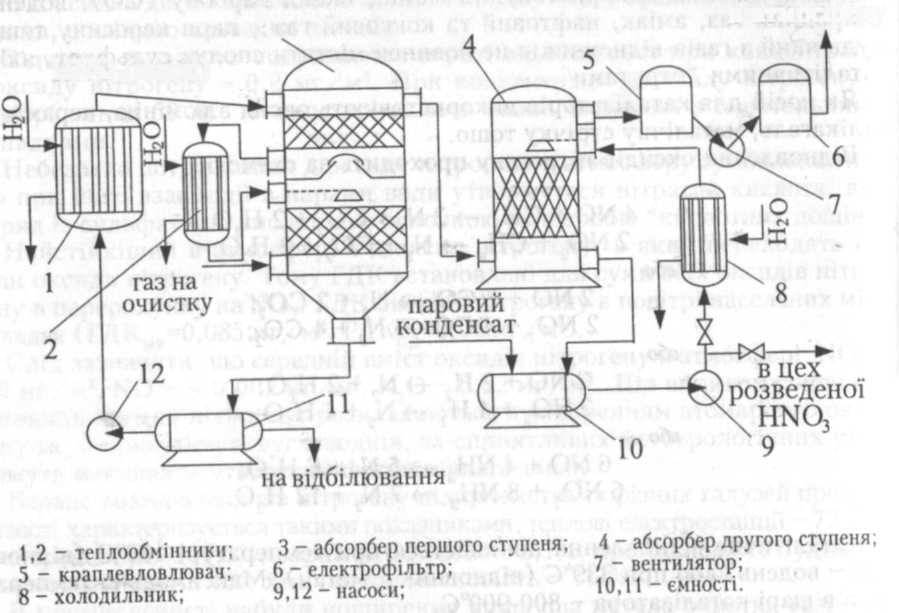
Рис. З-14. Схема установки для очистки газів з високою кониентрацією оксидів нітрогену.
Схема двохступінчастої очистки нітрозних газів включає в себе два абсорбери, які заповнені кільцями Рашига. В першому абсорбері (3) оксиди нітрогену поглинаються охолод-женою концентрованою нітратною кислотою, яка надходить на зрошення верхньої частини абсорбера з теплообмінника (1) при температурі 0-10°С. Із середньої частини першого абсорбера кислота потрапляє на охолодження в теплообмінник (2) і потім знову подається на зрошення нижньої частини абсорбера. Концентрація N02 при цьому знижується до 1,5-2,0%. Концентрована нітратна кислота зливається в ємність (11), звідки насосом (12) знову подається в теплообмінник (1). Частина кислоти з ємності (11) перекачується у відділення відбілювання, де з неї видувають оксиди нітрогену. Після цього нітратна кислота у вигляді товарного продукту надходить на склад.
Нітрозні гази, які містять 1,5-2,0% оксидів нітрогену, напрямляють у другу абсорбційну вежу (4), яка зрошується охолодженим в холодильнику (8) конденсатом з ємності (10). Утворений при цьому кислий конденсат напрямляється в цех для одержання розведеної нітратної кислоти. Одержаний газ проходить через краплевловлювач (5), вентилятором (7) подається в електрофільтр (6), а потім викидається в атмосферу.
