
- •Химическая коррозия Ме. Термодинамика и кинетика коррозии Ме в газах и неэлектролитах.
- •Методы защиты от хи-мической коррозии (жаростойкое легирование, защитные покрытия, за-щитные атмосферы)
- •3) Замена коррозионной среды на менее активную (защитные атмосферы) – имеет ограниченное применение. Пример:
- •Коррозия в электролитах. Распространённость, механизм возникновения, кинетика и основные особенности электрохимической кор-зии.
- •Химич. Механизм кор-зии в эл-тах:
- •Коррозия с кислородной деполяризацией, основные особенности, влияние различных факторов.
- •Пассивное состояние металлов. Современная теория пассивности. Использование явления пассивности в практике защиты.
- •Атмосферная коррозия металлов, основные особенности. Оценка коррозионной агрессивности атмосферы.
- •1)Сухая атмосферная коррозия (хим.) 2)Влажная атмосферная коррозия. 3)Мокрая атмосферная коррозия. 4)Подводная коррозия.
- •Поведение железа и его сплавов в условиях химической и электрохимической коррозии.
- •Грунтовая коррозия металлов, зависимость ее от различных факторов
- •* Влияние Сl-, so4-2:
- •Межкристаллитная корроз., питтинг. И язвенная коррозии, основн особенности, методы защиты.
- •Защита:
- •Классификация методов защиты от корр.Обработка корр-ой среды: удаление наиболее агрессивного ком-та, ингибиторы корр-ии.
- •Корр-ая стойкость железа и его сплавов в различных средах.
- •Противокоррозионное легирование и рафинирование, основные легирующие элементы, виды нержавеющих сталей.
- •Защитные органические покрытия: Лакокрксочные, битумные,полимерные. Области применения, механизм защитного действия, конструкция покрытий, особенности нанесения.
- •Коррозионная стойкость и защитная способность Гальванич покрытий
- •Коррозия и защита металлов
- •Показатели коррозии.
- •Один из участков протяженного трубопровода постоянно разрушается.
- •2) Повысить сопротивление цепи блуждающего тока (изоляция битумом, полимеры и секционирование тр/провода); 3) поляризованный дренаж; 4) токосъёмник
Химическая коррозия Ме. Термодинамика и кинетика коррозии Ме в газах и неэлектролитах.
Х.к. – это самопроизвольный процесс разрушения Ме под д-ем сухих газов и неэл-тов, при котором окисление Ме и восстановление окислителя протекают в виде одной гетерогенной хим. реакции (с уменьшением энергии).
∆G < 0
Газовая коррозия – коррозия под действием сухих газов (воздуха): 2Ме + О2 => 2МеО для двухвалентного Ме в сухом воздухе. PО2 в газе > РО2 над оксидом, но с повышением температуры м/быть наоборот. Это условие выполняется для всех Ме, кроме золота – идёт коррозия.
1)Этап ХК – это этап первоначального окисления, первые слои оксида. Стадии: 1.1)диффузия; 1.2)адсорбция О2 – хемосорбция; 1.3)образование оксида. Все стадии протекают быстро, появляется оксид.
2)Этап ХК – рост оксидной плёнки. Скорость кинетики зависит от того – какая плёнка получается:
2.1)несплошная плёнка, когда VMeO/VMe < 1 для щелочных Ме Na, K, Ca, Ba.
h vкор
h=kT
vкор= αh/αT T T
h – толщина плёнки
в случае несплошной плёнки – линейный закон роста h=kT, υ-скорость коррозии Ме высока и постоянна во времени – коррозия опасная.
2.2)сплошная плёнка: VMeO/VMe > 2,5-3,5 Т>6000С, вольфрам, молибден, ванадий. Стадии кор. процесса: 1)диффузия окислителя к поверхности Ме; 2)ионизация окислителя на границе раздела воздух-оксид; 3)ионизация Ме на границе Ме-оксид; 4)движение ионов Ме в оксиде; 5)движение ионов кислорода в оксиде; 6)перемещение электронов в оксиде; 7)образование оксида. Самые замедленные – стадии движения ионов в оксиде.
Важно знать, что движется быстрее – ионы Ме или ионы О2, это зависит от их размеров. Диаметр иона О2- =0,14 Нм, диаметр Fе2+ =0,07 Нм. Рост плёнки идёт со стороны воздуха, у тяжёлых Ме наоборот.
Теория коррозии зависит от массопереноса плёнки. Массоперенос плёнки происходит за счёт двух сил: 1)градиент концентрации – диффузия ионов; 2)электростатическое поле в плёнке – возникает миграция. Массоперенос плёнки зависит от её дефектности (её упорядоченности, её бездефектности). Упорядоченность плёнки оксидов зависит от:
1)Температуры – при низких Т< 3000С реакция 2Ме + О2 => 2МеО идёт с не очень высокой скоростью и при образовании оксида ионы Ме и О2 успевают вставать в узлы решётки и плёнка получается упорядоченная – бездефектная.
Массоперенос этой плёнки идёт за счёт миграции, рост идёт по логарифмическому закону.
при логарифмическом законе роста оксидной плёнки ХК при низкой температуре не опасна при образовании сплошной упорядоченной плёнки.
При повышении температуры реакция идёт с более высокой скоростью – ионы не успевают встать в узлы решётки и плёнка получается дефектная (плёнка растёт по параболическому закону).
при параболическом законе коррозия становится опасной, плёнка постоянно увеличивается (толстая плёнка – окалина). Температура перехода к параболическому закону служит характеристикой жаростойкости Ме. Жаростойкость – способность Ме сопротивляться коррозионному воздействию высоких температур. Жаропрочность – способность Ме сохранять свои механические свойства при высоких температурах. Переход от логарифмического к
параболическому закону идёт постепенно через степенной закон: hn = k*T, если n=2, то параболический; если n=10, то логарифмический. При температурах, близких к температуре плавления может быть паралинейный закон
Первоначально идёт окисление по параболе, плёнка достигает толщины h1, возникают внутренние напряжения и плёнка отскакивает, Ме оголяется. Если усреднить, то получается паралинейный закон скорость коррозии велика и постоянна во времени – самая опасная коррозия.
Вывод: ХК тем опаснее, чем выше температура Ме.
2)Состава окружающей коррозионной среды: законов нет, определяют опытным путём. В воздухе есть пары воды, SO2, H2S, H2, CO2 и т.д. Пары воды могут выполнять роль дополнительного окислителя: Fe + H2O => FeO + H2 – упорядоченность оксида ухудшается и пары воды способствуют увеличению коррозии.
3Fe + SO2 => FeS + 2FeO – продукты коррозии более сложные: оксиды и соли, менее упорядоченные, увеличивают скорость коррозии.
Fe3C + CO2 => 3Fe + 2CO – железо восстанавливается, но Fe3C – цементит разлагается и уменьшается прочность поверхностного слоя.
Fe3C + 2H2 => 3Fe + CH4 – происходит не только на поверхности, т.к. НАДС проникает вглубь Ме.
3)Природы Ме: 3.1)за счёт сплошности плёнки или несплошности; 3.2)влияет на упорядоченность сплошной плёнки – все Ме делятся на жаростойкие и нежаростойкие. К жаростойким относятся Ме сохраняющие логарифмический закон роста оксидной плёнки, т.е. дающие упорядоченную плёнку до температур близких к ТПЛАВЛЕНИЯ (алюминий ТПЛ = 6620С, хром ТПЛ > 10000С. Большинство технических Ме нежаростойкие.
Методы защиты от хи-мической коррозии (жаростойкое легирование, защитные покрытия, за-щитные атмосферы)
3 основных направления борьбы с хим.кор-зией:
1)изменение природы ме-талла (жаростойкое легирование):
легирующие элементы спо-собствуют образованию при высокой температуре более упорядоченной плён-ки. Жаростойкое легирование бывает:
среднее – 5-10% легир. эл-тов; высокое >10%.
Самыми главными элементами явл-ся Cr, Al, Si.
Cr- главный легир. эл-т, его должно быть ≥ 4-5% (до 30% max)
Чем ↑содержание Cr, тем
↑ t окалинообразования стали, но уменьшаются технологические характеристики стали.
Al и Si – явл-ся добавочными компонентами жаростойкого легирования. Они более сильно ухудшают характеристики стали.
Al – 1-2% - max 5%
Si– 1-2% - max 4%
Напр: 15Х5М - конструкционная, легированная, особого назначения - жаростойкая. Содержит 0,15% С, 5% -Сr, 1% Мо.
t окалинообразования = 500
15Х6СМ - -- // --, содержит 0,15 % С, 6% Сr, 1% Мо, 1% Si; t ок. = 700.
08Х13 - t ок. = 850.
10Х25 - t ок. = 1100.
Помимо жаростойких сталей, есть жаропрочные сплавы на основе Ni (нихром,хостелой…)
2) изоляция металла от окружающей среды (использование жаростойких покрытий)
Например:
неорганические эмали – смесь оксидов и солей. Недостаток - растрескивание при перепаде t.
термодиффузионное покрытие. Бывает:
- термохромирование
- термоалитирование
- термосилицирование
Al+NH4Cl+Al2O3 → 900°С NH4Cl →NH3+НСl
Аl диффундирует вглубь стали
керамические покрытия (оксидами Al2O3, TiO2, SiO2)- являются одними из жаростойких, но не выдерживают температурных перепадов, поэтому такие покрытия заменяют на керлитовые (металл+оксид) – более прочная связь.
покрытия из тугоплавких соединений (бориды, карбиды, нитриды). Улучшается поверхностная твёрдость + повышается жаростойкость стали (диффузия металлоидов)
Лакокрасочные покрытия не применяются! Кроме силиконового лака (Si-Si-Si) до 300°С; если + Al пудра, то t 500-550°С
3) Замена коррозионной среды на менее активную (защитные атмосферы) – имеет ограниченное применение. Пример:
* защита W в лампах накаливания
* использование защит. атмосфер при термообработке, особенно при отжиге до 100 ч при t 1000-1100°С
N2, CO,СО2 – защитная атмосфера при сгорании угля в печи
* сварка нержавеющих сталей, Тi,Аl в атмосфере аргона и др.


К.Д.- это графическое изображение кор. процесса с помощью поляризационных кривых (теоретических). Используются при анализе коррозионного процесса, для определения влияния различных факторов.
Скорость протекания любой электрохимической реакции зависит от потенциала. Эта зависимость может быть выражена уравнением поляризационной кривой или построена графически.
1.1) Zn-2ё=>Zn2+ 1.2) Zn2++2ё=> Zn 2.1) Н++ё=>Надс 2.2) Надс-ё=>Н+
Из условия стационарности коррозии: ia= ik можем найти потенциал коррозии. Это подробная диаграмма, описывающая коррозионный процесс:
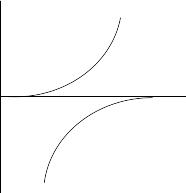 Коррозионная
диаграмма Шултина-Вагнера
Коррозионная
диаграмма Шултина-Вагнера
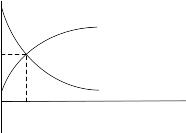
Коррозионные диаграммы Эванса
Эванс предложил изображать коррозионные диаграммы по другому: ток независимо катодный или анодный откладывается в одну сторону.
Условие стационарности находится по пересечению пунктиров, т.е. его не надо находить.
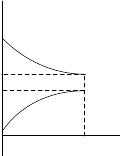










Катодные процессы электрохимической коррозии. Коррозия с водородной деполяризацией, влияние на неё различных факторов.
Электрохимическую коррозию могут вызывать пять видов окислителей:
1). Катионы: Н++ё=>НАДС=>H2; Cu2++2ё=>Cu; Fe3++ё=>Fe2+=>Fe3+ (+O2)
2). Молекулы: О2+4Н++4ё=>2H2O; H2O2+2ё=>2ОН-; CL2+2ё=>2СL-
3). Анионы солей кислот: NO3-+ё+Н+=>NO2+H2O; MnO4-+3ё+4Н+=>MnO2+2H2O;
Cr2O72-+6ё+Н+=>2Cr3++H2O
4). Оксиды и гидроксиды: Fe(OH)3+ё=> Fe(OH)2+ОН-; Fe3O4+2ё+2H+=>3FeO
5.1). Органика, предельные углеводороды: R+2H++2ё=>RH2 предельные
5.2). Кетоны, альдегиды, спирты – восстановление до другого органического соединения:
R=CH+H++ё=>R=OH2
Коррозию могут вызвать несколько видов окислителей, главные есть всегда и везде:
ион водорода (вода) – катионы
растворённый кислород – молекулы
Коррозия с водородной деполяризацией
Это коррозия под действием ионов водорода или воды, сопровождающаяся выделением водорода.
В кислых средах: Н3О++ё=>НАДС+Н2О; В нейтральных и щелочных: Н2О+ё=>НАДС+ОН-
ЕРАВНН2<ЕРАВНМе ЕРАВНН2= - 0,06рН
Металлы находящиеся в ряду стандартных электродных потенциалов левее водорода могут корродировать, а находящиеся правее не могут. Более точное определение производят по диаграмме устойчивости водорода.
 1
группа Ме справа до кадмия могут
корродировать в любых средах;
1
группа Ме справа до кадмия могут
корродировать в любых средах;
2 группа от кадмия до водорода корродируют в кислых средах; 3 группа от водорода влево не корродируют. Вывод: коррозии с водородной деполяризацией подвергаются активные Ме, либо Ме работающие в активных средах.
Кинетика коррозии с водородной деполяризацией.
Стадии:
1)Доставка Н3О+, Н2О не может быть замедлена; 2)Разряд; 3)Молизация: 3.1) эл.химическая десорбция; 3.2) рекомбинация; 3.3) эмиссия. Чаще всего замедлена эл.химическая десорбция.
4) Отвод водорода в газовую фазу.
перенапряжение зависит от природы Ме и от примесей(технический цинк корродирует быстрее чистого, т.к. в нём есть медь, а на ней перенапряжение водорода мало).
Перемешивание влияет, если замедлен отвод водорода в газовую фазу. Первый продукт при коррозии с водородной деполяризацией в результате катодного процесса является адсорбированный водород, это маленькая частица, соизмеримая по размерам с расстоянием в решётке Ме между атомами(ОЦК Fe), поэтому НАДС легко проникает вглубь Ме – эффект наводораживания, повышение хрупкости Ме, плохая свариваемость Ме, получается молекулярный водород отрывает защитные плёнки от Ме, разрыхляет продукты коррозии, коррозия усугубляется, поэтому коррозию пытаются полностью исключить. Если есть водородная деполяризация, то есть коррозия и с кислородной деполяризацией.
