
- •2 Подвижность атома галогена в ароматических нитросоединениях
- •3 Реакции замещения
- •30) Химические свойства
- •1. Окисление первичных спиртов
- •2. Восстановление ацилхлоридов по Розенмунду
- •3. Альдегиды получают гидролизом дигалогенопроизводных углеводородов, однако только тех, у которых оба атома галогена расположены у одного из концевых атомов углерода.
6) физ св-ва:
алканы: Темп-ры плав-ия и кип-ия увел-тся с молек-ой массой и длиной главной углерод. цепи. При норм. услов. неразвет-ные алканы с CH4 до C4H10 — газы; с C5H12 до C13H28 — ж-ти; после C14H30 — тв. в-ва. Темп-ры плав-ия и кип-ия пониж-тся от менее развет-ных к более развет-ным. Так, напр-р, при 20 °C н-пентан — ж-ть, а неопентан — газ. Газооб. алканы горят бесцвет. или бледно-голубым пламенем с выделением большого кол-ва тепла. Алкены: Физ-ие св-ва алкенов (непред-ых углеводородов) сходны со св-вами предельных углеводородов(алканов). Низкомолекулярные представители алкенов (до бутилена включительно) при обычных темп-рах и давлении— газы; средние члены гомол-го ряда - жидкости; высшие олефины — твердые вещества. Олефины нерастворимы в воде, хорошо растворимы в органических растворителях. Алкины: Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов. Алкины плохо растворимы в воде, лучше – в органических растворителях. Арены: Бензол и его ближайшие гомологи – бесцветные жидкие вещества (табл. 7.3.1), нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Огнеопасны. Бензол токсичен (вызывает заболевание крови – лейкемию). Галогенпроизводные углеводородов: бесцветные жидкости или газы, обладающие при глубоком вдохе слабым вкусом. Нерастворимы в воде и тяжелее воды. Спирты: представляют собой жид-ти или тв. в-ва со своеоб-ым запахом. (низш. спирты – приятный запах, С4-С6 – раздраж-й, высшие – аром-ый). Темп-ра кипения их выше, чем др-х углеводородов. Карбоновые кислоты: Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с н-нонановой СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота. Фенолы: Бесцветные игольчатыекристаллы, розовеющие на воздухе из-за окисления, приводящего к образованию окрашенных веществ. Обладают специфическимзапахом гуаши. Растворим в воде (6 г на 100 г воды), в растворах щелоче́й, в спирте, в бензоле, в ацетоне. 5 % раствор в воде — антисептик, широко применяемый в медицине. Многоат. спирты: бесцветные сиропообразные жидкости сладковатого вкуса, хорошо растворимы в воде, плохо — в органических растворителях; имеют высокие температуры кипения. Сложные эфиры: Сложные эфиры низших карбоновых кислот и простейших одноатомных спиртов — летучие бесцветные жидкости с характерным, зачастую фруктовым запахом. Сложные эфиры высших карбоновых кислот — бесцветные твердые вещества, температура плавления зависит как от длин углеродных цепей ацильного и спиртового остатков, так и от их структуры. Аром-ие и алифат-ие амины: Первые представители ряда аминов – метиламин CH3NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N и этиламин C2H5NH2 – при комнатной температуре газообразные, далее при увеличении числа атомов в R амины становятся жидкостями, а при увеличении длины цепи R до 10 атомов С – кристаллическими веществами. Растворимость аминов в воде убывает по мере увеличения длины цепи R и при возрастании числа органических групп, связанных с азотом (переход к вторичным и третичным аминам). Запах аминов напоминает запах аммиака, высшие (с большими R) амины практически лишены запаха. Альдегиды и кетоны: При обычных условиях все альдегиды и кетоны, за исключением формальдегида, являются жидкостями или твердыми веществами. Они имеют более низкие температуры кипения по сравнению с температурами кипения соответствующих спиртов, что связано с неспособностью карбонильных соединений к образованию водородных связей. Низшие и средние гомологи ряда альдегидов имеют характерный запах. Приятные запахи высших альдегидов широко используются в парфюмерии. Низшие альдегиды (формальдегид, ацетальдегид) и кетоны и ацетон) хорошо растворимы в воде.
Химические
св-ва:
Алканы не взаимод-ют с обычными минер.
кислотами, щелочами, окислителями.
Химические свойства непредельных
углеводородов резко отличны от свойств
предельных, насыщенных, углеводородов.
Непредельные углеводороды отличаются
от предельных значительно большей
реакционной способностью; олефины легко
вступают в реакции присоединения, в то
время как предельные углеводороды к
таким реакциям не способны. В отличие
от предельных углеводородов олефины
легко окисляются различными окислителями,
в том числе и кислородом воздуха, при
обыкновенной температуре. Важнейшее
свойство олефинов заключается в
способности их молекул соединяться
друг с другом или, как говорят, вступать
в реакции уплотнения. Реакции уплотнения,
в результате которых образуются
соединения, имеющие тот же состав, но
более высокий молекулярный вес, называются
реакциями полимеризации, а получающиеся
при этом вещества — полимерами.Химические
свойства алкинов
сходны с алкенами, что обусловлено их
ненасыщенностью. По химическим
свойствам арены
отличаются от предельных и непредельных
углеводородов. Это объясняется
особенностями строения бензольного
кольца. Делокализация шести p-электронов
в циклической системе понижает энергию
молекулы, что обусловливает повышенную
устойчивость (ароматичность) бензола
и его гомологов. Поэтому арены не склонны
вступать в реакции присоединения или
окисления, которые ведут к нарушению
ароматичности. Для них наиболее характерны
реакции, идущие с сохранением ароматической
системы, а именно, реакции
замещения атомов
водорода, связанных с циклом. Наличие
областей повышенной p-электронной
плотности с двух сторон плоского
ароматического цикла ведет к тому, что
бензольное кольцо является нуклеофилом
и в связи с этим склонно подвергаться
атаке электрофильным реагентом. Таким
образом, для ароматических соединений
наиболее типичны реакции электрофильного
замещения.
Спирты отличаются разнообразными
превращениями. Реакции спиртов имеют
некоторые общие закономерности:
реакционная способность первичных
одноатомных спиртов выше, чем вторичных,
в свою очередь, вторичные спирты химически
более активны, чем третичные. Для
двухатомных спиртов, в том случае, когда
ОН-группы находятся у соседних атомов
углерода, наблюдается повышенная (в
сравнении с одноатомными спиртами)
реакционная способность из-за взаимного
влияния этих групп. Для спиртов возможны
реакции, проходящие с разрывом как С–О,
так и О–Н – связей. Карбоновые кислоты
содержат сильно полярную связь между
атомами кислорода и водорода в
гидроксильной группе, которая еще больше
поляризуется под влиянием атома
кислорода, входящего в состав карбонильной
группы. Карбоновые кислоты — слабые,
поэтому сильные минеральные кислоты
вытесняют их из соответствующих солей.
Атом углерода карбонильной группы
сложных эфиров электрофилен, вследствие
этого для них характерны реакции
замещения спиртового остатка с разрывом
связи ацил-кислород:RCOOR1 +
Nu− ![]() RCONu
+ R1O−;
Nu = OH, R2O,
NH2,
R2NH,
R2CH
и т. п. Такие
реакции с кислородными нуклеофилами
(водой и спиртами) зачастую катализируются
кислотами за счет протонирования атома
кислорода карбонила с образованием
высокоэлектрофильного карбокатиона:
RCONu
+ R1O−;
Nu = OH, R2O,
NH2,
R2NH,
R2CH
и т. п. Такие
реакции с кислородными нуклеофилами
(водой и спиртами) зачастую катализируются
кислотами за счет протонирования атома
кислорода карбонила с образованием
высокоэлектрофильного карбокатиона:
RCOOR1 + H+ RC+OHOR1, который далее реагирует с водой (гидролиз) или спиртом (переэтерификация). Гидролиз сложных эфиров в условиях кислотного катализа является обратимым, гидролиз же в щелочной среде необратим из-за образования карбоксилат-ионов RCOO−, не проявляющих электрофильных свойств. Низшие сложные эфиры реагируют с аммиаком, образуя амиды, уже при комнатной температуре: так, например, этилхлорацетат реагирует с водным аммиаком, образуя хлорацетамид уже при 0 °C, в случае высших сложных эфиров аммонолиз идет при более высоких температурах. Фенол обладает слабыми кислотными свойствами, при действии щелочей образует соли — феноляты (например, фенолят натрия - C6H5ONa): C6H5OH + NaOH = C6H5ONa + H2O. Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп, увеличивает реакционную способность кольца к этим реакциям, и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется. Реакция Кольбе-Шмидта. Взаимодействие с металлическим натрием: 2C6H5OH + 2Na = 2C6H5ONa + H2↑. Взаимодействие с бромной водой (качественная реакция на фенол): C6H5OH + 3Br2(aqua) → C6H2(Br)3OH + 3HBr образуется твердое вещество белого цвета 2,4,6 трибромфенол. Взаимодействие с концентрированной азотной кислотой: C6H5OH + 3HNO3конц → C6H2(NO2)3OH + 3H2О образуется 2,4,6 тринитрофенол. Взаимодействие с хлоридом железа (III)(качественная реакция на фенол): 6C6H5OH + FeCl3 → [Fe(C6H5OH)6]CI3 образуется трихлоридфенолят железа (III)(фиолетовое окрашивание). Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп. Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. Например, этиленгликоль реагирует не только с щелочными металлами, но и с гидроксидами тяжелых металлов. Отличительная способность аминов – присоединять нейтральные молекулы (например, галогеноводороды HHal, с образованием органоаммониевых солей, подобных аммонийным солям в неорганической химии. Для образования новой связи азот предоставляет неподеленную электронную пару, исполняя роль донора. Участвующий в образовании связи протон Н+ (от галогеноводорода) играет роль акцептора (приемника), такую связь называют донорно-акцепторной (рис. 1). Возникшая ковалентная связь N–H полностью эквивалентна имеющимся в амине связям N–H. Альдегиды способны к восстановлению, основной продукт восстановления — первичные спирты. Присоединение синильной кислоты используется для удлинения углеродной цепи. Присоединение гидросульфита натрия используется для выделения альдегидов из растворов.
Присоединение спиртов с образованием полуацеталей (при избытке спирта и хлороводороде образуются ацетали). Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты.
1)
Согласно этой концепции, кислоты представляют собой вещества, способные в растворах отдавать протон, а основания — вещества, способные присоединять протон. Эта теория получила название протолитической, так как кислотность и основность связывают со способностью отдавать или присоединять протон. Большинство органических соединений можно рассматривать как кислоты, поскольку в них содержатся поляризованные связи атома водорода с различными элементами (О, N, S, С). Органические кислоты классифицируют по природе кислотного центра: 1. ОН-кислоты: спирты, фенолы, карбоновые кислоты, сульфокислоты, гидроксикислоты, аминокислоты; 2. SH-кислоты: тиоспирты, SH-содержащие аминокислоты и др. соединения; 3. NH-кислоты: амины, имины, гетероциклические соединения с атомом азота; 4. СН-кислоты: углеводороды, радикалы гетерофункциональных соединений. Основания Бренстеда — нейтральные молекулы или ионы, способные присоединять протон (акцепторы протонов). Влияние природы атома в основном центре и связанных с ним заместителей на основность противоположно рассмотренному ранее их влиянию на кислотность. Электронодонорные заместители увеличивают основность, электроноакцепторные — уменьшают.
Сравнение по основности (от самого слабого основания к самому сильному): 2-нитроанилин, 4-метиланилин, аммиак, пропиламин. Реакция анилина с HCl:
С6Н5NН2 + HCl = [C6H5NH3]+Cl-.
3)
По
сравнению с алкенами алкины несколько
менее активны в реакциях электрофильного
присоединения и более активны в реакциях
с нуклеофилами, например, с аминами и
алкоголятами. Меньшая длина тройной
связи по сравнению с двойной и
sp-гибридизация атомов углерода приводит
к тому, что область ![]() -связей
более компактна по сравнению с алкенами
и относительно труднодоступна для
электрофилов. С другой стороны, атомы
углерода более доступны для нуклеофильных
реагентов вследствии линейного строения
тройной связи. Тем не менее, алкины, как
и алкены, легче реагируют с электрофильными
реагентами, чем с нуклеофильными. Большое
влияние на соотношение скоростей реакций
алкенов и алкинов оказывает природа
растворителей.
-связей
более компактна по сравнению с алкенами
и относительно труднодоступна для
электрофилов. С другой стороны, атомы
углерода более доступны для нуклеофильных
реагентов вследствии линейного строения
тройной связи. Тем не менее, алкины, как
и алкены, легче реагируют с электрофильными
реагентами, чем с нуклеофильными. Большое
влияние на соотношение скоростей реакций
алкенов и алкинов оказывает природа
растворителей.
В состоянии sp-гибридизации атом углерода обладает наибольшей электроорицательностью, это приводит к сильной C-H кислотности концевых ацетиленовых группировок.
1. Гидрирование. Водород присоединяется к тройной связи в присутствии тех же катализаторов, что и к двойной:
![]()
Реакция эта идет медленнее, чем у аналогично построенных алкенов. Однако в смеси алкена и алкина в первую очередь гидрируется алкина, так как он легче адсорбируется на поверхности катализатора и не допускает на нее молекулы алкена. 2. Галогенирование. Присоединение хлора, брома и иода к алкинам по электрофильному механизму также идет с меньшей скоростью, чем к алкенам.
![]() .
.
Качественная реакция на алкины: R-C≡C-H + Ag(NH3)2OH = R-C≡C-Ag (белый осадок).
Качественная реакция на алкены: СH3-CH2-CH=CH2 + Br2 =HOH CH3-CH2-CH(Br)-CH2(Br) (обесцвечивание бромной воды).
4)
Качественная реакция на алкены: СH3-CH2-CH=CH2 + Br2 =HOH CH3-CH2-CH(Br)-CH2(Br) (обесцвечивание бромной воды).
Качественная реакция на алкины: R-C≡C-H + Ag(NH3)2OH = R-C≡C-Ag (белый осадок).
Качественная
реакция на спирты и многоатомные спирты:
Реакция с оксидом серебра - в осадок
выпадает медь:
![]() .
Многоат. спирты с Cu(OH)2 образуют комплекс
синего цвета.
.
Многоат. спирты с Cu(OH)2 образуют комплекс
синего цвета.
Качественная реакция на фенолы: Взаимодействие с хлоридом железа (III)(качественная реакция на фенол): 6C6H5OH + FeCl3 → [Fe(C6H5OH)6]CI3 образуется трихлоридфенолят железа (III)(фиолетовое окрашивание); Взаимодействие с бромной водой (качественная реакция на фенол): C6H5OH + 3Br2(вода) → C6H2(Br)3OH + 3HBr образуется твердое вещество белого цвета 2,4,6 трибромфенол.
Кач-ая р-ия на альдегиды: реакция серебрян. зеркала и р-ия медного зеркала
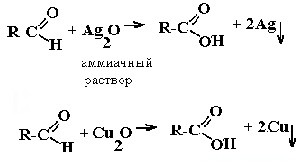 .
.
5) В результате взаимодействия электрофильного агента Е+ с алкеном образуется карбокатион, обладающий высокой реакционной способностью. Карбокатион далее стабилизируется за счет быстрого присоединения нуклеофильного агента Nu-:


Поскольку
медленной стадией является присоединение
электрофила, то процесс присоединения
любого полярного агента Е+![]() Nu-
следует
рассматривать именно как электрофильное
присоединение к кратной связи алкена.
Nu-
следует
рассматривать именно как электрофильное
присоединение к кратной связи алкена.
7) галогенирование: СН3-(CH2)4-CH=CH2+Cl2=CH3-(CH2)4-CHCl-CH2Cl.
CH3-C6H4-CH3+Cl2=CH3-C6H3Cl-CH3+HCl (в присутствии FeCl3).
Сульфирование: СН3-(CH2)4-CH=CH2+H2SO4= СН3-(CH2)4-CH(SO3H)-CH3
 CH3-C6H3(SO3H)-CH3+H2O.
CH3-C6H3(SO3H)-CH3+H2O.
Окисление: СН3-(CH2)4-CH=CH2+KMnO4(H+) = СН3-(CH2)4-COOH + CO2 + H2O + MnO2
 HOOC-C6H4-COOH
+ 2H2O + CO2.
HOOC-C6H4-COOH
+ 2H2O + CO2.
8)
C6H6 + HNO3 = C6H5-NO2 + H2O
Нитрование
ароматических углеводородов
нитроний-катионом протекает как
ионно-комплексная реакция. Сначала
нитроний катион NO2+ присоединяется
к ядру ароматического углеводорода,
![]()
затем от образовавшегося соединения отрывается протон.
![]() .
R=H.
Орто-, пара-ориентанты (1 род). Относятся
все ЭД-заместители(алкильные
заместители(-СН3 и т.д.), анионные зам-ли(-S
и т.д.), -NH2,
-OH
и т.д.) и галогены. Электр-ая плот-ть под
влиянием ЭД-зам-лей повыш-ся в основном
в орто- и пара-положениях. Мета-ориентанты
(2 род): ЭА-замес-ли (-NH3,
-NO2,-COOH,-COH
и т.д.) Сниж-ие элект-ой плот-ти в аром-ом
цикле неравн-но. Более всего сниж-ие в
орто- и пара-пол-иях, а в мета-положении
имеется область наибольшей элект-ой
плотности.
.
R=H.
Орто-, пара-ориентанты (1 род). Относятся
все ЭД-заместители(алкильные
заместители(-СН3 и т.д.), анионные зам-ли(-S
и т.д.), -NH2,
-OH
и т.д.) и галогены. Электр-ая плот-ть под
влиянием ЭД-зам-лей повыш-ся в основном
в орто- и пара-положениях. Мета-ориентанты
(2 род): ЭА-замес-ли (-NH3,
-NO2,-COOH,-COH
и т.д.) Сниж-ие элект-ой плот-ти в аром-ом
цикле неравн-но. Более всего сниж-ие в
орто- и пара-пол-иях, а в мета-положении
имеется область наибольшей элект-ой
плотности.
9)
расположим в ряд по увеличению кислотных свойств:
Спирты<фенолы<H2CO3<карбоновые кислоты. Фенолы также относят к ОН-кислотам, причем они проявляют по сравнению со спиртами, более сильные кислотные свойства. Это объясняется ЭА влиянием бензольного кольца (-М) и устойчивостью образующегося аниона за счет делокализации отрицательного заряда (ρ,π-сопряжение).
Получение солей:
![]()
С6H5OH + NaOH = C6H5ONa + H2O
2СH3CH2COOH + Na2CO3 = 2CH3CH2COONa + H2O + CO2.
10)
Как видно, процесс этерификации обратимый:
CH3–![]() –OH
+ HO–CH3 « CH3–
–OCH3 +
H2O
–OH
+ HO–CH3 « CH3–
–OCH3 +
H2O
поэтому при наступлении химического равновесия в реакционной смеси будут находиться как исходные, так и конечные вещества.
Катализатор (ионы водорода) – одинаково ускоряют прямую и обратную реакции, то есть достижение равновесия. Чтобы сдвинуть равновесие в сторону образования эфира, следует брать в избытке исходные кислоту или спирт, или удалять один из продуктов реакции из сферы взаимодействия – например, отгоняя эфир или связывая воду водоотнимающими средствами. Методом "меченых атомов" с помощью тяжёлого изотопа кислорода показано, что вода при этерификации образуется за счёт атома водорода спирта и гидроксила кислоты:
|
O II |
|
|
O II |
|
R– |
C- |
-18OH + H - |
-O–R’ ––H+® R– |
C |
–O–H + H218O |
Учитывая этот факт, предложен следующий механизм реакции этерификации. Кислород карбонильной группы кислоты захватывает протон, образуя оксониевый катион (I), который находится в равновесии с карбкатионом (II). Молекула спирта атакует далее карбкатион (II), присоединяется к нему за счёт неподелённой пары электронов кислородного атома и образует оксониевый катион (III), который находится в равновесии с оксониевым катионом (IV). От катиона (IV) отщепляется молекула воды, в результате чего образуется карбкатион (V), который находится в равновесии с оксониевым катионом (VI). Оксониевый катион (VI) выбрасывает протон, являющийся катализатором реакции, приводя к молекуле конечного продукта – сложному эфиру.
11)


 (пара-положение).
(пара-положение).
12)
Получение:
Винилацетата:

Бута-1,3-диена:
Винилхлорида:
![]() .
.
13)
Физические свойства. Сложные эфиры - бесцветные жидкости, малорастворимые или совсем не растворимые в воде, обладают специфическим запахом (в малых концентрациях - приятным, часто фруктовым или цветочным). Сложные эфиры высших спиртов и высших кислот - твердые вещества.
Химические свойства
1.
Реакция гидролиза, или омыления. Так,
как реакция этерификации является
обратимой, поэтому в присутствии кислот
протекает обратная реакция гидролиза:![]()
Реакция
гидролиза катализируется и щелочами;
в этом случае гидролиз необратим, так
как получающаяся кислота со щелочью
образует соль:![]()
2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.
3.
Реакция восстановления. Восстановление
сложных эфиров водородом приводит к
образованию двух спиртов:![]()
4.
Реакция образования амидов. Под действием
аммиака сложные эфиры превращаются в
амиды кислот и спирты:![]()
14)
I стадия. Катион алкилгидроксония, отщепляя воду, превращается в карбокатион:


Роль кислоты, таким образом, заключается в превращении ОН-группы в Н2О, которая отщепляется легче, чем анион НО–.
II стадия. Карбокатион вызывает гетеролитический разрыв связи в галогеноводороде и присоединяет галогенид-анион с образованием конечного продукта:
![]() или
или
![]()
![]()
Освободившийся
H+ идет
на протонирование новых молекул спирта.
(Вместо СН3-СН2ОН поставьте циклогексанол
(![]() ).
).
15)
Полиэтилен — представляет собой полимер, образующийся при полимеризации этилена:
![]() ;
;
Полипропилен — полимер пропилена, следующего за этиленом гомолога непредельных этиленовых углеводородов:
 ;
;
Полистирол — образуется при полимеризации стирола:
 ;
;
Поливинилхлорид (полихлорвинил) — получается полимеризацией винилхлорида:
 ;
;
Политетрафторэтилен — полимер тетрафторэтилена:
 .
.
16)
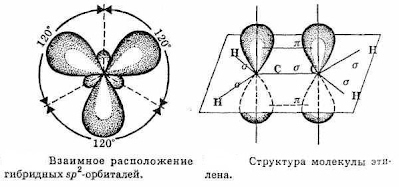
Атомы углерода в молекуле бутадиена-1,3 находятся в sp2 - гибридном состоянии, что означает расположение этих атомов в одной плоскости и наличие у каждого из них одной p- орбитали, занятой одним электроном и расположенной перпендикулярно к упомянутой плоскости.
|
|
Схематическое изображение строения молекул дидивинила (а) и вид модели сверху (b). Перекрывание электронных облаков между С1–С2 и С3–С4 больше, чем между С2–С3. |
|
p- Орбитали всех атомов углерода перекрываются друг с другом, т.е. не только между первым и вторым, третьим и четвертым атомами, но и также между вторым и третьим.
молекула
бутадиена -1,3 характеризуется системой
сопряженных двойных связей.
Такая
особенность в строении диеновых
углеводородов делает их способными
присоединять различные реагенты не
только к соседним углеродным атомам
(1,2- присоединение), но и к двум концам
сопряженной системы (1,4- присоединение)
с образованием двойной связи между
вторым и третьим углеродными атомами.
Отметим, что очень часто продукт 1,4-
присоединения является основным.
Рассмотрим реакции галогенирования и
гидрогалогенирования сопряженных
диенов.

|
––––® |
|
Углеводороды с сопряженными двойными связями получают:
1. дегидрированием алканов, содержащихся в природном газе и газах нефтепереработки, при пропускании их над нагретым катализатором
CH3–CH2–CH2–CH3 ––600°С;Cr2O3,Al2O3® CH2=CH–CH=CH2 + 2H2
CH3– |
CH–CH2–CH3 ––600°С;Cr2O3,Al2O3® CH2= I CH3 |
C–CH=CH2 + 2H2 I CH3 |
2. дегидрированием и дегидратацией этилового спирта при пропускании паров спирта над нагретыми катализаторами (метод акад. С.В.Лебедева)
2CH3CH2OH ––450°С;ZnO,Al2O3® CH2=CH–CH=CH2 + 2H2O + H2.
17)
СН3-СН(Cl)-CH2-CH2-CH3
+ НOH CH3-CH(OH)-CH2-CH2-CH3
+ НCl
CH3-CH(OH)-CH2-CH2-CH3
+ НCl

При замене Cl на I увеличится реакционная способность Нal-алкилов.(скорость тоже увеличится).
18)

 .
.
19)
Механизм SN2-реакции.
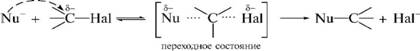
СН3 – СН(I) – CH2 – CH2 – CH3 + NaOH → СН3 – СН(OH) – CH2 – CH2 – CH3 + NaCl
При замене I на Cl скорость реакции уменьшится.
20)
Физические свойства
Первый член гомологического ряда предельных альдегидов НСНО - бесцветный газ, несколько последующих альдегидов - жидкости. Высшие альдегиды - твердые вещества. Карбонильная группа обуславливает высокую реакционную способность альдегидов. Температура кипения альдегидов возрастает с увеличением молекулярной массы. Кипят они при более низкой температуре, чем соответствующие спирты, например пропионовый альдегид при 48,8 оС, а пропиловый спирт - при 97,8 оС. Плотность альдегдов меньше единицы. Муравьиный и уксусный альдегиды хорошо растворяются в воде, последующие - хуже. Низшие альдегиды имеют резкий, неприятный запах, некоторые высшие - приятный запах.
Получение альдегидов: 1)дегидрирование спиртов:

2. Окисление спиртов

3.Получение из солей карбоновых кислот

4.Восстановление хлорангидридов кислот
![]()
5.Гидратация алкилацетиленов.
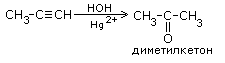
Химические свойства: Наличие карбонильной группы определяет большую реакционную способность альдегидов. Двойная связь между кислородом и углеродом в группе С = О в отличие от обычной двойной углерод-углеродной связи сильно поляризована, так как кислород обладает значительно большей электроотрицательностью, чем углерод, и электронная плотность p-связи смещается к кислороду.
 .
.
Где [O] – это KMnO4 и K2Cr2O7 в кислой среде.
21)
При бромировании бромом в присутствии кислот Льюиса в этих реакциях участвует комплекс галогена с кислотой Льюиса, например, [Br + ...Br-FeBr3 - ]. В качестве катализатора обычно берут FeCl3 или FeBr3, которые можно получать из металлического железа и Cl2 или Br2 прямо в реакционном сосуде. Более активные катализаторы AlCl3 или AlBr3 нередко приводят к образованию продуктов полигалогенирования. Так, например, при бромировании бензола в присутствии AlBr3 замещаются все шесть атомов водорода и образуется гексабромбензол. Поэтому AlHal3 мало пригодны для галогенирования бензола, моно- и диалкилбензолов, галогенбензолов. Сильные кислоты Льюиса эффективны при галогенировании нитробензола, бензойной кислоты и других соединений, содержащих электроноакцепторные заместители. Во всех случаях атакующим агентом, по-видимому, является комплекс Hal2 с кислотой Льюиса. До сих пор нет прямых доказательств участия в реакции катионов Cl+ или Br+, как кинетически независимых частиц.

![]()
Если ввести СН3- то бром присоединится в орто- или пара-полож-ие, если ввести группу NO2-, то бром присоединится в мета-положение.
24)
Ароматичность (от
греч. aroma, род. падеж aromatos - благовоние),
понятие, характеризующее совокупность
структурных, энергетических свойств и
особенностей реакционной способности
циклических структур с системой
сопряженных связей. Термин введен Ф. А.
Кекуле (1865) для описания свойств
соединений, структурно близких кбензолу -
родоначальнику класса ароматических
соединении.
Тенденция
бензола и его производных к сохранению
структуры сопряженного кольца в различных
превращениях означает повышенную
термодинамическую и кинетическую
устойчивость этого структурного
фрагмента. Стабилизация (понижение
электронной энергии) молекулы или иона.
обладающих циклической структурой,
достигается при полном
заполнении электронами всех
связывающих молекулярных ![]() орбиталей
и вакантности несвязывающих и
антисвязывающих орбиталей. Выполнение
этих условий достигается, когда общее
число
орбиталей
и вакантности несвязывающих и
антисвязывающих орбиталей. Выполнение
этих условий достигается, когда общее
число ![]() электронов
в циклическомполиене равно
(4л + 2), где п = = 0,1,2... (правило
Хюккеля).
электронов
в циклическомполиене равно
(4л + 2), где п = = 0,1,2... (правило
Хюккеля).
Это
правило объясняет устойчивость бензола
(ф-ла I) и циклопентадиенильного аниона
(II; п = 1). Оно позволило правильно
предсказать устойчивость циклопропенильного
(III; п = 0) и циклогептатриенильного
(IV; п = 1) катионов.
Ввиду подобия ![]() электронных
оболочек соединений II-IV и бензола они,
как и высшие циклические полиены - [10],
[14], [18]аннулены (V-VII), рассматриваются
как ароматические системы.
электронных
оболочек соединений II-IV и бензола они,
как и высшие циклические полиены - [10],
[14], [18]аннулены (V-VII), рассматриваются
как ароматические системы.
Электронное строение бензола.
Каждый
атом углерода в молекуле бензола
находится в состоянии sp2-гибридизации.
Он связан с двумя соседними атомами
углерода и атомом водорода тремя
σ-связями. В результате образуется
плоский шестиугольник: все шесть атомов
углерода и все σ-связи С—С и С—Н лежат
в одной плоскости. Электронное облако
четвертого электрона (р-электрона), не
участвующего в гибридизации, имеет
форму гантели и ориентировано
перпендикулярно к плоскости бензольного
к ольца.
Такие р-электронные облака соседних
атомов углерода перекрываются над и
под плоскостью кольца . В результате
шесть р-электронов образуют общее
электронное облако и единую химическую
связь для всех атомов углерода. Две
ольца.
Такие р-электронные облака соседних
атомов углерода перекрываются над и
под плоскостью кольца . В результате
шесть р-электронов образуют общее
электронное облако и единую химическую
связь для всех атомов углерода. Две
 области
большой электронной плоскости расположены
по обе стороны плоскости σ-связей .
области
большой электронной плоскости расположены
по обе стороны плоскости σ-связей .
-Электронное облако обусловливает сокращение расстояния между атомами углерода. В молекуле бензола они одинаковы и равны 0,14 нм. В случае простой и двойной связи эти расстояния составили бы соответственно 0,154 и 0,134 нм. Значит, в молекуле бензола нет простых и двойных связей. Молекула бензола - устойчивый шестичленный цикл из одинаковых СН-групп, лежащих в одной плоскости. Все связи между атомами углерода в бензоле равноценны, чем и обусловлены характерные свойства бензольного ядра. Наиболее точно это отражает структурная формула бензола в виде правильного шестиугольника с окружностью внутри (I). (Окружность символизирует равноценность связей между атомами углерода.) Однако часто пользуются и формулой Кекуле с указанием двойных связей (II):

Химические свойства бензола
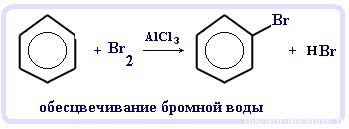
Реакции замещения в бензольном кольце проходят в присутствии катализаторов: солей Al(3+) или Fe(3+):
Реакция галогенирования бензола (взаимодействие с бромом - обесцвечивание бромной воды - качественная реакция на бензол):
C6H6 + Br2 = C6H5Br + HBr
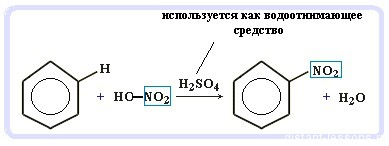
Нитрование бензола (обратите внимание, в органической химии неорганические кислоты реагируют немнго по-другому - с отщиплением группы -OH):
C6H6 + HO-NO2 → C6H5NO2 + H2O
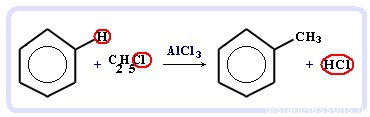
Алкилирование бензола - получение гомологов бензола, алкилбензолов (катализаторы реакции - галогениды алюминия: AlCl3, AlBr3 и т.д.):
С6H6 + С2H5Cl → C6H5C2H5 + HCl
Фенол реагирует с бромом легче чем бензол. Атомы водорода в бензольном ядре в феноле более подвижны, чем в бензоле (реакция бромирования фенола). Причина в наличии гидроксильной группы в молекуле фенола. Притягиваясь к бензольному ядру, р-электроны атома кислорода повышают в нём электронную плотность, особенно в положении 2,4,6. Именно сюда и направляется «атака» брома.
С6Н6 +
Br2 ![]() С6Н5Br
+ НBr
С6Н5Br
+ НBr
C6H5ОН + 3Br2 → C6H2Br3OH + 3HBr.
.
25)
Физические свойства:
Этиленгликоль и пропиленгликоль являются высококипящими жидкостями, глицерин представляет собой очень вязкую жидкость. Многоатомные спирты с количеством гидроксигрупп больше трѐх являются твѐрдыми телами.
Многоатомные спирты прекрасно растворяются в воде. Это обусловлено наличием нескольких полярных групп OH. Водные растворы этиленгликоля не замерзают при очень низкой температуре, поэтому используются как антифризы, которые используются в системах охлаждения двигателей внутреннего сгорания.
Антифризы (от греч. anti — против и англ. freeze — замерзать), водные растворы некоторых веществ (этиленгликоля, глицерина и др.), не замерзающие при низких температурах.
Гликоли являются ядовитыми веществами. Глицерин и другие упомянутые многоатомные спирты не токсичны и усваиваются организмом, включаясь в метаболизм углеводов.
Почти все многоатомные спирты обладают сладким вкусом. Поэтому ксилит и сорбит используются в питании больных диабетом.
Химические свойства:
Многоатомные спирты по химическим свойствам сходны с одноатомными спиртами. Однако в химических свойствах многоатомных спиртов есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют со щелочами, образуя соли. Например, этиленгликоль реагирует не только с щелочными металлами, но и с гидроксидами тяжелых металлов.
По аналогии с алкоголятами соли двухатомных спиртов называются гликолятами, а трехатомных — глицератами.
При взаимодействии этиленгликоля с галогеноводородами (НСl, HBr) одна гидроксильная группа замещается на галоген:

Вторая гидроксогруппа замещается труднее, под действием РСl5.
При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение ярко-синего цвета.
Применение:
Этиленгликоль используется главным образом для производства лавсана и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время).
Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканей и в других областях народного хозяйства. Наиболее важной областью применения глицерина является производство тринитрата глицерина (неверно называемого нитроглицерином) — это сильное взрывчатое вещество, которое взрывается от удара, а также лекарство (сосудорасширяющее средство). Сорбит (шестиатомный спирт) используется как заменитель сахара для больных диабетом.
26)
Углеводороды, содержащие одну двойную углерод-углеродную связь, называются алкенами. Ниже приведены валентные углы, длины связей для этилена:
 .
.

27)
Реакции получения:
1)гидролиз
 .
.
2)
гидратация
 .
.
3)восстановление
кетона .
.
28)
Физические свойства
Мононитросоединения ароматического ряда – жидкие или твердые вещества, имеющие запах горького миндаля. Ядовиты, особенно нитробензол.
Не растворяются в воде. Хорошие растворители.
Химические свойства
1 Восстановление нитросоединений. Химические свойства ароматических нитросoединений определяются нитрогруппой и бензольным кольцом.
При восстановлении нитрогруппа переходит в аминогруппу (– NH2):
С6H5- NO2 + 6[H]= С6H5 – NH2 + 2H2O.
анилин
Впервые нитробензол был восстановлен в анилин с помощью сульфида аммония. Эта реакция была открыта русским химиком Н.Н.Зининым (1842) и носит его имя.
Нитросоединения
с нитрогруппой в боковой цепи при
восстановлении образуют амины с
аминогруппой в боковой цепи:
С6H5
– CH2 – NO2
 С6H5
– CH2 – NH2.
С6H5
– CH2 – NH2.
Бензиламин
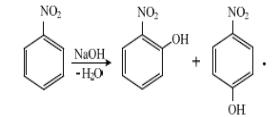
2 Подвижность атома галогена в ароматических нитросоединениях
Если в бензольном кольце в орто– или пара–положении в нитрогруппе находится атом галогена, то он становится настолько подвижным, что может легко замещаться на нуклеофильные агенты:

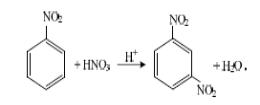
3 Реакции замещения
Нитрогруппа в ядре может проявлять себя по-разному. В реакциях электрофильного замещения нитрогруппа затрудняет вступление нового заместителя в ядро. При этом заместитель становится в мета–положение (мета–ориентация):
В реакциях нуклеофильного замещения нитрогруппа способствует вступлению нового заместителя в ядро, ориентируя его в орто– или пара–положение (орто– и пара–ориентация):
29)

 .
.
Против правила Марковника:
 .
.
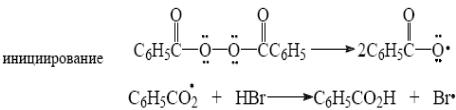
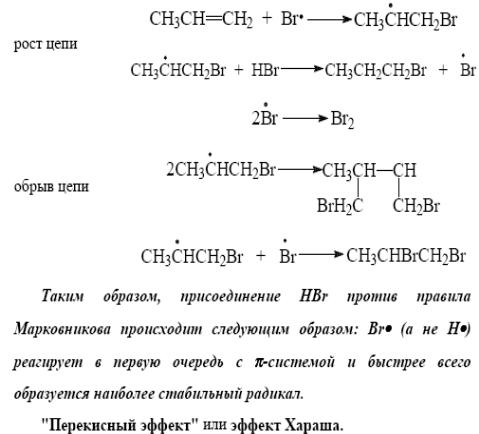
Мягкое окисление:
 .
.
Жесткое окисление:
А)
озонолиз

Б)
 .
.
Реакция
полимеризации: nCH2=CH-(CH2)3-CH3 (-CH2-CH-)n.
(-CH2-CH-)n.
I
(CH2)3-CH3
30) Химические свойства
1. Из-за смещения электронной плотности от гидроксильной группы O–H к сильно поляризованной карбонильной группе C=O молекулы карбоновых кислот способны к электролитической диссоциации: R–COOH=R–COO- + H+. Сила карбоновых кислот в водном растворе невелика.
2. Карбоновые кислоты обладают свойствами, характерными для минеральных кислот. Они реагируют с активными металлами, основными оксидами, основаниями, солями слабых кислот.
2СH3COOH + Mg=(CH3COO)2Mg + H2
2СH3COOH + СaO=(CH3COO)2Ca + H2O
H–COOH + NaOH=H–COONa + H2O
2СH3CH2COOH + Na2CO3=2CH3CH2COONa + H2O + CO2
СH3CH2COOH + NaHCO3=CH3CH2COONa + H2O + CO2
Карбоновые кислоты слабее многих сильных минеральных кислот (HCl, H2SO4 и т.д.) и поэтому вытесняются ими из солей: СH3COONa + H2SO4(конц.) ––t°® CH3COOH + NaHSO4
3. Образование функциональных производных: a) при взаимодействии со спиртами (в присутствии концентрированной H2SO4) образуются сложные эфиры. Образование сложных эфиров при взаимодействии кислоты и спирта в присутствии минеральных кислот называется реакцией этерификации (ester с латинского "эфир"). Данную реакцию рассмотрим на примере образования метилового эфира уксусной кислоты из уксусной кислоты и метилового спирта:
CH3– –OH(уксусная кислота) + HO–CH3(метиловый спирт)=CH3– –OCH3(метиловый эфир уксусной кислоты) + H2O.
Общая формула сложных эфиров R– –OR’ где R и R' – углеводородные радикалы: в сложных эфирах муравьиной кислоты – формиатах –R=H.
Обратной реакцией является гидролиз (омыление) сложного эфира:
CH3– –OCH3 + HO–H=CH3– –OH + CH3OH
Как видно, процесс этерификации обратимый:
CH3– –OH + HO–CH3 =CH3– –OCH3 + H2O, поэтому при наступлении химического равновесия в реакционной смеси будут находиться как исходные, так и конечные вещества. b) при воздействии водоотнимающих реагентов в результате межмолекулярной дегидратации образуются ангидриды
CH3– –OH + H–O– –CH3 ––(P2O5)® CH3– –O– –CH3 + H2O
c) при обработке карбоновых кислот пятихлористым фосфором получают хлорангидриды
CH3– –OH + PCl5 ® CH3– –Cl + POCl3 + HCl
Гидролиз всех функциональных производных карбоновых кислот (ангидридов, хлорангидридов, сложных эфиров и др.) приводит в кислой среде к исходным карбоновым кислотам, а в щелочной среде – к их солям.
4. Галогенирование. При действии галогенов (в присутствии красного фосфора) образуются a-галогензамещённые кислоты:
|
a |
CH3–CH2–COOH ––Br2;(P)® CH3– |
CH–COOH(a-бромпропионовая кислота(2-бромпропановая кислота)) + HBr I Br |
a- Галогензамещённые кислоты – более сильные кислоты, чем карбоновые, за счёт -I эффекта атома галогена.
32)
Дегидрирование
алкана:

Дегидратация:

Дегидрогалогенирование: .
.
33)
Лабораторные
методы получения спиртов
1.
Гидролиз галогеналканов в водных
растворах щелочей происходит
по механизму нуклеофильного замещения
(см. лекцию №12)
![]() 2.
Гидратация алкенов
Присоединение
воды к алкену протекает в присутствии
кислотных катализаторов (H2SO4,
H3PO4,
оксид алюминия и другие носители,
обработанные кислотами).
2.
Гидратация алкенов
Присоединение
воды к алкену протекает в присутствии
кислотных катализаторов (H2SO4,
H3PO4,
оксид алюминия и другие носители,
обработанные кислотами).
![]() Этим
методом в крупных масштабах получают
низшие спирты, из них важнейшим продуктом
является этанол:
Этим
методом в крупных масштабах получают
низшие спирты, из них важнейшим продуктом
является этанол:
![]() из
пропилена и н-бутилена
- изопропиловый и н-бутиловый
спирты:
из
пропилена и н-бутилена
- изопропиловый и н-бутиловый
спирты:
![]()
![]() а
из изобутилена - трет-бутиловый
спирт:
а
из изобутилена - трет-бутиловый
спирт:
 Электрофильный
механизм гидратации уже рассматривался
ранее. Присоединение протекает по
правилу марковникова, реакционная
способность алкенов определяется
сравнительной стабильностью образующихся
карбокатионов и изменяется в ряду:
Электрофильный
механизм гидратации уже рассматривался
ранее. Присоединение протекает по
правилу марковникова, реакционная
способность алкенов определяется
сравнительной стабильностью образующихся
карбокатионов и изменяется в ряду:
![]() 3.
Восстановление карбонильных соединений
(кетонов и альдегидов), сложных
эфиров
Альдегиды
и кетоны легко восстанавливаются
водородом в присутствии катализаторов
(например, Ni, Pd, Pt) в соответствующие
первичные и вторичные спирты:
3.
Восстановление карбонильных соединений
(кетонов и альдегидов), сложных
эфиров
Альдегиды
и кетоны легко восстанавливаются
водородом в присутствии катализаторов
(например, Ni, Pd, Pt) в соответствующие
первичные и вторичные спирты:

 Для
восстановления карбонильной группы
также широко используются комплексные
гидриды металлов - боргидрид натрия
NaBH4(растворитель
- вода, этанол) или алюмогидрид лития
LiAlH4 (растворитель
- абсолютный эфир). Карбонильные соединения
также можно восстанавливать атомарным
водородом, образующимся при взаимодействии
металлического натрия с этиловым
спиртом.
4.
Синтезы спиртов с использованием
реактивов Гриньяра
При
взаимодействии реактивов Гриньяра
(RMgHal) и литийорганических соединений с
карбонильными производными образуются
алкоголяты металлов, которые при действии
воды или разбавленной кислоты можно
превратить в соответствующие спирты.
Взаимодействие реактивов гриньяра с
формальдегидом, другими альдегидами и
кетонами представляет собой прекрасный
способ получения первичных, вторичных
и третичных спиртов:
Для
восстановления карбонильной группы
также широко используются комплексные
гидриды металлов - боргидрид натрия
NaBH4(растворитель
- вода, этанол) или алюмогидрид лития
LiAlH4 (растворитель
- абсолютный эфир). Карбонильные соединения
также можно восстанавливать атомарным
водородом, образующимся при взаимодействии
металлического натрия с этиловым
спиртом.
4.
Синтезы спиртов с использованием
реактивов Гриньяра
При
взаимодействии реактивов Гриньяра
(RMgHal) и литийорганических соединений с
карбонильными производными образуются
алкоголяты металлов, которые при действии
воды или разбавленной кислоты можно
превратить в соответствующие спирты.
Взаимодействие реактивов гриньяра с
формальдегидом, другими альдегидами и
кетонами представляет собой прекрасный
способ получения первичных, вторичных
и третичных спиртов:
 ^ Промышленные
методы получения спиртов
1.
Окисление алканов (синтез
спиртов С10-С20).
Спирты нормального строения
С10-С20 представляют
интерес в качестве сырья для синтеза
поверхностно-активных веществ.
Производство этих спиртов путем окисления
парафина по методу А.Н. Башкирова было
впервые разработано и реализовано в
СССР. Окисление ведут кислородом воздуха
в присутствии 4-5% борной кислоты, которая
связывает образующиеся спирты в эфиры,
не подвергающиеся дальнейшему
окислению:
^ Промышленные
методы получения спиртов
1.
Окисление алканов (синтез
спиртов С10-С20).
Спирты нормального строения
С10-С20 представляют
интерес в качестве сырья для синтеза
поверхностно-активных веществ.
Производство этих спиртов путем окисления
парафина по методу А.Н. Башкирова было
впервые разработано и реализовано в
СССР. Окисление ведут кислородом воздуха
в присутствии 4-5% борной кислоты, которая
связывает образующиеся спирты в эфиры,
не подвергающиеся дальнейшему
окислению:
![]() Полученные
спирты, образующиеся без деструкции
углеродной цепи, являются преимущественно
вторичными, с примесью гликолей и
кетоспиртов.
Эта фракция как сырье
для ПАВ имеет небольшую ценность, и
метод широкого распространения не
получил.
2.
Синтез спиртов по методу Фишера-Тропша.
При высоком давлении СО и Н2 образует
смесь кислородсодержащих соединений
(синтол) - спиртов, альдегидов, кетонов,
карбоновых кислот и сложных эфиров.
Этот метод нашел широкое применение
для синтеза метанола:
Полученные
спирты, образующиеся без деструкции
углеродной цепи, являются преимущественно
вторичными, с примесью гликолей и
кетоспиртов.
Эта фракция как сырье
для ПАВ имеет небольшую ценность, и
метод широкого распространения не
получил.
2.
Синтез спиртов по методу Фишера-Тропша.
При высоком давлении СО и Н2 образует
смесь кислородсодержащих соединений
(синтол) - спиртов, альдегидов, кетонов,
карбоновых кислот и сложных эфиров.
Этот метод нашел широкое применение
для синтеза метанола:
![]() 3.
Процесс оксосинтеза.
Реакция открыта Реленом в 1938 г. Назначение
процесса – получение из алкенов и
синтез-газа (СО+Н2)
альдегидов и их гидрирование до
спиртов:
3.
Процесс оксосинтеза.
Реакция открыта Реленом в 1938 г. Назначение
процесса – получение из алкенов и
синтез-газа (СО+Н2)
альдегидов и их гидрирование до
спиртов:
![]() Первичные
спирты С10-С18 линейного
строения являются сырьем для производства
ПАВ типа алкилсульфатов, которые
отличаются высоким индексом
биоразлагаемости, спирты С7-С9 служат
полупродуктами для получения сложноэфирных
пластификаторов, особенно фталатов.
Первичные
спирты С10-С18 линейного
строения являются сырьем для производства
ПАВ типа алкилсульфатов, которые
отличаются высоким индексом
биоразлагаемости, спирты С7-С9 служат
полупродуктами для получения сложноэфирных
пластификаторов, особенно фталатов.
34)

В случае вторичных и первичных алкилгалогенидов, как правило, реакция идёт как бимолекулярное нуклеофильное замещение SN2: !!!!(вместо ОН- поставьте NH2)

SN2 реакции являются синхронными процессами – нуклеофил (в данном случае OH-) атакует атом углерода, постепенно образуя с ним связь; одновременно с этим постепенно разрывается связь С-Br. Уходящий из молекулы субстрата бромид-ион в называется уходящей группой или нуклеофугом.
Если взять 2-бром-2-метилаклкан, то скорость будет меньше, т.к. 2-бром-2-метилалкан менее активный субстрат чем 1-бромалкан.
35)
Физические свойства фенола: На открытом воздухе в процессе окисления эти кристаллы приобретают розоватый цвет. Пахнет фенол гуашью. Может растворяться в: воде (в соотношении: 100 г воды / 6 г вещества); щелочах; бензоле; ацетоне; спирте.
Химические свойства фенолов. 1. Реакции замещения атома водорода в ОН-группе. При действии на фенолы щелочей образуются феноляты (рис. 5А), каталитическое взаимодействие со спиртами приводит к простым эфирам (рис. 5Б), а в результате реакции с ангидридами или хлорангидридами карбоновых кислот образуются сложные эфиры (рис. 5В). При взаимодействии с аммиаком (повышенная температура и давление) происходит замена ОН-группы на NH2, образуется анилин, (рис. 5Г), восстанавливающие реагенты превращают фенол в бензол (рис. 5Д)
1)
 2)
2)

2. Реакции замещения атомов водорода в бензольном кольце.
При галогенировании, нитровании, сульфировании и алкилировании фенола атакуются центры с повышенной электронной плотностью, т.е. замещение проходят преимущественно в орто- и пара-положениях.
При более глубоком протекании реакции происходит замещение двух и трех атомов водорода в бензольном кольце.
Особое значение имеют реакции конденсации фенолов с альдегидами и кетонами, по существу, это алкилирование, проходящее легко и в мягких условиях (при 40–50° С, водная среда в присутствии катализаторов), при этом атом углерода в виде метиленовой группы СН2 или замещенной метиленовой группы (CНR либо CR2) встраивается между двумя молекулами фенола. Часто такая конденсация приводит к образованию полимерных продуктов

Двухатомный фенол (торговое название бисфенол А), используют в качестве компонента при получении эпоксидных смол. Конденсация фенола с формальдегидом лежит в основе производства широко применяемых феноло-формальдегидных смол (фенопласты).
Способы получения фенолов.
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь). Промышленный способ получения самого фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4 (рис. 8А). Реакция проходит с высоким выходом и привлекательна тем, что позволяет получить сразу два технически ценных продукта – фенол и ацетон. Другой способ – каталитический гидролиз галогензамещенных бензолов.
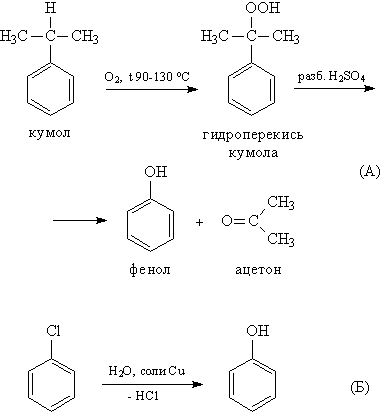
Применение фенолов.
Раствор фенола используют в качестве дезинфицирующего средства (карболовая кислота). Двухатомные фенолы – пирокатехин, резорцин, а также гидрохинон (пара-дигидроксибензол) применяют как антисептики (антибактериальные обеззараживающие вещества), вводят в состав дубителей для кожи и меха, как стабилизаторы смазочных масел и резины, а также для обработки фотоматериалов и как реагенты в аналитической химии.
В виде отдельных соединений фенолы используются ограниченно, зато их различные производные применяют широко. Фенолы служат исходными соединениями для получения разнообразных полимерных продуктов – феноло-альдегидных смол, полиамидов, полиэпоксидов. На основе фенолов получают многочисленные лекарственные препараты, например, аспирин, салол, фенолфталеин, кроме того, красители, парфюмерные продукты, пластификаторы для полимеров и средства защиты растений.
37)
СН3-СН(Cl)-CH2-CH2-CH3 + НOH CH3-CH(OH)-CH2-CH2-CH3 + НCl
Механизм SN1-реакции гидролиза
38)
Галогенирование алканов. Галогенирование (замещение галогеном) - важнейшая реакция алканов В качестве галогенирующих агентов можно применять не только хлор, но и бром. Йод не способен к реакции прямого замещения водорода, фтор действует слишком энергично, если не принять особых мер со свободным фтором реакция идет со взрывом.
![]()
Скорость галогенирования резко снижается в ряду:F>Cl>Br>I. Хлор реагирует с предельными углеводородами только под влиянием света, нагревания (300 оС) или в присутствии катализаторов, причем последовательно замещаются хлором все атомы водорода:
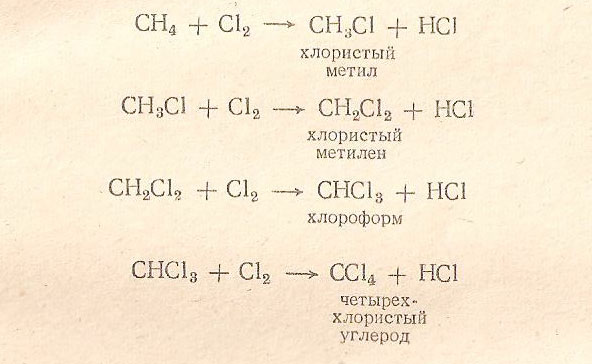
Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на галоген.
Галогенирование алкенов. Олефины легко присоединяют галогены. При этом образуются вицинальные галогенопроизводные: CH3-CH=CH2+Cl2→CH3-CHCl-CH2Cl (1,2-дихлорпропан).
Легче идет присоединение хлора, труднее - йода. Реакции обычно проходят в газовой фазе или с растворами алкенов в четыреххлористом углероде или хлороформе.
Алкены реагируют с бромом и хлором с образованием продуктов присоединения по двойной связи одной молекулы галогена с выходом, близким к количественному. Фтор слишком активен и даже при низкой температуре вызывает деструкцию алкенов. Присоединение йода к алкенам в большинстве случаев представляет собой обратимую реакцию, равновесие которой смещено в сторону исходных реагентов.
![]()
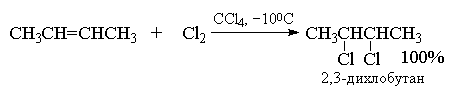
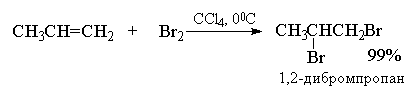
Галогенирование алкинов. Реакция протекает медленнее, чем для алкенов. Обесцвечивание бромной воды - качественная реакция на кратную связь:
![]()
При действии хлора образуются 1,2 дихлорэтен ClCH=CHCl и затем 1,1,2,2-тетрахлорэтен Cl2CH-CHCl2. Присоединение галогенов(хлора, брома, йода)к ацетиленам также идет с меньшей скоростью, чем к олефинам.
Галогенирование диеновых углеводородов. Галогены также способны присоединяться к сопряженным системам в 1, 2- и 1, 4-положения, причем количество 1, 4-продукта зависит от строения диенового углеводорода, природы галогена и условий реакции. Выход продукта 1, 4-присоединения возрастает при повышении температуры(до известного предела) и при переходе от хлора к йоду:
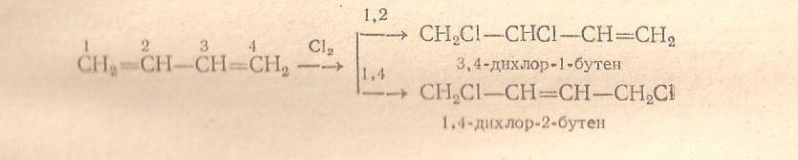
Галогенирование ароматических углеводородов. Прямое воздействие галогенов на ароматические углеводороды. Галогены могут реагировать с ароматическим углеводородом тремя путями: а) присоединяться к двойным связям бензольного кольца, б) замещать водородный атом бензольного кольца с образованием гологенарила, в) замещать водородный атом в алкильной группе боковой цепи с образованием арилалкилгалогенида.
Реакция присоединения галогена была рассмотрена выше. При действии на ароматические углеводороды галогенов (хлор, бром) на холоду в присутствии катализаторов происходит замещение водородных атомов в ядре с выделением галогеноводородов:
![]()
Катализатором при этом является хлорид или бромид железа. В качестве катализаторов могут быть также использованы и другие хлориды металлов, такие, как AlCl3, SbCl3, SbCl5, а также йод.
В боковую цепь можно ввести галоген (правило Ф.Ф. Бейльштейна ) на свету, при нагревании и в отсутствие катализаторов. Механизм замещения в этом случае радикальный. В случае толуола * эти превращения могут быть выражены схемой:

При введении в ядро бензола йода необходимо присутствие окислителей, которые окисляют образующуюся йодистоводородную кислоту и тем препятствуют ее восстанавливающему действию, а возможно окисляют и йод до йодноватистой кислоты, которая, видимо, более энергично действует на бензол.
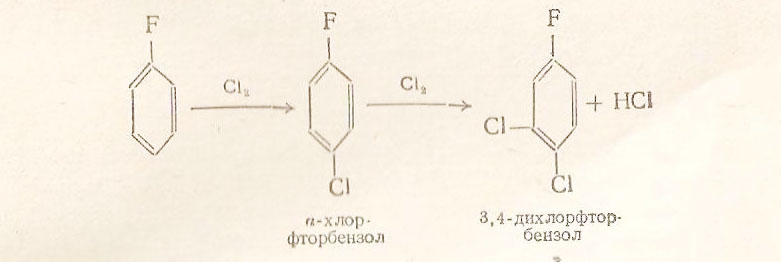
Галогены относятся к заместителям первого рода и потому при галогенировании бензола второй атом галогена вступает преимущественно в пара-положение к первому. Однако галогены, в отличие от других заместителей первого рода, затрудняют замещение(по сравнению с бензолом).
При хлорировании -фторхлорбензола третий атом галогена вступает в о-положение к хлору, а не к фтору. Следовательно, решающее действие на порядок замещения оказывает индукционный эффект галогена(о-положение к атому фтора имеет больший положительный заряд, так как –IF>-ICl) :
Галогенирование спиртов. Гидроксильная группа спиртов может быть замещена на галоген действием на них галогенводородных кислот, галогенных соединений фосфора или тионилхлорида. Реакция спиртов с галогеноводородами обратима:R – OH+ HCl ↔RCl + HOH.
Реакцию галогеноводорода со спиртами часто проводят так, что галогеноводород образуется непосредственно в реакционной среде, например при нагревании спирта с бромидом натрия и серной кислотой:C2H5OH +NaBr +H2SO4→C2H5Br +NaHSO4 H2O.
При реакции спиртов с галогенидами фосфора в качестве побочного продукта получается эфир фосфористой кислоты P(OR)3: 3R-OH +PCl3→3R-Cl+P(OH)3; 3R-OH +PCl3→P(OR)3 +3HCl.
В случае применения PCl5 последний переходит в хлорокись фосфора, например: C2H5OH+PCl5→C2H5Cl+POCl3+HCl.
Реакция с тионилхлоридом идет с образованием алкилхлорида, хлористого водорода и двуокиси серы: C2H5OH +SOCl2→C2H5OSOCl+HCl→C2H5Cl+SO2+HCl.
Галогенирование одноосновных кислот. Галогенозамещенные карбоновые кислоты можно рассматривать как продукты замещения водородных атомов углеводородного радикала карбоновой кислоты атомами галогенов. В соответствии с этим могут существовать моно-и полигалогенозамещенные кислоты.
При действии галогенидов фосфора на органические кислоты происходит образование галогенангидридов кислот. При этом, как и в случае спиртов, гидроксил замещается галогеном, например:
![]()
Хлорангидриды кислот могут быть получены также действием на органические кислоты хлористого тионила:
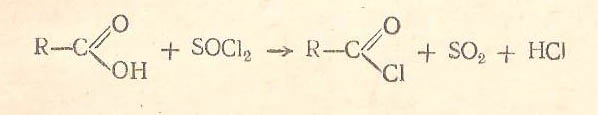
39)
CH4 + Cl2 = CH3Cl + HCl
Реакция галогенирования имеет цепной свободно-радикальный характер. Реакция образования хлорметана протекает по цепному механизму, который характеризуется следующими стадиями:
а)
инициирование цепи:
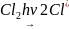
б) Рост цепи. Радикал хлора отнимает у молекулы алкана атом водорода: Cl*+ СН4→НСl + СН3 *
При этом образуется алкильный радикал, который отнимает атом хлора у молекулы хлора:
СН3*+ Сl2→СН3Сl + Сl*
Эти реакции повторяются до тех пор, пока не произойдет обрыв цепи по одной из реакций:
Cl* + Cl* → Сl2, СН3* + СН3* → С2Н6, СН3* + Cl* → СН3Сl*
Суммарное
уравнение реакции:

Образующийся хлорметан может подвергаться дальнейшему хлорированию, давая смесь продуктов CH2Cl2, CHCl3, ССl4 по схеме (*).
40)
Алкилированием называют реакции, приводящие к замещению водорода гидроксильной, карбоксильной или аминогруппы на алкильную группу.
Простые эфиры могут быть получены в результате отщепления молекулы воды от двух молекул спирта путем нагревания его с концентрированной серной кислотой: R-OH + HO-R а R-O-R + H2O.
Более общим способом превращения гидроксильных соединений в простые эфиры является взаимодействие алкоголятов с галоидными алкилами: R-ONa + R'I а R-O-R' + NaI.
Еще примером является алкилирование бензола н-пропилхлоридом, где получается смесь н-пропил- и изопропилбензолов, в которой изомеризованный продукт оказывается доминирующим.

Алкилирование алканов алкенами рассматривают как электрофильное присоединение по двойной связи.

Реакция идет при высокой температуре под давлением (400-500°С, 30 МПа).
Алкилирование алканов и алкинов алкилгалогенидами (нуклеофильное замещение):

41)
Химические свойства алкилбензолов
Реакции замещения алкилбензолов: во-первых, гомологи бензола более ракционноспособны - легче вступают в реакции, во-вторых, эти реакции идут немного по-другому:
Галогенирование алкилбензолов: С6H5-CH3 + Br2 (на свету) = С6H5-CH2Br + HBr
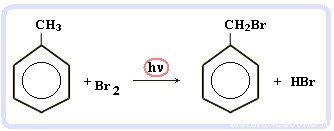
Т.е. бром идет в боковую цепь, а не в кольцо.
Чтобы бром пошел в кольцо, надо использовать катализатор - соли Al(3+)
Нитрование алкилбензолов:С6H5-CH3 + 3HNO3 → C6H2CH3(NO2)3
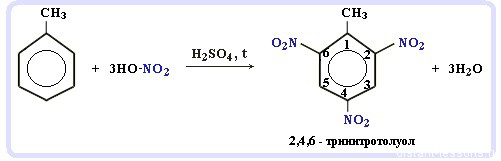
тринитротолуол, он же тротил
Окисление: реакция, характерная для алкилбензолов и не характерная для самого бензола
С6H5CH3 + [O] → C6H5COOH - бензойная кислота

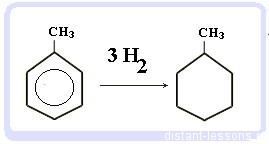
Гидрирование бензола и алкилбензолов:
Тут уже различий нет. при гидрировании всех аренов (температура, давление, катализатор - бензольное кольцо разорвать не так уж и просто) получаются циклоалканы, а точнее, циклогексан и циклогексан с радикалами:
С6H6 + 3 H2 → C6H12 циклогексан
С6H5CH3 + 3 H2 → C6H11-CH3 - метилциклогексан
Реакция горения: все органические вещества горят с образованием углекислого газа CO2 и воды H2O:
CnH2n-6 + (3n-3)\2 O2 → nCO2 + (n-3)H2O
Физические свойства. Первые члены гомологического ряда бензола (например, толуол, этилбензол и др.) — бесцветные жидкости со специфическим запахом. Они легче воды и нерастворимы в ней. Хорошо растворяются в органических растворителях. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Получение кумола(изопропилбензола): Алкилирование собственно бензола галогенопроизводными (реакция Фриделя-Крафтса) или олефинами.
|
+ CН3- |
СН-Сl I CH3 |
––AlCl3® |
|
CH-CH3 I + HCl CH3 изопропил- бензол |
!!!!!!!!!!!!химичске свойства кумола такие же как и алкилбензола.
42)
Физические свойства. Низшие кетоны – жидкости, легко растворимые в воде. В основном, кетоны обладают приятным запахом, напоминающим запах цветов. Как и альдегиды, кетоны кипят при более низкой температуре, чем соответствующие спирты, однако выше, чем углеводороды.
Химические свойства. Как и альдегиды, кетоны характеризуются высокой реакционной способностью. Химическая активность альдегидов и кетонов тем выше, чем больше положительный заряд на атоме углерода карбонильной группы. Радикалы, увеличивающие этот положительный заряд, резко повышают реакционную способность альдегидов и кетонов, а радикалы, уменьшающие поло-жительный заряд, оказывают противоположное действие. В кетонах две алкильные группы являются электронодонорными, откуда становится понятным, почему кетоны менее активны в реакциях нуклеофильного присоединения по сравнению с альдегидами. Приводя некоторые примеры реакций нуклеофильного присоединения по карбонильной группе кетонов, уделим внимание лишь отличиям их химических свойств от альдегидов. 1. Присоединение синильной кислоты.
R \ C=O(кетон) + H– CN –KCN® CH3– / R’ |
OH I C–CN(нитрил a-оксиизомасляной кислоты) I CH3 |
2. Присоединение гидросульфита натрия.
R \ C=O(кетон) + HSO3Na ® R– / R’ |
OH I C–SO3Na(гидросульфитное производное кетона) I R’ |
Следует отметить, что в реакцию с гидросульфитом натрия вступают только метилкетоны, т. е. кетоны, имеющие группировку CH3.
3. По сравнению с альдегидами для кетонов не характерны реакции со спиртами. 4. Присоединение водорода. Присоединение водорода к кетонам приводит к образованию вторичных спиртов.
R \ C=O(кетон) + H2 –Ni® / R’ |
R \ CH–OH(вторичный спирт) / R’ |
5. Кетоны окисляются значительно труднее, чем альдегиды. Кислород воздуха и слабые окислители не окисляют кетоны. Кетоны не дают реакции "серебряного зеркала" и не реагируют с гидроксидом меди (II). При действии сильных окислителей в жестких условиях углеродная цепь молекулы кетона разрушается рядом с карбонильной группой и образуются кислоты (иногда кетоны в зависимости от строения исходного кетона) с меньшим числом атомов углерода.
|
|
|
43)
Механизм SN2-реакции щелочного гидролиза:
СН3 – СН(I) – CH2 – CH2 – CH3 + NaOH → СН3 – СН(OH) – CH2 – CH2 – CH3 + NaCl
44)
Физические свойства
ТОЛУОЛ (метилбензол)
С6Н5СН3,
мол. м. 92,14; бесцв. жидкость с
ароматич. запахом; т. пл. — 94,99 °С, т. кип.
110,62 °С; ![]() 0,8669;
0,8669; ![]() 1,49693;
tкрит 318,64
°С, pкрит4,109
МПа; h 0,584 мПа· с (20 °С); g 28,5
мН/м (20 °С); ур-ние температурной
зависимости давления пара: Igp (МПа)
= 3,075 - 1343,94(t + 219,38);
1,49693;
tкрит 318,64
°С, pкрит4,109
МПа; h 0,584 мПа· с (20 °С); g 28,5
мН/м (20 °С); ур-ние температурной
зависимости давления пара: Igp (МПа)
= 3,075 - 1343,94(t + 219,38);![]() 0,1049
кДж/(моль·К);
0,1049
кДж/(моль·К); ![]() 6,62
кДж/моль,
6,62
кДж/моль, ![]() 37,99
кДж/моль,
37,99
кДж/моль,![]() —12
кДж/моль,
—12
кДж/моль, ![]() —
3916 кДж/моль,
—
3916 кДж/моль, ![]() (газ) 319,7
Дж/(моль·К). Смешивается
со спиртами,углеводородами, хорошо
раств. в большинстве орг. р-рителей;
р-римость в воде 0,014% по массе (20
°С); р-римость воды в толуоле 0,4%
(20 °С). Образует азеотропные смеси:
с водой (86,5% толуола по массе, т.
кип. 84,1°С), метанолом (31% толуола,
63,8 °С), уксусной к-той (72,5% толуола, 100,6
°С) и др.
(газ) 319,7
Дж/(моль·К). Смешивается
со спиртами,углеводородами, хорошо
раств. в большинстве орг. р-рителей;
р-римость в воде 0,014% по массе (20
°С); р-римость воды в толуоле 0,4%
(20 °С). Образует азеотропные смеси:
с водой (86,5% толуола по массе, т.
кип. 84,1°С), метанолом (31% толуола,
63,8 °С), уксусной к-той (72,5% толуола, 100,6
°С) и др.
Химические свойства
Все свойства толуола можно разделить на 2 типа:
А) реакции, затрагивающие бензольное кольцо,
Б) реакции, затрагивающие метильную группу.
Реакции в ароматическом кольце. Метилбензол вступает во все реакции электрофильного
замещения, свойственные для бензола.
1) Нитрирование:

1-Метил-2-нитробензол 1-Метил-4-нитробензол
(!!!!!!!!!Здесь вместо бензола напишит толуол в исх веществах, продукты ракции написаны правильно)
2) Хлорирование толуола может производиться путём пропускания через
толуол газообразного хлора в присутствии хлорида алюминия (реакция проводится
в темноте). Хлорид алюминия играет при этом роль катализатора. В этом случае
образуется 2- и 4-замещённый изомеры:
|
|
|
|
3) Сульфирование метилбензола концентрированой серной кислотой тоже приводит
к образованию смеси 2- и 4-замещённого изомеров:
|
|
|
|
Реакции в боковой цепи. Метильная группа в метилбензоле может вступать в
определённые реакции, характерные для алканов, но также и в другие реакции, не
характерные для алканов.

Дальнейшее галогенирование приводит к образованию следующих соединений (на рисунке)
Бромирование метилбензола осуществляется при аналогичных условиях и приводит
к образованию соответствующих бромозамещающенных соединений.
Метильная боковая цепь в толуоле подвергается окислению даже такими
сравнительно мягкими окислителями, как оксид марганца (IV):
|
|
|
|
Более сильные окислители, например перманганат калия, вызывают дальнейшее
окисление:

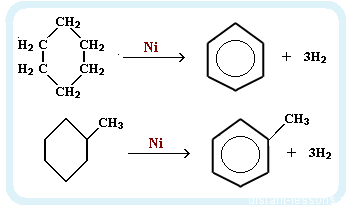
получение бензола
Ароматизация нефти. Точнее, это реакция циклизации гексана. Называется метод "ароматизация нефти", т.к. из нее получают гексан:

Обратите внимание на условия реакции - давление, температуру и катализатор. Они означают, что при обычных условиях гексан не вступит в такую реакцию. Алканы вообще довольно нереакционноспособные вещества.
Дегидрирование циклогексана: этот метод хорошо тем, что можно получить не только бензол, но и его гомологи. Для этого надо взять циклогексан с нужным количеством атомов С в боковой цепи
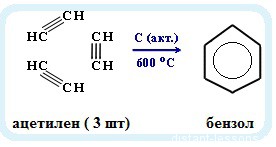
Именная реакция - реакция Зелинского. Получение бензола из ацетилена:
Области применения бензола
Бензол – один из наиболее распространенных химических продуктов и самое распространенное ароматическое соединение. В физическом весе пластмасс около 30%, в каучуках и резинах – 66%, в синтетических волокнах – до 80% приходится на ароматические углеводороды, родоначальником которых является бензол.
Основные области применения бензола - производство этилбензола, кумола и циклогексана. На долю этих продуктов приходится около 70% мирового потребления бензола. Этилбензол является важным нефтехимическим продуктом, основной объем которого используются для производства стирола. Наиболее значимыми продуктами, в производстве которых используется фенол, является бисфенол-А и фенолформальдегидные смолы. Циклогексан используется в качестве сырья для получения капролактама, растворителя. Капролактам в свою очередь применяется для производства термопластичных смол (полиамид 6), капроновых волокон и нитей. Нитробензол является полупродуктом для получения анилина.
Бензол также используется для получения анилина, малеинового ангидрида, является сырьем для производства синтетических волокон, каучуков, пластмасс. Бензол применяется как компонент моторного топлива для повышения октанового числа, как растворитель и экстрагент в производстве лаков, красок, поверхностно-активных веществ.
45)
 .
!!!!!Вместо R-Hal
подставьте 2-бром-метилалкан.
.
!!!!!Вместо R-Hal
подставьте 2-бром-метилалкан.
Если взять 1-бром алкан, то скорость реакции уменьшится.
Если взять 2-иод-2-метилалкан, то скорость реакции увеличится.
46)
Химические свойства альдегидов и кетонов определяются особенностями карбонильной группы >C=O, обладающей полярностью – электронная плотность между атомами С и О распределена неравномерно, сдвинута к более электроотрицательному атому О. В результате карбонильная группа приобретает повышенную реакционную способность, что проявляется в разнообразных реакциях присоединения по двойной связи. Во всех случаях кетоны менее реакционноспособны, чем альдегиды, в частности, из-за пространственных затруднений, создаваемых двумя органическими группами R, наиболее легко участвует в реакциях формальдегид Н2С=О.
Присоединение циановодородной (синильной) кислоты HCN:

Эта реакция используется для удлинения углеродной цепи, а также для получения α-гидроксикислот R-CH(COOH)OH по схеме: R-CH(CN)OH + H2O R-CH(COOH)OH + NH3.
Механизм: Атака карбонильной группы нуклеофилом может происходить снизу или сверху плоского фрагмента молекулы:

Присоединение R-MgHal к формальдегиду приводит к образованию первичных спиртов:

Из альдегидов получаются вторичные спирты:

Присоединением молекулы кислого сернистокислого натрия (бисульфита) получаются так называемые бисульфитные соединения, причем водород присоединяется к кислороду карбонильной группы, а остаток SO2ONa — к углеродному атому:
![]()
Получение:

 a)
a)





