
- •Для студентов очной и заочной форм обучения Минск 2003
- •Введение
- •Протокол работы должен включать:
- •Правила работы в химической лаборатории
- •Запрещается:
- •Лабораторная работа № 1 Исследование соли карбоната кальция
- •Количество вещества эквивалентов nэ(в) (единица – моль) равно произведению числа эквивалентности zb на количество вещества nB:
- •Mэ(СаСо3) Vэ(co2) Vo(co2)
- •Лабораторная работа № 2 Способы выражения состава растворов
- •Цель работы:
- •Лабораторная работа № 3 Энергетика химических процессов
- •Цель работы
- •Выполнение опыта (опыт выполняют 2 студента)
- •Наблюдения и выводы
- •Выполнение опыта
- •Наблюдения и выводы
- •Лабораторная работа №4 Химическая кинетика и равновесие
- •Цель работы
- •Лабораторная работа № 5 Определение температуры замерзания антифриза
- •Наблюдения и выводы
- •Лабораторная работа № 6 Химические реакции в растворах электролитов
- •(Полное ионное уравнение) Равновесие реакции сдвигается вправо, если в результате реакции образуются:
- •(Краткое ионно-молекулярное уравнение)
- •Цель работы
- •Выполнение опыта
- •Выполнение опыта в четыре пробирки налить по 20 капель следующих 0,5н. Растворов: сульфата цинка, сульфата аммония, сульфата меди и сульфата марганца.
- •Лабораторная работа № 7 Гидролиз солей
- •Лабораторная работа № 8 Определение жёсткости воды
- •Лабораторная работа № 9 Определение кислотности пищевых продуктов
- •Лабораторная работа № 10 Комплексные соединения и их свойства
- •Лабораторная работа №11 Грубодисперсные и коллоидные системы
- •Лабораторная работа № 12 Окислительно-восстановительные реакции (овр)
- •Лабораторная работа №13 Определение электродных потенциалов металлов
- •Наблюдения и выводы
- •Лабораторная работа № 14 Ряд напряжений. Гальванические элементы (гэ)
- •Наблюдения и выводы
- •Лабораторная работа № 15 Коррозия металлов
- •Лабораторная работа №16 Электролиз водных растворов электролитов
- •Vo (теор.)
- •Лабораторная работа № 17 Нанесение гальванических покрытий
- •Лабораторная работа № 18 Приготовление электролита для свинцового аккумулятора
- •Цель работы
- •Выполнение опыта
- •Лабораторная работа № 19 Свойства свинца и свинцовый аккумулятор
- •Лабораторная работа № 20 Свойства железа и алюминия
- •1. Определение оптической плотности стандартных растворов
- •2. Определение оптической плотности исследуемого раствора
- •Контрольные вопросы к лабораторным работам
- •Литература
Цель работы
Установить зависимость скорости химической реакции от концентрации реагирующих веществ.
Определить влияние концентраций исходных и конечных веществ на смещение равновесия обратимой реакции.
Опыт1. Влияние концентрации реагирующих веществ на скорость химической реакции в гомогенной системе
Взаимодействие тиосульфата натрия с серной кислотой протекает по уравнению:
Na2S2O3(aq) + H2SO4(aq) = Na2SO4(aq) + S(т) + SO2 (г) +H2O(ж) (4.5)
Выполнение опыта
Работу выполняют два студента. Предварительно проделать качественный опыт: в пробирку налить 5–10 капель 1н. раствора тиосульфата натрия Na2S2O3 и добавить 1–2 капли 2н. раствора серной кислоты. Наблюдать появление слабой опалесценции и дальнейшее помутнение раствора от выпавшей свободной серы.
Приготовить три раствора тиосульфата натрия различной концентрации. Для этого в три пробирки внести (рис. 4.1): в первую – 4 капли 1н. раствора тиосульфата натрия и 8 капель воды; во вторую – 8 капель 1н. раствора тиосульфата натрия и 4 капли воды; в третью – 12 капель 1н. раствора тиосульфата натрия.
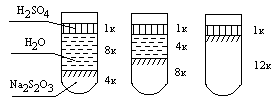
Рис. 4.1. Схема проведения опыта
Таким образом, в одинаковых объемах будет содержаться разное число моль Na2S2O3. В первую пробирку добавить 1 каплю 2н. раствора серной кислоты и одновременно замерить время, прошедшее от момента добавления кислоты до появления в растворе заметной опалесценции. Также добавить по 1 капле 2н. раствора серной кислоты, по очереди, во вторую и третью пробирки, также замерив время до появления опалесценции.
Данные опыта внести в таблицу 4.1.
Таблица 4.1
№ про-бир-ки |
Объем реагентов V;число капель |
Общий объем рас-твора,Vобщ.,число капель |
Концент-рация раствора Na2S2O3, С;моль/л. |
Время реакции τ; с |
Скорость реакции ; моль/л с |
||
Na2S2O3. 1н. |
H2O |
H2SO4 2н. |
|||||
1 |
4 |
8 |
1 |
13 |
0.25 |
|
|
2 |
8 |
4 |
1 |
13 |
0.5 |
|
|
3 |
12 |
– |
1 |
13 |
1 |
|
|
Наблюдения и выводы
1. Определить скорость реакции в зависимости от концентрации. Указать физический смысл константы скорости данной реакции.
2. По полученным данным построить график зависимости скорости реакции от концентрации: на оси абсцисс откладывать концентрацию, на оси ординат – скорость реакции.
Опыт 2. Влияние изменения концентраций исходных и конечных веществ на равновесие гомогенной химической реакции
Химическое равновесие – это такое состояние системы, при котором скорости прямой и обратной реакций равны.
Для обратимой гомогенной реакции mA + nB ↔ pC + gD (4.6)
константа химического равновесия:
[C]p [D]g
КС = ------------- . (4.7)
[A]m [B]n
В обратимых химических реакциях равновесие устанавливается в тот момент, когда отношение произведения концентраций продуктов, возведенных в степень стехиометрических коэффициентов, к произведению концентраций исходных веществ, также возведенных в соответствующую степень , равно некоторой постоянной величине, называемой константой равновесия.
Константа химического равновесия зависит от природы реагирующих веществ и от температуры. Концентрации реагирующих веществ, при которых устанавливается равновесие, называются равновесными.
Изменение внешних условий (концентрации, температуры, давления) вызывает смещение химического равновесия и переход в новое равновесное состояние. Направление смещения химического равновесия определяется принципом Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, производить какое-либо внешнее воздействие (изменять температуру, давление, концентрацию), то в этой системе самопроизвольно возникают процессы, стремящиеся ослабить произведенное воздействие. Чем больше значение константы равновесия химической реакции, тем больше выход ее продуктов.
Смещение равновесия обратимой реакции между хлоридом железа (III) и роданидом калия KSCN.
Выполнение опыта
В четыре пробирки внести по 5–7 капель разбавленного 0,0025н. раствора хлорида железа (III) – FeCl3 и такое же количество разбавленного раствора роданида калия – KSCN. Одну пробирку с полученным раствором сохранить для сравнения результатов опыта (эталон).
В остальные пробирки добавить следующие реактивы: в первую – одну каплю концентрированного раствора роданида калия, во вторую – одну каплю концентрированного раствора хлорида железа (III), в третью – несколько кристалликов хлорида калия KCl (схема 4.2).
Сравнить интенсивность окраски полученных растворов с интенсивностью окраски эталона.
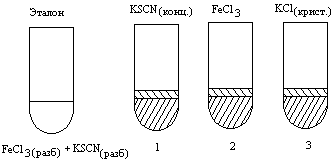
Рис.4.2. Схема опыта
Наблюдения и выводы
1.Составить уравнение соответствующей обратимой реакции.
2.Написать выражение константы равновесия данной реакции, указать её физический смысл.
3.Какие вещества находятся в исследуемом растворе в момент равновесия?
4.Какое вещество придает раствору красную окраску?
5.Как изменяется интенсивность окраски раствора и в каком направлении смещается равновесие данной системы при добавлении:
- концентрированного раствора хлорида железа (III),
- концентрированного раствора роданида калия,
- кристаллов хлорида калия?
6. Проанализируйте смещение равновесия данной реакции, используя выражение константы равновесия и принцип Ле Шателье. Сделайте вывод: соответствуют ли теоретические выводы наблюдениям в опыте?
