
- •2. Кпд процесса движения гжс. Удельный расход газа. Зависимость оптимальной и максимальной подач от относительного погружения подъемника.
- •4. Уравнение баланса давлений в подъемнике. Прямые и обратные задачи при практических расчетах.
- •5 . Плотность идеальной и реальной гжс. Расходное и истинное газосодержание. Положение кривых () для реальной и идеальной гжс.
- •6. Относительная скорость газа и её оценка. Явление скольжения газа.
- •7. Классификация методов расчета газожидкостного потока по моделям течения.
- •8. Последовательность гидравлического расчета движения гжс
- •10. Теоретические основы исследований скважин на неустановившихся режимах. Определение параметров пласта по квд без учета притока (метод Минеева и Хорнера).
- •13.Интегральный метод обработки квд с учетом притока.
- •Порядок обработки кривой реагирования (на логарифмической сетке)
- •16.Расчет ско карбонатных коллекторов (известняк, доломит)
- •Расчет ско для доломита
- •17.Основные факторы, влияющие на скорость реакции кислотного раствора с породой. Порядок приготовления кислотного раствора
- •18..Кислотные ванны. Техн-гия обчной ско
- •20.Термокислотные обработки. Расчет тко. Форма магния при тко термокислотная обработка
- •21.Гко терригенных коллекторов и их расчет. Объем глинокислоты при гко
- •22.Меры безопасности при работе с соляной кислотой. Средства оказания первой помощи при попадании кислоты на кожу, в глаза
- •Основные принципы системной технологии
- •Выбор скважин для опз определяется
- •29 Вопрос. Рабочие жидкости при гкрп. Комплекс спецтехники и технологический процесс гкрп. Меры безопасности при гкрп
- •31 Вопрос. Водоснабжение систем ппд. Источники водоснабжения. Качество нагнетаемой воды. Водоснабжение систем ппд.
- •37 Вопрос. Основные источники и элементы загрязнений закачиваемых вод. Современные требования к качеству закачиваемых вод.
- •38 Вопрос. Схема и эффективность ступенчатой технологии очистки закачиваемых вод
Порядок обработки кривой реагирования (на логарифмической сетке)
Совмещают фактическую кривую реагирования «lg ∆Рф(t) — lg tф» (2) с эталонной «lg ∆Рэ(t) — lg tэ» (1) . Определяют координаты на фактической кривой ∆Рф и tф, соответствующие единичным координатам на эталонной кривой ∆Рэ=0,1 и tэ = 1
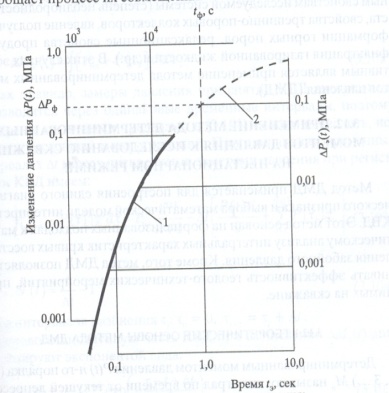
Совмещ-ные кривые 1 – эталонная, 2 - фактическая. Рассчитывают параметры пласта
Гидропроводность и пьезопроводность
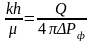
При немонотонном характере фактических кривых реагирования совмещение таких кривых с эталонными затруднено и интерпретация их может привести к большим ошибкам
В этом случае необходимо пользоваться дифференциальным или интегральным способами обработки фактических кривых реагирования.
16.Расчет ско карбонатных коллекторов (известняк, доломит)
Расчет СКО для известняка
СаСО3 + 2НСL = СаСL2 + Н2О + СО2 ↑
или в количественных соотношениях
(40+12+3×16)+2(1+35,5)=(40+2× 35,5) + (2×1+16) + (12+2×16)
100г + 73г = 111г + 18г + 44г
При растворении 100 г известняка 73 г чистой HCl получается 111 г растворимой соли хлористого кальция, 18 г воды и 44 г углекислого газа. На 1 кг известняка надо израсходовать 730 г. чистой HCl.
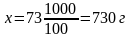
1 л 15%-ного раствора кислоты содержит 161,2 г чистой HCl. Следовательно, для растворения 1кг известняка потребуется:
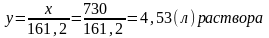
Расчет ско для доломита
CaMg(CO3)2 + 4HCL = СаСL2 + MgCL2 + 2H2O + 2СО2 ↑
(40+24,3+2(12+3×16))+4(1+35,5)=(40+2×35,5)+(24,3+2×35,5) +2(2×1+16) + 2(12+2×16)
184,3 +146 г = 111 г + 95,3 г + 36 г + 88 г
При растворении 184,3 г доломита 146 г чистой HCl получается 111 г растворимой соли хлористого кальция, 95.3 г растворимой соли хлористого магния, 36 г воды и 88 г углекислого газа.
Д
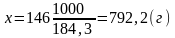 ля
растворения 1 кг доломита потребуется
кислоты
ля
растворения 1 кг доломита потребуется
кислоты
или 15%-ного раствора HCl:
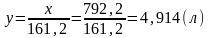
17.Основные факторы, влияющие на скорость реакции кислотного раствора с породой. Порядок приготовления кислотного раствора
Скорость реакции кислоты характеризуется временем ее нейтрализации при взаимодействии с породой и зависит от температуры и давления в зависимости от вещественного состава карбонатной породы скорость реакции возрастает от 1,5 до 8 раз при повышении температуры от 20 до 60°С. Изменение концентрации кислотного раствора от 5 до 15% НСL не оказывает практического влияния на скорость реакции даже при температуре 60°С Повышение давления снижает скорость реакции. время нейтрализации 75% объема кислотного раствора увеличивается в 7-10 раз при повышении давления с 0,1 до 0,7 МПа. при увеличении давления от 0,7 до 1 МПа время нейтрализации увеличивается в 30-35 раз .при увеличении давления с 2 до 6 МПа скорость реакции снижается в 70 раз Порядок приготовления раствора НСlвода ингибиторы стабилизаторы концентрированная соляная кислота .хлористый барий. интенсификаторы
