
- •5.4 Экстракция.
- •Жидкостная экстракция
- •5.4.1.1 Равновесия в системе жидкость - жидкость
- •5.4.1.2 Материальный баланс процесса жидкостной экстракции Однократная (одноступенчатая) экстракция.
- •5.4.1.3 Основные способы проведения экстракции Однократная (одноступенчатая) экстракция.
- •Экстрагирование в системе твердое тело – жидкость (выщелачивание).
- •5.4.2.1 Экстрагирование растворенного вещества.
- •5.4.2.2 Экстрагирование твердого вещества.
- •5.4.2.3 Схемы проведения экстракции.
5.4 Экстракция.
Экстракция – процесс извлечения одного или нескольких компонентов из растворов или твердых тел с помощью избирательных растворителей (экстрагентов). При взаимодействии с экстрагентом в нем хорошо растворяются только извлекаемые компоненты и значительно слабее или практически вовсе не растворяются остальные компоненты исходной смеси. В химической технологии экстракция из растворов экстрагентами более распространена, чем экстракция из твердых тел.
Жидкостная экстракция
Процесс экстракции обычно экономически выгоднее ректификации, поскольку при экстракции не нужно испарять всю жидкую смесь.
Обычно жидкостную экстракцию с сочетают с ректификацией, которую применяют для регенирации экстрагента. Экстракт – раствор извлеченных веществ в экстрагенте, рафинат – остаточный исходный раствор.
На рис. 5.47 представлена схема без регенезации. Чаще всего используются схемы с регенезацией экстрагента.

Рис. 5.47 Схема проведения экстракционных процессов
5.4.1.1 Равновесия в системе жидкость - жидкость
Для трехкомпонентной системы жидкость – распределяемое вещество–жидкость можно изменять концентрацию одной из фаз без нарушения равновесия. В процессе жидкостной экстракции обычно Т не меняется, Р на равновесие системы не влияет.
Закон распределения: отношение равновесных концентраций распределяемого между двумя жидкими фазами вещества при Т=const есть величина постоянная.
![]()
![]() или
или
![]() (5.141)
(5.141)
где у* и х – равновесные концентрации распределяемого вещества соответственно в экстракте и рафинате, m – коэффициент распределения.
По формуле (5.141) линия равновесия должна быть прямой, выходящей из начала координат. Однако это справедливо для случая полной взаимной нерастворимости участвующих в процессе фаз, что довольно редко встречается в реальных условиях. Обычно m зависит от концентрации распределяемого вещества Т=const, если же меняется Т, то величина m может меняться еще сильнее.
Линии равновесия на диаграмме у-х при постоянной темпиратупе называют изотермами экстракции (рис. 5.48). Если известны изотермы для разных Т, то становится возможным выбрать наиболее приемлемое Т.
1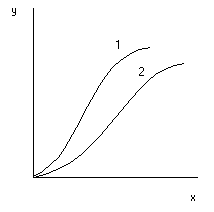 – неэлектролит
– неэлектролит
2 – электролит
Рис.5.48 Типичные изотермы экстракции.
Треугольные диаграммы. Отметим, что часто фазы, участвующие в процессе экстракции, частично растворимы друг в друге. Тогда экстракт помимо экстрагента и растворенного вещества содержит некоторое количество растворителя из исходного раствора, а рафинат помимо первоначального раствора и некоторого количества растворенного вещества – определенное количество экстрагента. Оба раствора состоят из трех компонентов.
А,
В, С – чистые компоненты. В точке А –
чистый Фх, в точке
![]() В
– чистый М, в точке С – чистый Фу. Точка
М характеризуется величинами. Точки на
площади треугольника соответствуют
составам трехкомпонентных растворов.
В
– чистый М, в точке С – чистый Фу. Точка
М характеризуется величинами. Точки на
площади треугольника соответствуют
составам трехкомпонентных растворов.

Рис. 5.49 Треугольная диаграмма
Равновесную концентрацию для трехкомпонентных смесей ж-ж можно представить на треугольной диаграмме.

Рис. 5.50 Равновесная кривая в треугольной диаграмме.
А – 100% - растворитель в исходном растворе,
В – 100% - растворенное вещество,
С – 100% - экстрагент
Линии АВ, ВС, СА – характеризуют состав двухкомпонентных растворов. Пусть А и В, В и С, неограниченно растворимы друг в друге, а А и С – ограниченно растворимы. Пусть состав А и С характеризуются точками G1 и G2. Если к ним добавить В, получим трехкомпонентный расслаивающий раствор соответствующий точкам D1 и D2. Эта хорда соответствует растворам, находящихся в равновесии друг с другом. Точка К – критическая точка, соответствует однофазному раствору.
Взаимная растворимость с увеличением температуры повышается, поэтому область существования гетерогенных систем уменьшается. При высоких температурах может вообще исчезнуть (точка Ткр на рис. 5.51).
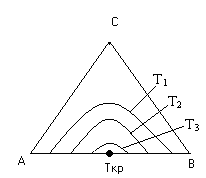
Рис. 5.51 Влияние Т на равновесную кривую.
Селективность
экстрагента.
Основным свойством экстрагента является
селективность, которая характеризует
его способность преимущественно
извлекать один из двух, трех и более
компонентов раствора. Селективность
экстрагирования по отношению к
распределяемому компоненту характеризуется
коэффициентом селективности (коэффициент
разделения)
![]()

(5.142)
или с учетом (5.141)
![]() (5.143)
(5.143)
Как
видно, чем больше
![]() тем больше
.
Если
=1,
то селективность равна 0. В реальных
условиях
больше 2.
тем больше
.
Если
=1,
то селективность равна 0. В реальных
условиях
больше 2.
Обозначены через у – экстракт, х – рафинат.
к
 оэффициент
распределения для компонента В.
оэффициент
распределения для компонента В.
