
- •5.3. Перегонка жидкостей.
- •5.3.1. Равновесие в системах жидкость – пар.
- •Смеси взаимно нерастворимых жидкостей.
- •5.3.2 Простая перегонка.
- •Материальный баланс простой перегонки.
- •5.3.4.Ректификация
- •Периодически действующие установки.
- •5.3.4.1. Материальный баланс непрерывной ректификации бинарных смесей.
- •Материальный баланс всей колонны:
- •Материальный баланс по нк:
- •Уравнения рабочих линий.
- •5.3.4.2. Тепловой баланс ректификационной колонны.
- •5.3.5 Периодическая ректификация.
- •5.3.6 Ректификация многокомпонентных смесей.
- •5.3.7. Экстрактивная и азеотропная ректификация.
5.3. Перегонка жидкостей.
Перегонка жидкостей представляет собой процесс, в котором разделяемая жидкая смесь нагревается до кипения, а образующийся пар отбирается и конденсируется. В результате получают жидкость – конденсат, состав которого отличается от состава начальной смеси. Повторяя много раз процесс испарения и конденсации, можно практически полностью разделить исходную смесь на чистые составные части (компоненты).
Процесс перегонки основан на том, что компоненты, составляющие смесь, обладают различным давлением пара при одной и той же температуре. Поэтому пар, а, следовательно, и конденсат обогащается преимущественно легколетучим (или низкокипящим - НК) компонентом. Очевидно, что в неиспарившейся жидкости остается в основном труднолетучий (или высококипящий - ВК) компонент. Таким образом, компоненты обладают различной летучестью при одной и той же температуре.
Если исходная смесь состоит из летучего и нелетучего компонента, то ее разделяют выпариванием. Посредством перегонки разделяют смеси, все компоненты которого летучи.
Жидкость, полученная в результате конденсации паров, называется дистиллятом (ректификатом), оставшаяся часть – остатком.
Простая перегонка – процесс однократного частичного испарения смеси с последующей конденсацией образовавшихся паров. Простую перегонку применяют для разделения смесей, летучести компонентов которой существенно отличаются друг от друга, либо для предварительного разделения жидких смесей.
Ректификация – наиболее полное разделение жидких смесей при многократном взаимодействии паров с жидкостью, полученной при частичной конденсации паров.
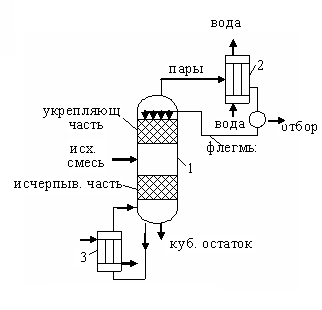
Рис. 5.27 Насадочная ректификационная колона: 1 – колонна, 2 – дефлегматор, 3 – кипятильник
Рассмотрим ректификационную колонну, в которой снизу движутся пары, а сверху навстречу парам подают жидкость, называемую флегмой. При взаимодействии поднимающихся паров со стекающей жидкостью происходит частичная конденсация пара и частичное испарение жидкости (флегмы) за счет теплоты конденсации. При этом из пара конденсируется в основном ВК, а из флегмы, в основном, НК. Стекающая флегма непрерывно обогащается ВК, а поднимающиеся пары – НК.
В результате выходящий из колонны пар состоит почти целиком из НК. Пар конденсируют в специальном теплообменнике – конденсаторе (дефлегматор). Часть этого конденсата в виде флегмы идет на орошение колонны, другая часть – дистиллят или ректификат – отбирают как готовый продукт. Для образования восходящего потока газа колонну снабжают кипятильником, в котором происходит испарение части кубового остатка. Кубовый остаток состоит почти из чистого ВК.
5.3.1. Равновесие в системах жидкость – пар.
В общем случае жидкая смесь может состоять из нескольких компонентов. В простейшем случае из двух, например, из компонентов A и B.
Существует правило фаз Гиббса, по которому можно определить число степеней свободы
![]() ,
,
где K – число компонентов, Ф – количество фаз, n – количество внешних факторов, влияющих на процесс, С – число степеней свободы.
Согласно правилу фаз Гиббса для массообмена, число степеней свободы такой системы = 2 (два компонента и две фазы, внешние факторы – температура и давление). Следовательно, из трех независимых параметров, полностью определяющих состояние системы (температура, давление, концентрация) можно произвольно выбрать любые два: при этом значение третьего параметра становится зависимым.
По степени растворимости жидкости делятся:
Взаиморастворимые в любых соотношениях:
Идеальные растворы – подчиняются закону Рауля
Нормальные растворы – частично подчиняются закону Рауля
Неидеальные растворы – значительно отклоняются от закона Рауля
Частично взаиморастворимые
Практически взаимонерастворимые.
Рассмотрим взаиморастворимые в любых соотношениях
Обозначим состав жидкой фазы через x, паровой фазы – y. Тогда возможны следующие варианты фазовых диаграмм:
p – T (x= const),
p – x (T= const),
T – x (p= const).
Для технических расчетов наиболее важна диаграмма T – x,y, т.к. обычно процесс перегонки в промышленных аппаратах происходит при P = const, т.е. в изобарных условиях.
Закон Рауля:
Парциальное давление каждого компонента,
например, низкокипящего компонента А
в паре
![]() ,
пропорционально мольной доле
,
пропорционально мольной доле
![]() этого компонента в жидкости. При этом
коэффициент пропорциональности равен
давлению насыщенного пара
этого компонента в жидкости. При этом
коэффициент пропорциональности равен
давлению насыщенного пара
![]() данного компонента при данной T°C.
данного компонента при данной T°C.
![]()
![]()
![]() – давление
насыщенного пара над чистой жидкостью.
– давление
насыщенного пара над чистой жидкостью.
По закону Дальтона, общее давление пара над раствором P равно сумме парциальных давлений его компонентов:
![]()
Тогда

По закону Дальтона
![]() ;
;

По уравнению по
известным
и
![]() при заданной температуре
при заданной температуре
![]() и т.д. находим
и т.д. находим
![]() и т.д. Затем по уравнению (5.104) находим
и т.д. Затем по уравнению (5.104) находим
![]() и т.д. Строим линию кипения жидкости и
конденсации паров (рис 5.28).
и т.д. Строим линию кипения жидкости и
конденсации паров (рис 5.28).
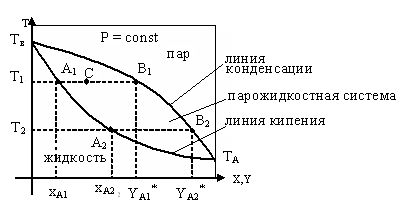
Рис.5.28 Фазовая диаграмма T – x,y.
Линия
![]() - отвечает фазе, находящейся при
температуре кипения.
- отвечает фазе, находящейся при
температуре кипения.
Линия
![]() - линия конденсации.
- линия конденсации.
Любая точка лежащая выше этой кривой, соответствует паровой фазе, пары являются перегретыми.
Точка C характеризует систему, температура которой выше температуры кипения и ниже температуры конденсации паров этого же состава.
Область между линиями и соответствует равновесным парожидкостным системам.
По уравнениям (5.102-5.104) можно получить уравнение линии равновесия:
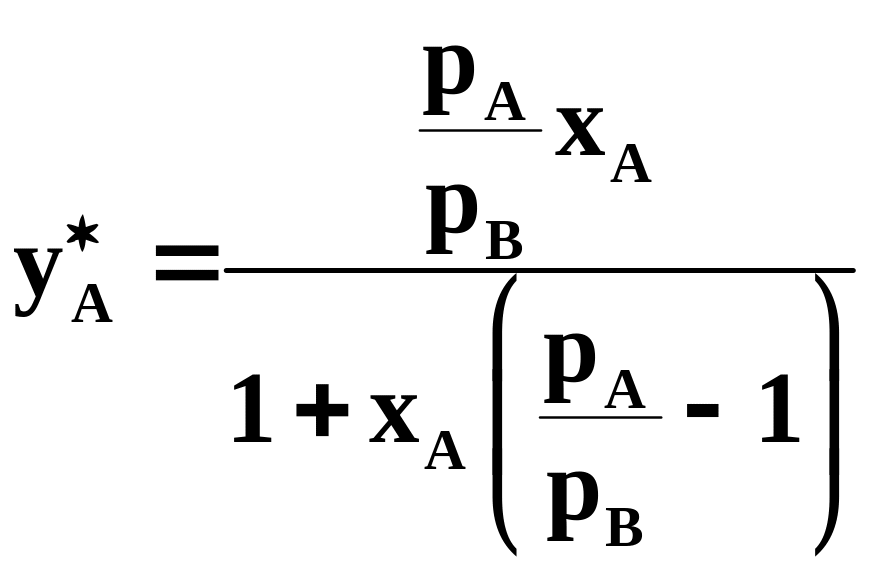
Уравнение получено
для идеальных бинарных систем. Обозначим
 – относительная летучесть компонентов.
Поскольку давления насыщенных паров
и
– относительная летучесть компонентов.
Поскольку давления насыщенных паров
и
![]() компонентов А и В меняются в интервале
температур
компонентов А и В меняются в интервале
температур
![]() и
и
![]() ,
то для расчета по берут среднее α.
,
то для расчета по берут среднее α.
![]() (5.106)
(5.106)
![]() - соответствует
ТА,
- соответствует
ТА,![]() - ТВ
- ТВ

Поскольку
![]() с понижением давления снижается, то α
увеличивается. Относительная летучесть
α
при понижении температуры растет.
с понижением давления снижается, то α
увеличивается. Относительная летучесть
α
при понижении температуры растет.
Взаимное расположение кривых на фазовых диаграммах T – x,y и y – x как для идеальных, так и для реальных систем определяются с помощью законов Коновалова. Законы Коновалова устанавливают связь между изменением состава, давлением и температурой в 2-х фазных системах, они лежат в основе теории перегонки и ректификации бинарных смесей.

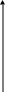






y
![]()
1
2
3 x
Рис.5.29 Влияние давления на линию равновесия.
Первый закон Коновалова: пар обогащается тем компонентом, при добавлении которого к жидкости повышается давление пара над ней или снижается ее температура кипения; или пар всегда более обогащен НК, чем соответствующая ему жидкая равновесная фаза.
Этот закон дополняется первым правилом Вревского, отражающим влияние T на равновесные составы фаз: при повышении T бинарной смеси в парах возрастает относительное содержание того компонента, парциальная молярная теплота испарения которого больше.
Неидеальные растворы (реальные смеси) с полностью взаимной растворимостью компонентов не следует закону Рауля:
![]() и
и
![]()
Здесь γ – коэффициент активности. Если γ > 1 – положительное отклонение, если γ < 1 – отрицательное. Определение γ часто затруднено, поэтому диаграмму y – x обычно строят по экспериментальным данным.
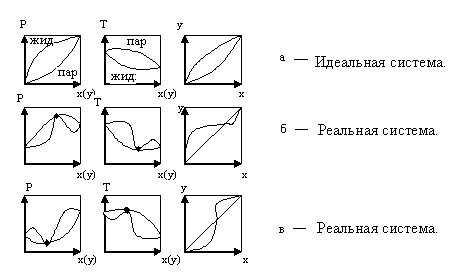
Рис.5.30 Фазовые диаграммы.
В реальных системах на фазовых диаграммах P – x(y) и T – x(y) возникают относительные максимумы или минимумы. При этом кривые жидкости и пара соприкасаются друг с другом в экстремальных точках (рис. 5.30).
В этих точках составы равновесных фаз одинаковы. Такие смеси называют азеотропными, или азеотропами. Такая смесь при испарении не изменяет своего состава. Поэтому для их разделения применяются спецметоды.
Для таких систем существует второй закон Коновалова: если давление и T сосуществования 2-х бинарных фаз имеют экстремум, то составы фаз одинаковы.
Смещение состава азеотропов при изменении внешних условий определяется вторым законом Вревского: если давление (или T) снижены Ж-П имеет максимум, то при повышении T в азеотропной смеси возрастает концентрация того компонента, парциальная молярная теплота испарения которого больше, а если давление (или T) систем Ж-П имеет минимум, то при повышении T в азеотропной смеси возрастает концентрация компонента с меньшей теплотой испарения.
Этот закон определяет возможности разделения азеотропных смесей изменением давления при перегонке. При этом точка азеотропы перемещается на диаграмме y-x и в принципе может совпасть, на диаграмме 8, с правым верхним углом диаграммы. Тогда азеотропную смесь можно разделить перегонкой.
Т.о, законы Коновалова характеризуют изменение состояния равновесия 2-х фазных систем при изобарных или изотермических условиях. А законы (правила) Вревского определяют закономерности влияния на фазовое равновесие бинарных систем изменений температуры и давления.
Частично растворимые жидкости.
Взаимная растворимость существенно зависит от состава и температуры. Обычно растворимость жидкостей с ростом температуры T°С растет.

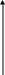




T
Tкр M
1 2
T1
x
x1 x2
Рис. 5.31 кривая растворимости.
Если задана температура T, то в области концентраций x<x1 и x>x2 возникает гомогенная система при полной растворимости жидкостей. При этом системы могут подчиняться закону Рауля. В интервале от x1 до x2 образуются 2 нерастворимые друг в друге жидкости с концентрацией x1 в одной жидкой фазе и x2 – в другой. В равновесии с жидкостями находится паровая фаза определенного состава. При t>Tкр образуется гомогенный раствор при смешении жидкостей в любых соотношениях. Концентрация паровой фазы будет зависеть от состава жидкой фазы. Пример - фенол в воде.
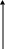











P y
x1 x2 x x1 x2 x
Рис.5.32 диаграммы для смесей жидкостей,
ограниченно растворимых друг в друге
