
Лекция № 7
Экстракционная переработка урановых пульп и растворов. Основные понятия. Краткая характеристика основных экстрагентов и разбавителей, применяемых в технологии урана.
Экстракция – извлечение какого-либо вещества из одной фазы в другую (в переводе означает извлекаю). В более узком смысле слова и в том, в котором мы будем его употреблять, экстракция – это жидкостная экстракция или процесс извлечения соединений металлов ( и кислот) из водных растворов, где они содержатся в виде солей неорганических кислот, в органические, не смешивающиеся с водой растворы.
Экстракция обладает многими преимуществами: относительная простота экстракционной технологии, высокая эффективность и избирательность, что обеспечило ей быстрое внедрение и использование в промышленности.
Сущность метода экстракционного извлечения заключается в том, что при определенных условиях соли некоторых элементов, в частности урана (IV) могут в значительном количествах переходить из водных растворов в органический растворитель, тогда как другие элементы остаются в водном слое.
Т.е. можно сказать, что экстракционные процессы основаны на распределении веществ между двумя несмешивающимися фазами, органической и водной. В воде большинство растворенных неорганических веществ диссоциировано и образующиеся ионы гидратированы. В неполярной или малополярной органической жидкости диссоциация растворенных веществ отсутствует или сильно подавлена. Переход ионов из воды в органическую фазу невыгоден энергетически, поэтому для получения экстрагируемого соединения необходимо образование незаряженной электронейтральной молекулы или достаточно прочной ионной пары. Кроме того необходимо полное или частичное «освобождение» экстрагируемого элемента от гидратной оболочки и образование более или менее гидрофобного соединения.
Образовавшаяся крупная незаряженная молекула или ионная пара, полностью или частично лишенная гидратной оболочки и других гидрофильных групп и имеющая в своем составе органическую часть, нарушает упорядоченную структуру воды, которая «выталкивает» ее в органическую фазу. Если органическая часть экстрагируемой молекулы дополнительно взаимодействует с органическим растворителем (например, с образованием водородных связей), это еще более способствует экстракции.
В экстракционной практике принята следующая терминология.
Экстрагенты - органические соединения, способные вбирать в себя, извлекать из водной фазы металлы, их соединения. Их применяют в чистом виде или в семи с другими органическими жидкостями.
Органические жидкости, которые самостоятельно не экстрагируют исходные соли, но служат добавками при экстракции называют разбавителями.
Органический раствор, насыщенный извлекаемой солью называется экстракт, водный раствор из которого извлекают вещество называют рафинат.
Принципиальная схема экстракции:
И сходный
водный раствор
экстрагент + разбавитель
сходный
водный раствор
экстрагент + разбавитель
экстракция
Разделение фаз



Рафинат
Экстракт
Экстракционные процессы обычно протекают в гетерогенной многофазной системе. В условиях фазового равновесия действует правило фаз Гиббса, устанавливающее соотношение между числом степеней свободы F, числом фаз ф и числом независимых компонентов в системе К: F = К - ф + 2.
В обычных условиях при экстракции число фаз равно 2, т.е. система двухфазна.
Число компонентов определяет, как известно, числом «независимых переменных» - самостоятельно существующих химических соединений, без числа уравнений, показывающих, как эти соединения связаны между собой. При экстракции любой соли из ее водных растворов нейтральным экстрагентом система трехкомпонентна (воды, экстрагируемая соль, экстрагент). если же в процессе экстракции образуются какие-либо соединения, то это не меняет числа независимых переменных, т.к. появляются уравнения, связывающие эти соединения. Например, при экстракции азотной кислоты трибутилфосфатом (ТБФ) из водного раствора протекает реакция:
ТБФ орг + HNO3 водн.
![]()
В равновесной системе содержится четыре
вещества: ТБФ, азотная кислота, вода и
![]() .
Т.к. связь между компонентами выражается
одним уравнением, то число компонентов
будет на единицу меньше и равно трем.
Согласно правилу фаз Гиббса для
трехкомпонентной двухфазной системы
F= 3-2+2=3. процессы экстракции
обычно протекают при фиксированном
давлении (атмосферное давление). Система
становится бивариантной, т.е. независимыми
параметрами являются температура и
концентрация распределяемого компонента
в одной из фаз. Концентрация вещества
в другой фазе – зависимая величина.
Функциональная зависимость этих величин
может быть записаны в виде общего
термодинамического уравнения экстракции:
Сорг = f (С водн.,
Т).
.
Т.к. связь между компонентами выражается
одним уравнением, то число компонентов
будет на единицу меньше и равно трем.
Согласно правилу фаз Гиббса для
трехкомпонентной двухфазной системы
F= 3-2+2=3. процессы экстракции
обычно протекают при фиксированном
давлении (атмосферное давление). Система
становится бивариантной, т.е. независимыми
параметрами являются температура и
концентрация распределяемого компонента
в одной из фаз. Концентрация вещества
в другой фазе – зависимая величина.
Функциональная зависимость этих величин
может быть записаны в виде общего
термодинамического уравнения экстракции:
Сорг = f (С водн.,
Т).
При постоянной температуре это уравнение Сорг = f (С водн.), т.е. система становится моновариантной, это означает что можно произвольно выбрать одну концентрацию компонента (н-р, в водной фазе), тем самым уже определяя концентрацию в органической фазе, которую уже нельзя взять произвольно. Т.о. при постоянной температуре должна существовать определенная зависимость Сорг = К (С водн.) - для данной температуры отношение концентраций вещества, распределяющегося между двумя несмешивающимися жидкостями – есть величина постоянная при различных его концентрациях – закон распределения Нернста - Шилова. Сорг / С водн = D - коэффициент распределения, который зависит от природы растворителя и распределяющегося вещества, от температуры, но не зависит от концентрации вещества.
Закон распределения справедлив при
достаточно больших разведениях. С
увеличением концентрации наблюдаются
существенные отклонения от этого закона.
Кроме того, закон справедлив лишь в том
случае, когда растворенное вещество
находится в обеих фазах в одной и той
же форме. В реальных же системах
распределяемое вещество может
диссоциировать, ассоциировать,
сольватироваться, гидролизоваться,
образовывать комплексы и т.д. Т.е. закон
идеализирован и применим лишь в некоторых
случаях. Точное выражение закона
распределения для любых, а не только
низких концентраций можно получить на
основе законов термодинамики. Если в
выражение вместо концентраций подставить
активности веществ. D =
![]() ,
где а – активности растворов, а γ1
и γ2 – коэффициенты активности
вещества в водной и органической фазах
соответственно. При бесконечном
разбавлении
,
где а – активности растворов, а γ1
и γ2 – коэффициенты активности
вещества в водной и органической фазах
соответственно. При бесконечном
разбавлении
![]()
Коэффициент распределения имеет очень важное значение с точки зрения технологии экстракционных процессов:
чем выше D, тем большее количество вещества можно извлечь за одну операцию (контакт) экстрагирования. Поэтому желательно иметь экстрагенты с высокими коэффициентами распределения. Однако и при сравнительно невысоком D можно добиться хорошего извлечения повторением операций экстрагирования, что позволяет глубоко извлекать продукт в органическую фазу. При D =10, уже при одном контакте извлечение составляет 90%. Даже для такого низкого коэффициента распределения как 1, за пять контактов можно получить 97%-ое извлечение (0,5 + 0,25 + 0,125 +0,063+0,032=0,97).
различия коэффициентов распределения ценного компонента и примесей позволяют при экстракции эффективно избавляться от примесей.
даже небольшое различие коэффициентов распределения двух химически близких веществ дает возможность разделять их экстракционным методом и селективно выделять их. Н-р, можно разделить ниобий и тантал, гафний и цирконий, бериллий и алюминий, уран и плутоний и т.п.
Требования к экстрагентам
достаточно высокий коэффициент распределения урана, что является важнейшей характеристикой экстрагента;
определенная селективность в отношении урана (избирательность)
быстрота и чистота разделения фаз после контакта.
малая взаимная растворимость в системе водный раствор – экстрагент (в идеале – полная несмешиваемость)
плотность экстрагента должна отличаться от плотности водного раствора. В процессе экстракции следует учитывать, что плотность водной фазы уменьшается, а органической увеличивается, что затрудняет разделение фаз после экстракции и даже вызвать их инверсию. Обычно плотность органической фазы снижают добавкой разбавителя. В некоторых случаях плотность органической фазы может быть намного больше плотности водной (разбавитель CCl4).
химическая стойкость экстрагента к кислотам и окислителям (это же требование важно и для разбавителя)
низкая летучесть, вязкость, токсичность.
высокая температура вспышки, в идеале полная негорючесть экстрагента.
радиационная стойкость
невысокая стоимость, доступность и простата синтеза.
относительная легкость регенерации экстрагента.
Классификация экстрагентов
Извлечение урана из водной фазы в органическую происходит в результате химического взаимодействия гидратированных ионов с экстрагентами с получением новых соединений, растворимых в смеси экстрагента и разбавителя. Обратный процесс – реэкстракция урана в водную фазу – также связан с предшествующими химическими процессами разрушения экстрагируемых соединений. Однако механизм экстракции и реэкстракции может быть различным в зависимости от природы экстрагента и условий проведения экстракции.
Рассмотрим наиболее типичные экстрагенты и механизмы экстракции. Обычно экстрагенты и характерные для них механизмы подразделяют на три группы:
это так называемые нейтральные экстрагенты. При экстракции происходит образование сольватов, поэтому говорят о сольватном механизме сорбции. В качестве экстрагентов используют – кислородсодержащие растворители: спирты, простые и сложные эфиры, альдегиды, кетоны и нейтральные фосфорорганические соединения. Например:
а) экстракция уранил-нитрата диэтиловым эфиром:
![]()
б) экстракция уранил-нитрата трибутилфосфатом:
![]()
Это типичные реакции комплексообразования с вытеснением воды из внутренней координационной сферы комплекса, которые можно записать следующим образом:
![]()
Предполагают, что реакция с ТБФ протекает в две стадии:
![]()
![]()
Эти экстрагенты экстрагируют преимущественно из азотнокислых растворов по аналогичным реакциям. Для этой группы экстрагентов характерна очень высокая растворимость (емкость) образующихся сольватов в избытке растворителя, достигающая в некоторых случаях растворимости уранил-нитрата в воде (56%).
некоторые органические кислоты, н-р: ацетилацетон, кислые алкилфосфаты. Наибольшее значение имеют следующие фосфорсодержащие экстрагенты:
кислота |
моноалкилфосфаты |
диалкилфосфаты |
Нейтр. соед-ия 1-ой гр. |
|
|
|
|
|
|
|
|
|
|
|
|
Кислые алкилфосфаты образуют с уранил-ионом (а также ионом U4+) в органической фазе устойчивые комплексыне соединения, в состав которых входят катион из водной фазы и анион органической кислоты. Н-р: при экстракции уранил-иона моноалкилфосфатом протекает реакция
OH O
ROP - OH + UO2+2ВОДН = RO – P – O - UO2 + 2 H+водн
OHорг O
А при экстракции диалкилфосфатом:
O O
2(RO)2 P + UO2+2ВОДН = (RO)2 – P UO2 + 2 H+водн
OHорг O
Ионы водорода, освобождающиеся при экстракции, переходят в водную фазы, повышая соответственно ее кислотность. По существу происходит катионный обмен, в результате которого образуются прочные нейтральные комплексы с уранил-ионом в качестве центрального иона и органическими лигандами. Эти соединения хорошо рас творимы в органической фазе – смеси экстрагента и разбавителя.
Уравнение экстракции уранил-иона ди-2-этилгексилфосфорной кислотой (Д2ЭГФК):
![]() .
.
Процесс экстракции сопровождается полимеризацией.
Радикалы RPO42-
и (RO)2P
![]() с легкостью вытесняют такие анионы как
Cl-, N
с легкостью вытесняют такие анионы как
Cl-, N![]() из внутренней сферы соединений уранила.
Процесс экстракции кислыми алкилфосфатами
идет хорошо из сернокислых, хлорнокислых,
азотнокислых и фосфорокислых сред, хотя
селективность экстрагирования по
отношению к урану оставляет желать
лучшего.
из внутренней сферы соединений уранила.
Процесс экстракции кислыми алкилфосфатами
идет хорошо из сернокислых, хлорнокислых,
азотнокислых и фосфорокислых сред, хотя
селективность экстрагирования по
отношению к урану оставляет желать
лучшего.
органические соединения, для которых растворимость в неполярных растворителях обусловлена образованием солей с органическим катионом. Примером подобных экстрагентов являются амины (первичные амины: RNH2 ; вторичные R2NH; третичные R3N) .
В аминах, как в аммиаке азот имеет неподеленную пару электронов, что обуславливает их способность к образованию координационных соединений. Подобно аммиаку, амины реагируют с кислотами, давая соли аминов:
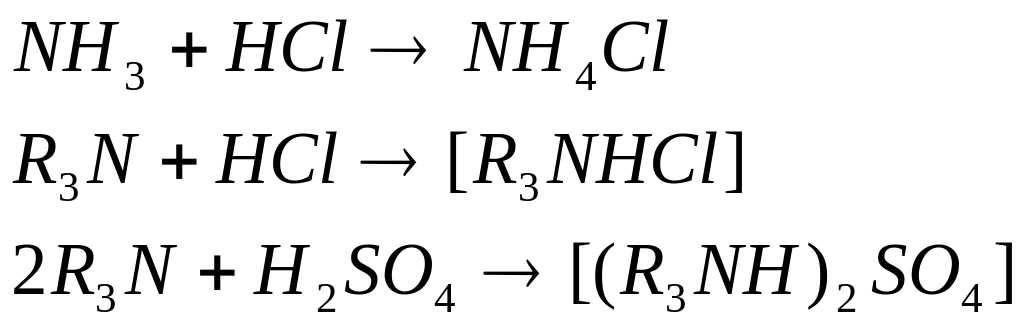
Эти соли аминов и служат экстрагентами:
![]() , т.е. реализуется анионообменный
механизм экстракции и амины ведут себя
как анионообменная смола (только жидкая).
В общем случае взаимодействие с амином
может быть выражено следующим соотношением:
, т.е. реализуется анионообменный
механизм экстракции и амины ведут себя
как анионообменная смола (только жидкая).
В общем случае взаимодействие с амином
может быть выражено следующим соотношением:
![]()
С позиции координационной теории более правильно записать реакцию следующим образом
![]() ,
т.е. и в этом случае наблюдается вытеснение
воды, что подтверждает ее важную роль
при экстракции. Отсюда крылатое выражение
«без воды нет экстракции».
,
т.е. и в этом случае наблюдается вытеснение
воды, что подтверждает ее важную роль
при экстракции. Отсюда крылатое выражение
«без воды нет экстракции».
Характерная особенность экстракции аминами в том, что равновесие устанавливается в течение нескольких секунд. Экстракция аминами протекает только в том случае, если водная фаза содержит ионы водорода в количестве достаточном для превращения амина в соль аммония, т.к. экстрагентами могут быть только соли аминов.
Экстракционная способность аминов увеличивается в ряду: первичные < вторичные < третичные.
В экстракции применяются, как правило, третичные амины.
