
- •Тема: Исследование сил поверхностного натяжения
- •Краткое теоретическое введение
- •Определение коэффициента поверхностного коэффициента натяжения по методу Ребиндера.
- •Определение постоянной прибора а
- •Определение коэффициента поверхностного натяжения по методу отрыва капель Описание капельного метода.
- •Определение зависимости поверхностного натяжения растворов пав от концентрации
- •Значений для воды при различных температурах
Тема: Исследование сил поверхностного натяжения
Цель: Целью работы является изучение поверхностного натяжения жидкости, исследование зависимости коэффициента поверхностного натяжения жидкости от концентрации, а также овладение разными методами определения коэффициента поверхностного натяжения.
Краткое теоретическое введение
Поверхностное натяжение жидкости объясняется существованием сил молекулярного взаимодействия на свободной поверхности, соприкасающейся с газом или другой жидкостью.
Известно, что между
молекулами вещества действуют силы
молекулярного притяжения и отталкивания.
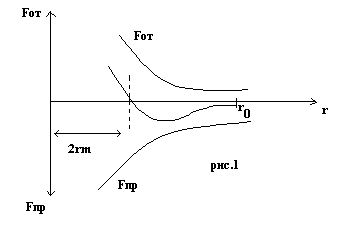
На рис.1 изображена зависимость сил
отталкивания и притяжения двух соседних
молекул от расстояния между их центрами.
Равнодействующая сил притяжения Fпр
и отталкивания Fот,
действующих на каждую молекулу изображена
пунктирной линией. Эта равнодействующая
дважды обращается в нуль - при расстояниях
2rm
и r0
. Условно rm
называется радиусом молекулы, а r0
- радиусом сферы
молекулярного действия. (![]() )(
)(![]() ).
).
Когда расстояние между центрами молекул становиться меньше сферы радиуса r0 , центральная молекула притягивается ко всем молекулам, находящимся внутри этой сферы ( рис.2).
Если в пределах сферы молекулярного действия плотность вещества одинакова, то равнодействующая сил притяжения, действующих на центральную молекулу, равна нулю. Если же плотность вещества неодинаковая, то равнодействующая сил молекулярного притяжения не равна нулю и направлена в сторону большей плотности. А потому на каждую молекулу поверхностного слоя толщиной d действуют силы молекулярного притяжения, перпендикулярные поверхности и направленные вглубь жидкости (рис3).
П од
действием этих сил молекулы стремятся
уйти с поверхности в глубину. Вместе с
тем молекулы поверхностного слоя
обладают избытком потенциальной энергии
по сравнению с молекулами, находящимися
в глубине жидкости. Устойчивое равновесие
жидкости связано с минимум потенциальной
энергии, т.е. с минимально возможной в
данном состоянии величиной поверхности
жидкости. При изотермическом увеличении
площади поверхности жидкости совершенная
работа равна увеличению свободной
поверхностной энергии.
од
действием этих сил молекулы стремятся
уйти с поверхности в глубину. Вместе с
тем молекулы поверхностного слоя
обладают избытком потенциальной энергии
по сравнению с молекулами, находящимися
в глубине жидкости. Устойчивое равновесие
жидкости связано с минимум потенциальной
энергии, т.е. с минимально возможной в
данном состоянии величиной поверхности
жидкости. При изотермическом увеличении
площади поверхности жидкости совершенная
работа равна увеличению свободной
поверхностной энергии.
![]() (1)
(1)
Где
![]() - свободная энергия одной молекулы на
поверхности жидкости
- свободная энергия одной молекулы на
поверхности жидкости
![]() - свободная энергия одной молекулы в
глубине
- свободная энергия одной молекулы в
глубине
![]() -
число молекул выведенных из глубины на
поверхность жидкости
-
число молекул выведенных из глубины на
поверхность жидкости
Величина, численно равная работе изотермического увеличения поверхности жидкости на единицу, называется коэффициентом поверхностного натяжения.
Обозначим
-
=![]() - изменение свободной поверхностной
энергии одной молекулы, а
- изменение свободной поверхностной
энергии одной молекулы, а
![]() - число молекул единицы поверхности
жидкости. Тогда
- число молекул единицы поверхности
жидкости. Тогда
![]() (2).
Поскольку всякая система стремится
перейти в состояние с минимальной
потенциальной энергией, свободная
поверхность жидкости стремится сократить
свою величину (капля жидкости всегда
стремится принять форму шара, обладающего
наименьшей поверхностью по сравнению
с другими поверхностями). Это объясняется
тем, что между молекулами поверхностного
слоя, как показывает опыт, действуют
силы поверхностного натяжения,
направленные по касательной к поверхности
перпендикулярно к любой линии на
поверхности жидкости.
(2).
Поскольку всякая система стремится
перейти в состояние с минимальной
потенциальной энергией, свободная
поверхность жидкости стремится сократить
свою величину (капля жидкости всегда
стремится принять форму шара, обладающего
наименьшей поверхностью по сравнению
с другими поверхностями). Это объясняется
тем, что между молекулами поверхностного
слоя, как показывает опыт, действуют
силы поверхностного натяжения,
направленные по касательной к поверхности
перпендикулярно к любой линии на
поверхности жидкости.
Можно предположить,
что молекулы поверхностного слоя
расположены на расстояниях, несколько
больших 2rm
(рис.1). Эти расстояния уменьшаются по
мере удаления от поверхности, и становится
несколько меньше 2rm
на глубине
![]() (рис.3).
(рис.3).
Силы поверхностного натяжения – это силы взаимного притяжения молекул. Работу увеличения поверхности можно подсчитать, например, при увеличении мыльной пленки (рис.4).
![]()
г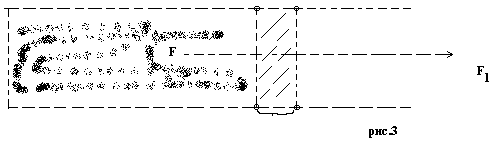 де
де
![]() -
внешняя сила, равна силе поверхностного
натяжения, действующая на всю границу
поверхности 2
-
внешняя сила, равна силе поверхностного
натяжения, действующая на всю границу
поверхности 2![]() ,
но противоположна по направлению:
,
но противоположна по направлению:
![]()
Здесь - сила поверхностного натяжения, действующего на границу , но у пленки две поверхности. Получаем:
![]()
И так, коэффициент поверхностного натяжения измеряется силой поверхностного натяжения, действующей по касательной к поверхности на единицу длины произвольного контура по поверхности жидкости. Не трудно видеть, что это определение соответствует приведенному выше. Размерности коэффициентов, определенные этими двумя путями, совпадают
![]() =[Дж/м2
]=[ Н/м]
=[Дж/м2
]=[ Н/м]
Коэффициент поверхностного
натяжения зависти от рода жидкости,
т.е. от соотношения свободной поверхностной
энергии молекул и энергии на глубине
жидкости, а также от плотности жидкости,
т.к. от нее зависит число молекул единицы
поверхности. При нагревании жидкости
уменьшается как
![]() ,
так и
,
так и
![]() поэтому коэффициент поверхностного
натяжения
поэтому коэффициент поверхностного
натяжения
![]() так же уменьшается. Рассмотрим
взаимодействие молекул из верхней части
сферы молекулярного действия. По мере
роста температуры растет плотность
пара над поверхностью, а плотность
жидкости уменьшается. Поэтому и
равнодействующая сил молекулярного
притяжения, действующая на каждую
молекулу поверхности слоя, уменьшается.
так же уменьшается. Рассмотрим
взаимодействие молекул из верхней части
сферы молекулярного действия. По мере
роста температуры растет плотность
пара над поверхностью, а плотность
жидкости уменьшается. Поэтому и
равнодействующая сил молекулярного
притяжения, действующая на каждую
молекулу поверхности слоя, уменьшается.
Эту температурную зависимость поверхностного натяжения жидкости можно проиллюстрировать на примере воды:
|
|
|
|
0 |
75,49 |
40 |
69,54 |
5 |
74,75 |
45 |
66,8 |
10 |
74,01 |
50 |
66,0 |
15 |
73,26 |
60 |
64,2 |
20 |
72,53 |
70 |
62,3 |
25 |
71,78 |
80 |
|
30 |
71,08 |
90 |
|
При критической температуре, когда исчезает различие между жидкостью и ее паром, равнодействующая обращается в нуль, исчезает поверхностный слой. Обращается в нуль и, следовательно, коэффициент поверхностного натяжения.
Коэффициент поверхностного натяжения можно определить различными методами. Наиболее употребительными являются: метод отрыва кольца, капельный метод и метод, основанный на измерении максимального давления в пузырьке воздух (метод Ребиндера).
