
- •Физическая химия
- •Тема 1. Строение в-в.
- •Физическая химия
- •Строение атомов и молекул
- •Состав атомных ядер.
- •1. Электрон может двигаться вокруг ядра атома не по любым, а только по вполне определенным стационарным орбитам.
- •Электроотрицательность.
- •Химическая связь и строение молекул.
- •Ковалентная связь.
- •Энергия химической связи.
- •Полярные и неполярные ковалентные связи.
- •Ионная связь.
- •Дисперсионное взаимодействие.
Строение атомов и молекул
К началу XX столетия было доказано, что атомы всех элементов имеют сложное строение и представляют собой электронейтральные системы, состоящие из положительно заряженного ядра и выражающихся вокруг него отрицательно заряженных электронов. Ядро имеет малые размеры, но в них сосредоточена почти вся масса атома (~99,97%).
Состав атомных ядер.
Ядра атомов состоят из протонов и нейтронов.
Протон – ядерная частица с массой 1,00782 у.е и зарядом +1в условных единицах. Заряд протона = по вел-не и противоположен по знаку заряду электрона (заряд е- условно принят равным -1). Протон принято обозначать символом «р».
Нейтрон – ядерная частица с массой 1,00866 у.е без электрического заряда. Нейтрон обозначается символом «n».
Число атомов в ядре и, следовательно, значение его положительного заряда равны порядковому номеру элемента в периодической системе элементов.
Электронная структура атомов.
Основу атому составляет ядро, но в процессе хим. превращений оно остается без изменений. Хим. р-ции сопровождаются перестройкой лишь е- , оболочек и особенности хим. свойств элементов определения особенностями е- ного строения их атомов.
Английский физик Резерфорд предложения ядерную (планетарную) модель атома, согласно которой ядро находится в центре атома, а е- вращаются вокруг ядра по орбите. Однако теория Резерфорд не объяснила у стобчивости атома.
В 1913г. Нильс Бор (Дания) разработал теорию строения атома водорода с привлечение квантовых представлений об излучении энергии.
В 1900г немецкий физик М.Планк предположил, что энергия излучается не непрерывно, а определенными теориями – квантами. Кванты лучистой энергии называются фотонами. Величина кванта энергии Е определяется ур. имени Планка: E=h٧
Где h постоянная Планка, или квант действия = 6,625×10-34Дж·c. ٧ - частота излучения, которая связана со скоростью света с и длинной λ соотношением
٧=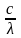
в основу свой теории Бор положил следующие постулаты:
1. Электрон может двигаться вокруг ядра атома не по любым, а только по вполне определенным стационарным орбитам.
Почему е- не падает- объясняется тем, что кулоновские силы притяжения между ядром и е- уравниваются центробежной силой вращающегося вокруг него е-
2. электроны, двигаясь по стационарным орбитам энергии не излучают, их общий запас энергии остается постоянным. Поглащение и излучение энергии происходит при переходе е- с одной орбиты на другую.
Электронные облака.
Квантовомеханическая теория заставила отказаться от принятых представлений о том, что е- в атоме движется по определенным траекториям. Движение е- представляется в виде облака отрицательного электричества. Область пространства вокруг ядра где оказывается е-, называется электронным облаком.
Формула е- -ных облаков может быть различной: сферической, гантелеобразной и более сложной.
Электроотрицательность.
При химических реакциях атомы различных элементов превращаются в положительную или отрицательно заряженные ионы. Атом, потерявший е-, превращается в (+) заряженный ион: Э-n е- = Эn+
атом, присоединивший е-, становится отрицательно заряженным ионом:
Э+n е- = Эn-
как потеря, так и присоединение атомами е- сопровождается энергетическим эффектом, т.е поглощением или выделением энергии. Энергия, которую необходимо затратить для отрыва е- от атома и превращения его в положительный ион, называется энергией ионизации.
У различных элементов энергия ионизации имеет различное значение. Самые большие энергии ионизации имеют атомы инертных газов, наименьшие – атомы щелочных Ме.
Чем больше радиус атома, тем слабее притягиваются е- к ядру и, следовательно, тем меньше энергия ионизации, т.е тем меньше энергии нужно затратить на отрыв е- и превращение радиуса атома в положительно заряженный ион. С уменьшение радиуса атома энергии ионизации возрастает.
Энергия, которая выделяется при присоединении е- к нейтральному атому с обр-ем отрицательно заряженного иона, называется энергией сродства к электрону. С уменьшением радиуса атома энергия сродства к е- увеличивается, с увеличением радиуса -уменьшатся.
Электроотрицательность ЭО – представляет собой сумму величин энергии ионизации I и энергии сродства к электрону Е: ЭО=I+Е
ЭО элемента имеет ту де размерность, что и энергия ионизации и энергия сродства к е- : (эВ/моль) электрон-вольт, кДЖ/моль или ккал/моль (киллоджоуаль или ккал на моль).
Чем меньше значение ЭО, тем сильнее выражены у элемента металлические свойства. Чем больше значение ЭО, тем сильнее выражены неметаллические свойства элемента.
