
- •Лабораторная работа №1. Получение соляной кислоты.
- •Общие сведения:
- •Описание схемы установки:
- •Методика проведения опыта.
- •Обработка результатов опыта.
- •Обсуждение результатов опыта:
- •Контрольные вопросы:
- •Лабораторная работа № 2. «Обжиг серного колчедана».
- •Общие сведения:
- •Методика проведения работы:
- •Обработка результатов опыта:
- •Определение лимитирующей стадии процесса.
- •Контрольные вопросы.
- •Лабораторная работа №3 Коксование каменного угля
- •Контрольные вопросы
- •Лабораторная работа № 5. Реактор периодического действия.
- •Основные математические модели химических реакторов.
- •Математическая модель реактора идеального смещения периодического действия (рис – п).
- •Математическая модель реактора идеального вытеснения непрерывного действия (рив).
- •Математическая модель реактора непрерывного действия идеального смешения (рис – н).
- •Описание экспериментальной установки.
- •Порядок выполнения работы:
- •Порядок измерения рН раствора.
- •Обработка полученных данных.
- •Расчет периодического реактора идеального перемешивания.
- •Определение объема реактора идеального вытеснения.
- •Расчет объема реактора идеального смешения (рис – н).
- •Оформление работы:
- •Контрольные вопросы:
- •Лабораторная работа №6 разделение жидких смесей на ректификационной колонке при атмосферном давлении
- •Лабораторная работа №7 получение азотной кислоты
- •Лабораторная работа № 8. Определение фракционного состава жидкого топлива (бензина). Введение.
- •Аппаратура:
- •Подготовка к испытанию:
- •Проведение опыта.
- •Контрольные вопросы.
Контрольные вопросы
Как применяется кокс, полученный коксованием каменного угля?
Как протекает процесс коксования и в результате чего образуется твердый остаток каменноугольный пек?
Какие продукты получаются в процессе коксования каменного угля?
В каких склянках происходит процесс абсорбции газа жидкостью?
С какой целью проводят титрование серной кислотой?
От каких условий зависит наиболее полное протекание процесса коксования?
Лабораторная работа №4.
Умягчение воды ионообменным способом.
Цель работы: Ознакомление с ионообменным способом обессоливание воды и стандартной методикой определения ее жесткости.
Введение.
Использование воды в химической промышленности чрезвычайно разнообразно: вода является широко распространенным растворителем, реакционной средой, сырьем для получения водорода, тяжелой воды. Различных водосодержащих веществ, употребляется в качестве теплоносителя и охлаждающего агента.
Применение воды в различных производствах требует специальной ее подготовки. Общая схема водоподготовки, методы и число операций устанавливаются в зависимости от состава воды, требования потребителей и технико-экономических соображений.
Основными операциями водоподготовки являются: очистка от механических примесей, умягчение и обессоливание, дегазация и обеззараживание и в ряде случаев нейтрализация.
Водосмягчением называется полное и частичное удаление солей кальция и магния, содержание которых в воде обусловливает ее жидкость. Различают общую жесткость, карбонатную (временную) и некарбонатную (постоянную).
Общая жесткость воды определяется суммарным содержанием в ней кальция и магния.
Карбонатная (временная) жесткость создается наличием в воде бикарбонатов кальция и магния, которые при кипячении переходят в средние или основные соли и выпадают в осадок:
Ca(HCO3)2 —→ CaCO3 + H2O +CO2↑
Mg(HCO3)2 —→ MgCO3 + CO2↑ + H2O
MgCO3 + H2O —→ Mg(OH)2 + CO2↑
Постоянная жесткость обусловлена нитратами, хлоридами, сульфитами и другими солями кальция и магния, не выпадающими в осадок при кипячении.
Жесткость воды измеряют в миллиграмм-эквивалентах на 1 л.
Один миллиграм-эквивалент жесткости отвечает содержанию 20,04 мг Са или 12,16 мг Mg на один литр воды.
Применяемые на практике методы умягчения воды можно разделить на следующие группы: термические, химические, ионообменные и комбинированные.
Выбор того или другого метода определяется глубиной умягчения, качеством исходной воды и экономическими соображениями.
Обессоливание заключается в удалении или понижении всех содержащихся в воде солей.
Умягчение или обессоливание воды наиболее эффективно может быть осуществлено методом ионного обмена. Этот метод основан на способности некоторых твердых трудно растворимых веществ – ионитов – к обменным реакциям с катионами или анионами, содержащимся в воде.
Иониты, способные обмениваться с катионами, находящимися в растворе, называются катионитами; способные обменивать анионы – анионитами.
В настоящее время в промышленности в качестве катионитов применяются сульфированные угли и ряд синтетических смол: фенольные, резорциновые, пирогаллоловые и другие, содержащие оксигруппы, карбоксильные и сульфогруппы.
В качестве анионитов применяются карбомидные, мелоиновые, анилиновые и прочие синтетические смолы.
Реакции ионообмена обратимы, поэтому после истощения ионит регенерируют, обрабатывая его соответствующими растворами солей, кислот или щелочей.
Процессы катионного обмена могут быть описаны следующими уравнениями:
Na2R + (Ca, Mg)(HCO3)2 ↔ (Ca, Mg)R + 2NaHCO3 , (1);
Na2R + (Ca, Mg)SO4 ↔ (Ca, Mg)SO4 + Na2SO4 , (2);
Анионный обмен осуществляется следующим образом:
ROH + Cl - ↔ RCl + OH - (3);
2ROH + SO42- ↔ R2SO4 + 2OH - (4);
где: R – составная часть ионита, за исключением активной (обменивающейся) группы.
Процесс регенерации может быть представлен уравнениями:
CaR + 2NaCl ↔ Na2R + CaCl2 (5);
CaR + 2HCl ↔ H2R + CaCl2 (6);
RCl + NaOH ↔ ROH + NaCl (7);
При регенерации иониты разрыхляют, чтобы предотвратить их слеживание и уплотнение, так как связанное с этим неравномерное распределение жидкости по рабочему сечению фильтра может вызвать значительное снижение их емкости.
Промышленные схемы в зависимости от требований производства включают в себя или колонки – фильтры с катионитом (умягчение) или последовательное соединение катионитных и анионитных колонок (обессоливание).
Одним из показателей качества ионита является его обменная емкость т.е. количество задержанных ионов в грамм – эквивалентах на 1 м3 ионита. Различают полную обменную емкость и рабочую. Рабочая обменная емкость выражается количеством ионов кальция и магния в г/экв., поглощаемым единицей объема ионита до момента проскока.
Рабочая емкость ионита зависит от природы ионита, рН раствора, величин и структуры зерен ионита (величины его поверхности), скорости фильтрования воды, степени ее жесткости, температуры и т.д.
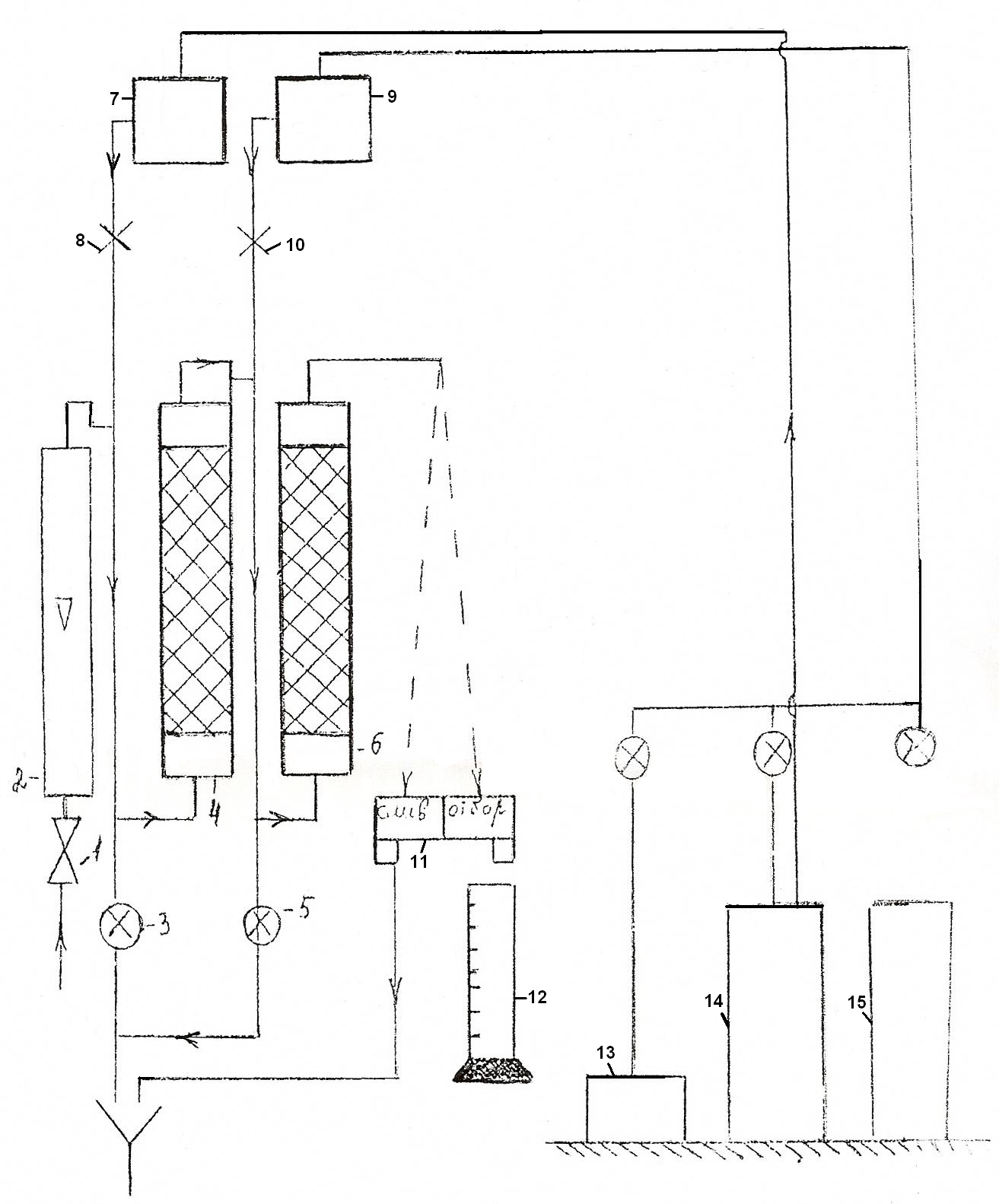
Описание установки.
Схема установки ионного обмена показана на рис.3.
Обессоливание воды в этой установке производится на катионовом 4 и анионовом 6 фильтрах, куда вода последовательно поступает с заданной скоростью из водопровода через вентиль 1.
Скорость воды устанавливается с помощью ротаметра 2.
Обессоленная вода после фильтров 4 и 6 через пробоотборник 11 либо сливается в канализацию, либо отбирается в мерный цилиндр 12 для анализа.
Основным элементом схемы является катионовый фильтр 4. В нижней и верхней частях фильтра укреплены сетки, между которыми располагается катионит. Высота слоя катионита замеряется во время опыта.
Цикл работы фильтра складывается из собственно умягчения и регенерации. Умягчение воды осуществляется пропусканием ее через слой катионита и продолжается до достижения определенной жесткости на выходе из фильтра. При умягчении протекают реакции 1 и 2.
В анионитовом фильтре 6 попутно из воды удаляются анионы по реакциям 3 и 4.
Регенерация состоит из трех операций: взрыхление, собственно регенерация и отмывка ионитов.
Взрыхление осуществляется током воды снизу вверх. Для этого закрываются краны 10 и 8 и открывается кран 1. для более эффективного взрыхления кран 1 следует периодически закрывать и открывать. При взрыхлении происходит разрушение спрессованных (слежавшихся) мест ионита.
Регенерация осуществляется пропусканием регенерирующего раствора через слой ионита. Для регенерации катионита используется 3% раствор соляной кислоты, а для регенерации анионита – 3% щелочи. Регенерирующие растворы подаются из бачков 7 и 9.
Примечание: Наполнение бачков 7 и 9 осуществляется с помощью компрессора 13 из емкостей 14 и 15, лаборантским составом.
Методика проведения опыта.
В начале работы производится слив застоявшейся в трубах воды. Для этого открывают краны 1 и 3 и в течение 5 минут вода сливается в канализацию. Определяется начальная жесткость воды (см. методику определения жесткости воды).
Производится взрыхление ионитов.
Собственно регенерация разбивается на два этапа: регенерацию катионита и анионита. Для регенерации катионита кран 3 и открываются краны 5 и 8 . В этом случае кислота из бочка 7 проходит через колонку 4 и через кран 5 сливается в канализацию. Кран 8 открывается с таким расчетом, чтобы время регенерации катионита составляло не менее 10 – 15 мин.
Для регенерации анионита краны 8 и 5 закрываются и открывается кран 10. Скорость подачи щелочи задается такой же, как и при регенерации катионита. После регенерации кран 10 закрывается.
После регенерации ионитов необходимо отмыть фильтры от кислоты и щелочи. Для этого краном 1 устанавливают заданный расход воды (задается преподавателем в пределах 30 – 70 делении по ротаметру). Промывку продолжают 5 – 10 минут.
После промывки при заданном расходе воды через каждые 3 мин. с помощью пробоотборника 11 обессоленная вода отбирается в цилиндр 12 для анализа на жесткость. Отбор проб и определение жесткости воды ведется до тех пор, пока последняя не будет превышать величины, которая задается преподавателем.
Замеряется время умягчения воды от начала умягчения до момента проскока. Закрывается кран 1.
По окончании опыта приводят в порядок рабочее место и сдают дежурному лаборанту.
Методика определения жесткости воды.
В коническую колбу емкостью 250 – 300 мл наливается отобранная проба в количестве 100 мл. Приливают 5 мл аммиачно-буферного раствора и 6 – 7 капель индикатора – хрома темно-синего.
При наличии ионов Са2 и Mg2 раствор окрашивается в темно-малиновый цвет. Этот раствор титруют 0,05 – 0,1 раствором трилона «Б» до изменения цвета.
Жесткость определяется по формуле:
N * K * V * 1000
Ж = ———————— , мг-экв (8);
100
где: N – нормальность раствора трилона «Б».
К – поправочный коэффициент, учитывающий изменение нормальности раствора трилона «Б» при его стоянии (значения К даются лаборантом).
V – количество трилона «Б», пошедшего на титрование.
100 – объем воды, взятой на титрование, мл.
Обработка результатов опыта.
Опытные данные наносят на график в координатах общая жесткость воды – время от начала умягчения.
Рассчитывают рабочую емкость катионита для условий опыта по формуле:
V * τ (Жвх – Σni=1Жвых/ n) * 100
EP = —————————————— мг-экв/м3 (9);
Vkat
Где: V – объемный расход воды, м3/с.
τ – время умягчения до момента проскока, с.
Жвых и Жвх – общая жесткость исходной воды на выходе из катионита за время 5,10,15 и т.д. минут.
Vkat – объем катионита, м3.
n - число анализов воды.
Определяется время рабочего цикла установки:
τ = τрегенер + τпромывки + τработы ионитов (10);
Контрольные вопросы.
Подземная, атмосферная и поверхностная вода. Их характеристика.
Качество воды. Параметры, оценивающие качество воды. Их определение.
Методы умягчения воды. Достоинства и недостатки каждого из них.
Методы очистки сточных вод. Области применения каждого из методов.
Биохимическая очистка сточных вод.
Термические методы очистки сточных вод.
Химические методы очистки промышленных сточных вод.
Очистка сточных вод флотацией и электрофлотацией.
Электрохимическая очистка сточных вод.
Ионообменные способы очистки сточных вод.
Обессоливание воды методом электродиализа.
