
- •Лабораторная работа №1. Получение соляной кислоты.
- •Общие сведения:
- •Описание схемы установки:
- •Методика проведения опыта.
- •Обработка результатов опыта.
- •Обсуждение результатов опыта:
- •Контрольные вопросы:
- •Лабораторная работа № 2. «Обжиг серного колчедана».
- •Общие сведения:
- •Методика проведения работы:
- •Обработка результатов опыта:
- •Определение лимитирующей стадии процесса.
- •Контрольные вопросы.
- •Лабораторная работа №3 Коксование каменного угля
- •Контрольные вопросы
- •Лабораторная работа № 5. Реактор периодического действия.
- •Основные математические модели химических реакторов.
- •Математическая модель реактора идеального смещения периодического действия (рис – п).
- •Математическая модель реактора идеального вытеснения непрерывного действия (рив).
- •Математическая модель реактора непрерывного действия идеального смешения (рис – н).
- •Описание экспериментальной установки.
- •Порядок выполнения работы:
- •Порядок измерения рН раствора.
- •Обработка полученных данных.
- •Расчет периодического реактора идеального перемешивания.
- •Определение объема реактора идеального вытеснения.
- •Расчет объема реактора идеального смешения (рис – н).
- •Оформление работы:
- •Контрольные вопросы:
- •Лабораторная работа №6 разделение жидких смесей на ректификационной колонке при атмосферном давлении
- •Лабораторная работа №7 получение азотной кислоты
- •Лабораторная работа № 8. Определение фракционного состава жидкого топлива (бензина). Введение.
- •Аппаратура:
- •Подготовка к испытанию:
- •Проведение опыта.
- •Контрольные вопросы.
Лабораторная работа №7 получение азотной кислоты
Азотную кислоту в промышленности получают окислением аммиака. Этот процесс одновременно и необратимо протекает в трех направлениях:
4NН3 + 5О2 → 4NО + 6Н2О + 907 кДж (1)
4NН3 + 4О2 → 2N2О + 6Н2О + 1104,9 кДж (2)
4NН3 + 3О2 → 2N2 + 6Н2О + 1269 кДж (3)
Повышение температуры свыше 1173 К приводит к разложению исходного аммиака и образующегося в результате реакции оксида азота (II):
2NН3 ↔ N2 + 3Н2
2NO ↔ N2 + O2
Кроме того, оксид азота может взаимодействовать с непрореагировавшим аммиаком:
4NН3 + 6NО → 5N2+6Н2О
Для того чтобы направить реакцию в сторону образования оксида азота, используют сплав платины с родием, который избирательно ускоряет реакцию первую.
Исходя из уравнения реакции, воздушноаммиачная смесь должна иметь соотношение МН3:О2 = 1:1,25. На практике это соотношение поддерживают 1:1,7 - 1,8, что соответствует 10 - 11% аммиака в воздушноаммиачной смеси. Повышение содержания аммиака в смеси до 15% делает ее взрывоопасной. Повышение давления не оказывает влияния на выход оксида азота. Полученный оксид азота (II) затем окисляется до оксида азота (IV):
2NО+ О2 ↔2NО2+112,3 кДж
Эта реакция до температуры 413 К практически необратима. Повышение давления и понижение температуры способствуют образованию оксида азота (IV). Нитрозные газы поступают на абсорбцию водой:
2NO2 + H2О → HNО3 + НNО2 + 116 кДж
3НNО2→ HNО3 + 2NО + H2O – 75 кДж
Абсорбция протекает успешнее при понижении температуры и повышении давления.
Цель работы. Получить азотную кислоту окислением аммиака и определить ее выход в зависимости от условий проведения процесса.
Порядок проведения работы. В лаборатории для окисления аммиака используют различные катализаторы. С наибольшей скоростью окисление аммиака протекает на платине, поэтому ее использование в лаборатории в виде сеток или платинированного асбеста дает наилучшие результаты. Большее распространение в учебных лабораториях получили железохромовый и ванадиевый катализаторы, которые изготавливаются на основе оксидов этих металлов. Катализатором заполняют кварцевую или фарфоровую трубку, помещенную в печь. Образовавшиеся нитрозные газы поглощают водой с несколькими каплями пероксида водорода.
Синтез азотной кислоты из воздушноаммиачной смеси, полученной из аммиака и воздуха
Реактивы: раствор соляной кислоты концентрации 0,1 моль/л, пероксид водорода, метиловый оранжевый, хлорид аммония, гидроксид кальция.
Оборудование: установка для получения азотной кислоты (рисунок 1), мерный цилиндр вместимостью 1 л, коническая колба на 250 мл.
Газообразный аммиак из градуированного газометра 1 через поглотительную склянку 4, наполненную раствором гидроксида калия, и реометр 5 поступает в смеситель 6. Аммиак в газометр набирают либо из баллона с аммиаком, либо после получения непосредственно в лаборатории реакцией хлорида, аммония с натронной известью. Газометр и реометр наполняют аммонизированным раствором хлорида натрия.

Рисунок 1. Установка для получения азотной кислоты:
1 - газометр; 2, 3, 22 - краны; 4, 9, 20 - поглотительные склянки с раствором КаОН; 5, 11 - реометры; 6 - смеситель; 7 - воздуходувка; 8, 12, 19 -трехходовые краны; 10 - осушительная колонка; 13 - печь; 14 - трубка с катализатором; 15 - термопара; 16 - терморегулятор; 17 - холодильник; 18 -поглотительные колонки (абсорберы); 21 - аспиратор.
Воздух подается воздуходувкой 7, очищается в поглотительной склянке 9, наполненной раствором гидроксида калия, в осушительной колонке 10 с твердым гидроксидом калия и через реометр 11 также направляется в смеситель 6. Перед началом синтеза проводят анализ воздушноаммиачной смеси, ее пропускают через поглотительную склянку 20 и аспиратор 21.
Для проведения работы в склянку 20 наливают 10 мл 0,1 моль/л раствора НС1 с 2-3 каплями метилового оранжевого, заполняют аспиратор 21 водой и наливают в поглотители 18 по 50 мл дистиллированной воды с 8-10 каплями пероксида водорода. После этого установку проверяют на герметичность. С этой целью на выходную трубку поглотителя 18 надевают резиновый шланг с зажимом, закрывают кран 2, открывают кран 3, краны 8 и 19 ставят в положение, кран 12 в положение и открывают на аспираторе кран 22. Если по истечении небольшого промежутка времени вода перестает вытекать из аспиратора, то установка собрана герметично.
После проверки герметичности закрывают кран 3, переключают краны 12 и 19 в положение и приступают к получению воздушноаммиачной смеси.
Скорость подачи аммиака и воздуха регулируют так, чтобы в смеси было около 10% аммиака. Для этого включают воздуходувку и при помощи трехходового крана 8 устанавливают расход воздуха по реометру 11 около 18—20 л/ч, затем открывают на газометре кран 2 и регулируют подачу аммиака краном 3 по реометру 5. Расход аммиака должен быть около 2 л/ч. Образующаяся смесь через кран 19 выбрасывается в вытяжной шкаф.
Для анализа воздушноаммиачной смеси переводят кран 19 в положение и пропускают смесь через склянку 20 до изменения окраски индикатора, после чего сразу закрывают кран 22, переводят кран 19 в другое положение и измеряют объем воды, вытекшей из аспиратора.
Так как с 10 мл раствора соляной кислоты концентрации 0,1 моль/л взаимодействует 22,4 мл аммиака, процентное содержание аммиака можно вычислить по формуле:
η=
где V2 - объем аммиака, равный 22,4 мл;
V1 - объем воды, вытекшей из аспиратора, мл.
Если содержание аммиака в воздушноаммиачной смеси находится в пределах 10%, то приступают к окислению аммиака. С этой целью включают печь 14 и при достижении заданной температуры переключают кран 19 в положение, а кран 12 в положение, отмечая при этом объем аммиака в газометре 1. Пропускают воздушноаммиачную смесь через трубку с катализатором 14 и поглощают образующиеся нитрозные газы в поглотителях 18 до израсходования определенного объема аммиака из газометра (обычно в интервале 0,5-2 л). Работу можно проводить либо меняя температуру реакции при постоянной объемной скорости подачи газов, либо меняя объемную скорость газов при постоянной температуре. Раствор азотной кислоты сливают из поглотителей 18 в коническую колбу, промывают поглотители небольшими количествами дистиллированной воды, которые присоединяют к раствору в колбе добавляют 3-5 капель метилового оранжевого и титруют раствором гидроксида калия концентрации 0,1 моль/л. Образовавшуюся в результате синтеза массу азотной кислоты (т 1) вычисляют по формуле:
m1= 0,0063·V,
где V - объем раствора 0,1 моль/л гидроксида калия, мл; 0,0063 - масса азотной кислоты в г, соответствующая массе гидроксида калия, содержащейся в 1 мл ее 0,1 моль/л раствора.
Зная объем аммиака, взятый из газометра, рассчитывают по уравнению реакции теоретический выход азотной кислоты.
Синтез азотной кислоты из воздушноаммиачной смеси, полученной пропусканием воздуха через раствор аммиака
Реактивы: раствор аммиака (10-12%-ный), растворы соляной кислоты концентрации 0,1 моль/л, гидроксида калия - 0,1 моль/л, метиловый оранжевый, пероксид водорода.
Оборудование: установка для получения азотной кислоты (рисунок 2), коническая колба на 250 мл, ареометр.
Воздушноаммиачную смесь получают, пропуская из градуированного газометра 1 воздух через колбу 5, наполненную раствором аммиака (10-12%-ный). Для проведения эксперимента проверяют ареометром плотность раствора аммиака и заполняют газометр воздухом. Для этого закрывают кран 3, ставят трехходовой кран 5 в положение и открывают краны 2 и 4. Затем в поглотитель 12 заливают 50 мл 0,1 моль/л раствора соляной кислоты, а поглотители 18 по 50 мл дистиллированной воды с 8-12 каплями пероксида водорода. Проверяют герметичность прибора, временно устанавливая зажимы на выходе из поглотителей 12 и 18, открывая на газометре краны 3 и 4 при соответствующих положениях трехходовых кранов 5 и 10. Если по истечении некоторого времени в склянке 8 прекратится пробулькивание пузырьков воздуха и на дифманометре и будет постоянное давление, то систему можно считать герметичной. Закрывают кран 4 и снимают зажимы на выходе из поглотителей 12 и 18. Для определения содержания аммиака в воздушноаммиачной смеси устанавливают трехходовой кран 10 в положение и пропускают 1 л воздуха, регулируя скорость его подачи краном 4 по реометру 6 в пределах 2-3 л/ч. Воздух перед колбой с аммиаком очищается в поглотительной склянке 7 раствором гидроксида калия, а воздушноаммиачная смесь - твердым гидроксидом калия в осушительной колонке 9. Воздушноаммиачная смесь направляется в поглотитель 12, где аммиак поглощается раствором соляной кислоты концентрации 0,1 моль/л. После пропускания 1 л воздуха, не меняя положения крана 4, необходимо привести кран 5 в положение, отключая газометр от системы. При дальнейшей работе объемная скорость подачи воздуха будет постоянной, если уровень воды в колоколе газометра поддерживать по возможности стабильным, что контролируется показаниями дифманометра 11.
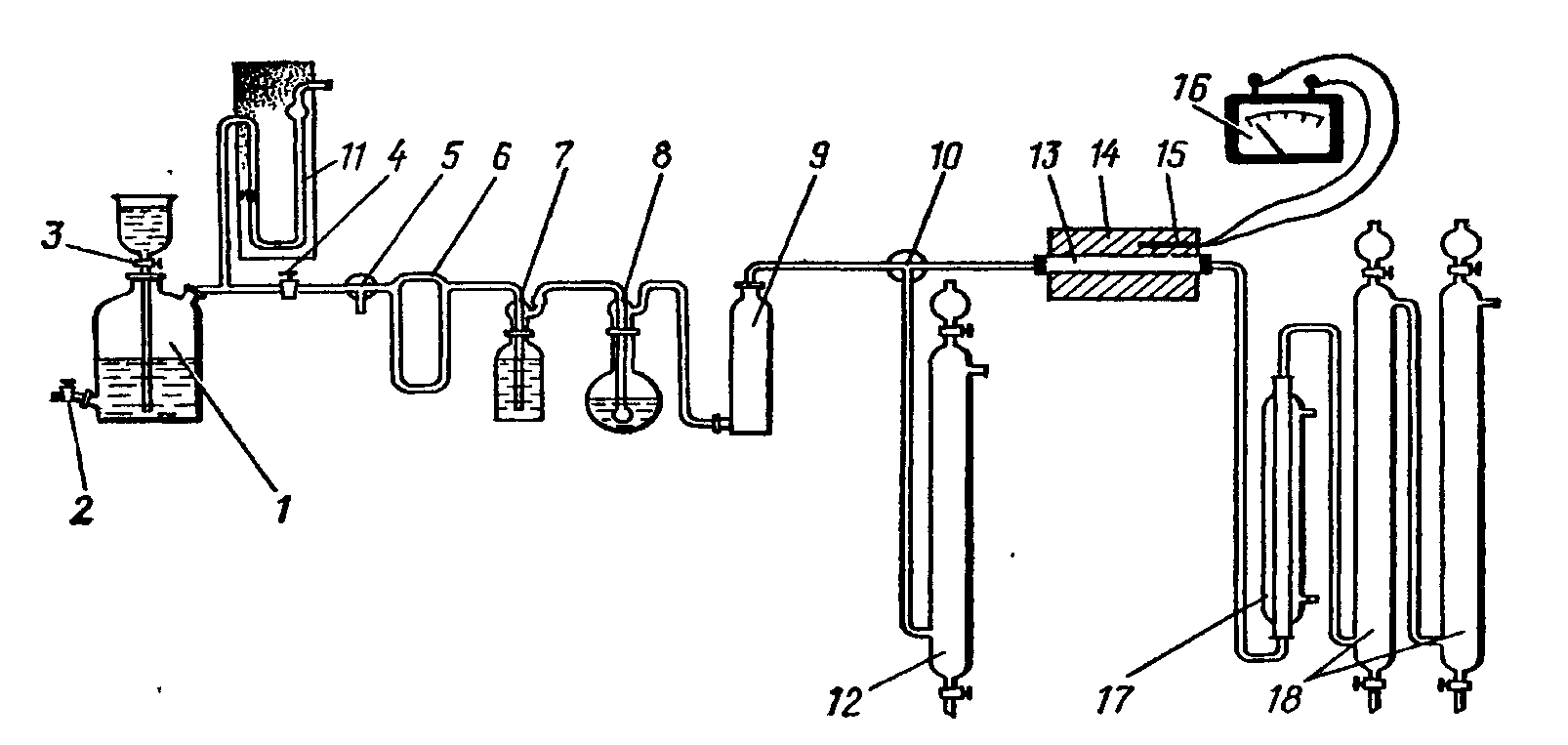
Рисунок 2. Установка для получения азотной кислоты:
1 - газометр с воздухом; 2,3, 4 - краны; 5, 10 - трехходовые краны; 6 - реометр; 7 - промывная склянка с раствором кон; 8 - колба с раствором аммиака; 9 -осушительная колонка; И - дифманометр; 12 - поглотительная колонка для определения содержания аммиака в воздушноаммиачной смеси; 13 - трубка с катализатором; 14 -. трубчатая печь; 15 - термопара; 16 - терморегулятор; 1 7 - холодильник; 1 8 - абсорберы.
Раствор из поглотителя 12 сливают, промывают поглотитель небольшим количеством дистиллированной воды, присоединяют ее к раствору аммиака и титруют в присутствии метилового оранжевого раствором гидроксида калия концентрации 0,1 моль/л. По результатам анализа рассчитывают массу аммиака (т), содержащуюся в 1 л воздушноаммиачной смеси при данной объемной скорости подачи воздуха:
m=(V0- V1)·0,0017
где V0 - объем 0,1 моль/л раствора НС1 в поглотительных колонках, мл;
V1 - объем 0,1 моль/л раствора гидроксида калия, израсходованный на титрование, мл;
0,0017 — масса аммиака (г), соответствующая массе соляной кислоты, содержащейся в 1 мл раствора концентраци и 0,1 моль/л.
Анализ воздушноаммиачной смеси проводят 2-3 раза.
Определив содержание аммиака в воздушноаммиачной смеси, включают печь 14 и при достижении заданной преподавателем температуры устанавливают краны 5 и 10 в положение (┴). Далее проводят работу и определяют массу образовавшейся азотной кислоты и выход ее в процентах, как описано в первом варианте получения азотной кислоты.
