
- •2.) Переваривание и всасывание углеводов, роль глюТов в этом процессе, инсулинзависимые и инсулиннезависимые ткани. Врожденные патологии переваривания дисахаридов.
- •2) Гликогенез, ферменты, регуляция, биологическая роль гликогена. Гликогенолиз, виды, ферменты гликогенолиза и его значение для организма. Регуляция. Гликогенозы.
- •5 Билет
- •3.В стационар поступил ребенок 6 месяцев
- •2.Регуляция липидного обмена. Роль печени в нарушении липидного обмена. Жировая дистрофия печени и факторы ее вызывающие.
- •2)Витамины антиоксиданты е и с.
5 Билет
1)В организме чела 50тыс. белков,отличающихся первичной струтрурой,конформацией,строением активного центра и функцями. Кроме того б различаются количеством амино-кт, из кот они построены. К глобулярным относ белки форма кот – эллипс. Они имеют компактную стр-ру и многие из них за счёт удаления гидрофобных радикалов внутрь хорошо р-римы в воде (глобин). Фибоиллярные белки имеют вытянутую нитевидную структуру. К ним относятся каллогены, эластин, керотин, вып в орг чел стр-рную ф-ю. Прстые белки содерж в своём составе только полипептидные цепи, сост из аминок-тных остатков. Сложные белки содерж помими полипептид цепей небелковую часть, присоед к белкут слабыми или ковалентными связями. Небелковая часть может быть представлена ионами Ме, к-либо орг молекулами и носит наз простетической группы. По сходству вып ф-ий белки можно раздеоить на группы: - ферменты (специализир белки, ускоряющие теч хим р-ий), - регуляторные белки (относятся к белковым гормонам, участвующие в поддержании гомеостаза), - рецепторные белки (сигнальные молекулы действуют на внутриклет процессы через взаимодейств с белками- рецепторами), - транспортные б (переносят специфич лиганды от одного органа к другому), стр-рные б (предают форму тканям, создают опору, опред мех св-ва), - защит б (узнают и связывают чужеродные молекулы, нейтрализуя их), - сократительные белки (при вып своих фи-й наделяют Кл способностью сокращатся и передвигаться). Белки, имеющие гомологичные участки полипептид цепи, сходную конформацию и родственные ф-и выд в сем-ва белков. Сериновые протеазы – семейство ф-тов, кот исп уникальный активированный остаток сериа, располож в актив центре, для связ и каталитич гидролиза апептид связей в б. Иммуноглобулины – специфические белки, вырабатываемые б-лимфоцитами в ответ на попадание.
2) Аэробный распад глюкозы включает реакции аэробного гликолиза и последующее окисление пирувата в реакциях катаболизма.1)Начинается с фосфорилирования глюкозы, катализирует гексокиназа. 2)изомеризация г-6-ф во ф-6-ф (фермент глюкозофосфатизомераза. 3)фосфорилирование ф-6-ф с образованием фруктозо-1,6-бисфосфата (фермент фосфофруктокиназа). 4)расщепление фруктозо-1,6-бисфосфата на глицеральдегид-3-фосфат и дигидроксиацетат (фермент фруктозо-1,6-бисфосфат-альдолаза). 5)взаимопревращение триозофосфатов (фермент триозофосфатизомераза) 6)окисление глицеральдегид-3-фосфата до 1.3-дифосфоглицерата (фермент глицеральдегид-3-фосфат-дегидрогеназа). 7)перенос фосфатной группы с 1.3-дифосфоглицерата на АДФ (ферм фосфоглицераткиназа) 8)изомеризация 3-фосфоглицерата в 2-фосфоглицерат (ферм фосфоглицерат-фосфомутаза) 9)дегидратация 2-фосфоглицерата с обр-м фосфоенолпирувата (ферм енолаза). 10)перенос фосфатной группы с фосфоенолпирувата на АДФ (ферм пируваткиназа) с образованием пирувата. Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему, получившую название «пируватдегидрогеназный комплекс». 1)пируват теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (E1)2)оксиэтильная группа комплекса E1–ТПФ–СНОН–СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидроли-поилацетилтрансферазой (Е2) 3)Этот фермент катализирует III стадию – перенос ацетильной группы на коэнзим КоА (HS-KoA) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением. 4)регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид–Е2. При участии фермента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. 5)восстановленный ФАДН2 дигидро-липоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н+. Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий. В нем принимают участие 3 фермента (пируватдегидрогеназа, ди-гидролипоилацетилтрансфераза, дигидролипоилдегидрогеназа) и 5 коферментов (ТПФ, амид липоевой кислоты, коэнзим А, ФАД и НАД), Энергетическая эффективность: 38 АТФ
3)Ответ: Больному 30 лет, обратился к врачу с жалобами на боли в животе особенно после приема жирной пищи. Из анамнеза видим, что это гиперлипопротеинемия, т.к. это состояние возникает после приема пищи. Гиперлипопротеинемия 5 видов. Из лабораторных данных видно, что это гиперлипопротеинемия по Фридрексону 5 типа. Все 5 видов различаются увеличением, дефектом липопротеинов. Липопротеины - это транспортные формы липидов. Повышение содержание хиломикронов, пре-бетта липопротеида и триглицеридов. Это свойственно именно 5 типу. Причина возникновения на данный момент не известна. Можно спутать с 4 типом, но при 4 типе преобладает углеводная пища.
Билет 6
1)Электрофорез белков: метод основан на том что при определенном значении рН и ионной силы р-ра, белки двигатся в электрическом поле со скоростью пропорциональной их суммарному заряду. Белки имеющие «-» заряд двигаются к аноду(+), а «+» белки двигаются к катоду(-).
Электрофорез проводят на бумаге, крахмальном геле. Разрешащющая способность электрофореза в геле выше, чем на бумаге.
Содержание белка в крови-65-85г/л-общий белок(все белки). Общ.белок складывается из глобулинов, фибриногенов(2-4г/л), альбуминов.
Повыш.содержание общ.белка-больше 85.
Гиперпротеинемия: -абсолют,-относит.
Абсолют: за счет повыш. глобул.фракций.(после перенесенных инфекций, при потере жидкости, физ.нагр). наблюдается сгущение крови, повыш.потооотделение.
Разновидность гиперпротеинемии:
Паропротеинемия-появл. В крови пат.белков (140-160 г/л)-при онк.заб.
Гипопротеинемия-приголодании, заб.почек, печени –абсолют.
Относит. – при разбавлении крови – нарушение выделит.функции почек.
2) Пентозофосфатный путь является альтернативным путем окисления глюкозы. Этот процесс поставляет клеткам кофермент NADPH, использующийся как донор водорода в реакциях восстановления и гидроксилирования и обеспечивает клетки рибозой, которая участвует в синтезе нуклеотидов и нуклеиновых кислот. Пентозофосфатный путь не приводит к образованию АТФ. ферменты пентозофосфатного пути локализованы в цитозоле. В пентозофосфатном пути превращения глюкозы можно выделить 2 части: окислительный и неокислительный пути образования пентоз. Окислительный путь образования пентоз включает 2 реакции дегидрирования. Коферментом дегидрогеназ является НАДФ+, который восстанавливается в НАДФН. Пентозы образуются в результате реакции окислительного декарбоксилирования. Неокислительный путь образования пентоз включает реакции переноса 2 и 3 углеродных фрагментов с одной молекулы на другую. Этот путь служит для синтеза пентоз. Неокислительный путь образования пентоз обратим=> может служить для образования гексоз и пентоз. . Пентозофосфатный путь может функционировать в печени, жи ровой ткани, молочной железе, коре надпочечников эритроцитах, в органах, где активно протекают вое синтезы, например синтез липидов за один оборот цикла полностью распадается одна молекула глю козы. Суммарное уравнение пентозофосфатного цикла: 6глюкозо-6-фосфат + 12NADP+-> 12NADPH + 12Н+ 5глюкозо-6-фосфат + 6С02
Промежуточные продукты (фруктозо-6-фосфат, глицероальдегид-3-фосфат) могут включаться в пути аэробного и анаэробного окисления и служить источником энергии для синтеза АТФ.
3) У женщины повышенное содержание ЛПВП. ЛПНП в норме. Возможно у женщины какая то из липопротинемии связанная с повышенным содержанием ЛПВП. Так как ЛПНП в норме, а ЛПВП выше нормы, то даже не смотря на высокое содержание холестерина в сыворотке, рик атеросклероза аленький дальнейшего лечения не требуется.
Билет 7
1) Ферменты или энзимы – белковые катализаторы, ускоряющие реакции в клетке.
Около 10000. Ферменты имеют белковую структуру, одно обнаружена способность некоторых молекул РНК осуществлять аутокатализ. Такие РНК называются рибозимы. Ферменты катализируют превращение веществ, которые называются субстратами в продукты. Ферменты отличаются от небиологических катализаторов следующими свойствами: 1.Высокой эффективностью действия, скорость ферментативной реакции в 109 – 1012 раз выше. 2.Высокой специфичностью действия, способность выбирать определенное S и катализировать специфическую реакцию. Благодаря действию ферментов реакции в клетке не беспорядочны, не перепутываются, а образуют строго определенные метаболические пути. 3.Мягкими условиями протекания ферментативной реакции. t=37, нормальное атмосферное давление, pH близкое к нейтральному. 4. Способностью к регуляции.
Классификация и номенклатура. Изоферменты.
1.Оксидоредуктазы – ферменты, катализирующие окислит.-востановит. реакции. Подразделяются на 17 подклассов. 2.Трансферазы – ферменты, катализирующие реакции переноса различных групп от одного субстрата к другому. 8 подклассов. 3.Гидролазы – ферменты, катализирующие разрыв связей в субстратах с присоединением воды. 11 подклассов. 4. Лиазы – ферменты, катализирующие реакции разрыва связей в субстрате без присоединения воды или окисления . 4 подкласса. 5.Изомеразы – ферменты, катализирующие превращения в пределах одной молекулы. 6.Лигазы – ферменты, катализирующие соединение двух молекул с использованием энергии фосфатной связи. 5 подклассов.
Изоферменты – формы фермента, который катализирует одну и туже реакцию, но различны по некоторым свойствам (аминокисл. составу, М, Составу субъединиц, электрофоретической подвижности и др.). Изоферменты – продукты экспрессии разных генов. Существуют различия в распределении изоферментов в разных тканях, в разных участках клетки, что отражает различие в метаболизме. Одним из осн-х механизмов образования изоферментов включает объединение разных субъединиц в разных комбинациях при образовании активного олигомерного фермента, т.е. 4-ная структура.
11)Зависимость скорости ферментативной реакции .
При повышении температуры на каждые 10 °С скорость увеличивается примерно вдвое (правило Вант-Гоф-фа). Однако для ферментативных реакций это правило справедливо лишь в области низких температур — до 50-60 °С. При более высоких температурах ускоряется денатурация фермента, что означает уменьшение его количества; соответственно снижается и скорость реакции. При 80-90 °С большинство ферментов денатурируется практически мгновенно. Количественное определение ферментов рекомендуется проводить при 25 °С.
Изменение рН приводит к изменению степени ионизации ионогенных групп в активном центре, а это влияет на сродство субстрата к активному центру и на каталитический механизм. Кроме того, изменение ионизации белка (не только в области активного центра) вызывает конформационные изменения молекулы фермента. существует некоторое оптимальное состояние ионизации фермента, обеспечивающее наилучшее соединение с субстратом и катализ реакции. Оптимум рН для большинства ферментов лежит в пределах от 6 до 8. Однако есть и исключения: например, пепсин наиболее активен при рН 2. Количественное определение ферментов проводят при оптимальном для данного фермента рН.
По мере увеличения времени инкубации скорость реакции снижается. Это может происходить вследствие уменьшения концентрации субстрата, увеличения скорости обратной реакции
При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает.
2) Инсулин-белковый гормон, синтезируется и секретируется в кровь в-клетками островков Лангерганса поджелудочной железы. Эти клетки чувствительны к изменениям содержания глюкозы в крови и секретируют инсулин в ответ на повышение ее содержания. Синтез инсулина регулируется глюкозой. Секреция инсулина и глюкагона также регулируется глюкозой( глюкоза подавляет секрецию глюкагона). Сам инсулин снижает секрецию глюкагона.
Инсулин увеличивает проницаемость плазматических мембран для глюкозы, активирует ключевые ферменты гликолиза, стимулирует образование в печени и мышцах из глюкозы гликогена, усиливает синтез жиров и белков. Кроме того, инсулин подавляет активность ферментов, расщепляющих гликоген и жиры. То есть, помимо анаболического действия, инсулин обладает также и антикатаболическим эффектом.
Нарушение секреции инсулина вследствие деструкции бета-клеток — абсолютная недостаточность инсулина — является ключевым звеном патогенеза сахарного диабета 1-го типа. Нарушение действия инсулина на ткани — относительная инсулиновая недостаточность — имеет важное место в развитии сахарного диабета 2-го типа.
Глюкагон-«гормон голода», вырабатывается а-клетками поджелудочной железы в ответ на снижение уровня глюкозы в крови. По химической природе глюкагон – пептид
Механизм действия глюкагона обусловлен его связыванием со специфическими глюкагоновыми рецепторами клеток печени. Это приводит к повышению опосредованной G-белком активности аденилатциклазы и увеличению образования цАМФ. Результатом является усиление катаболизма депонированного в печени гликогена (гликогенолиза).
Адреналин – выделяется из клеток мозгового вещества надпочечников в ответ на сигналы нервной системы, при возникновении экстремальных ситуаций. Он обеспечивает мышцы и мозг источником энергии.
3) Ответ: Аминолевулинатсинтаза и аминолевулинатдегидратаза принимают участие в биосинтезе гема Аминолевулинатсинтаза является пиридоксальзависимым ферментом. Аллостерическим ингибитором активности является гем. Аминолевулинатдегидратаза катализирует реакцию конденсации двух молекул аминолевулиновой кислоты с образованием двух молекул воды и одной молекулы порфобилиногена. Аминолевулинатдегидратаза также ингибируется гемом, но так как активность этого фермента в 80 раз выше,чем АЛК-синтазы, то это не имеет большого физиологического значения. -Промежуточные продукты- см. схему ниже.
-Наследственные и приобретенные нарушения синтеза тема, сопровождающиеся повышением содержания порфобилиногенов, а также продуктов их окисления в тканях и крови и появлением их в моче, называют Порфириями. ("порфирин"- с греческого означает пурпурный). В зависимости от основной локализации патологического процесса различают печеночные формы и эритропоэтические наследственные Порфирии. Эритропоэтические- сопровождаются накоплением порфиринов в нормобластах и эритроцитах, а печеночные - в гепатоцитах. Аминолевулинат и порфириногены являются нейротоксинами. Прием лекарств, являющихся индукторами синтеза АЛК-синтазы, может вызвать обострение. ( Сульфаниламидные препараты, барбитураты, HIIBC, стероиды, гестагены.), т.к. в их метаболизме должны принимать участие гемсодержащие белки, снижается внутриклеточное содержание гема, что приводит к дерепрессии синтеза АЛК-синтазы. Повышение активности АЛК-синтазы приводит к значительному накоплению АПК ипорфобилиногенаСхема. Последовательные стадии биосинтеза гема, с указанием предшественников, экскретаруемых с мочой, при различных формах Порфирии. Фигурные скобки объединяют соединения, которые экскретируются с мочой в избыточном количестве при обострении указанных форм Порфирии.
Билет№8
1. Зависимость скорости ферментативных реакций от температуры, рН, концентраций фермента и субстрата. Единицы измерения активности и количества ферментов
Зависимость активности ферментов (скорости реакции) от температуры описывается колоколообразной кривой с максимумом скорости при значениях оптимальной температуры для данного фермента
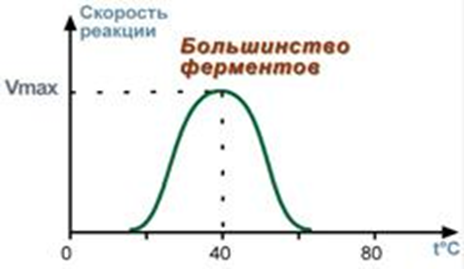
При повышении температуры на каждые 10 °С скорость увеличивается примерно вдвое (правило Вант-Гоф-фа). Однако для ферментативных реакций это правило справедливо лишь в области низких температур — до 50-60 °С. При более высоких температурах ускоряется денатурация фермента, что означает уменьшение его количества; соответственно снижается и скорость реакции. При 80-90 °С большинство ферментов денатурируется практически мгновенно. Количественное определение ферментов рекомендуется проводить при 25 °С.
При понижении температуры активность ферментов понижается
Для каждого фермента существует определенный узкий интервал рН среды, который является оптимальным для проявления его высшей активности
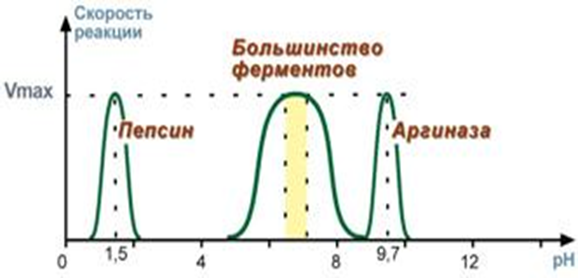
Изменение рН приводит к изменению степени ионизации ионогенных групп в активном центре, а это влияет на сродство субстрата к активному центру и на каталитический механизм. Кроме того, изменение ионизации белка (не только в области активного центра) вызывает конформационные изменения молекулы фермента. существует некоторое оптимальное состояние ионизации фермента, обеспечивающее наилучшее соединение с субстратом и катализ реакции. Оптимум рН для большинства ферментов лежит в пределах от 6 до 8. Однако есть и исключения: например, пепсин наиболее активен при рН
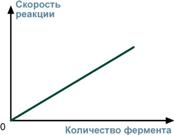
При увеличении количества молекул фермента скорость реакции возрастает непрерывно и прямо пропорционально количеству фермента, т.к. большее количество молекул фермента производит большее число молекул продукта
2. Количественное определение ферментов проводят при оптимальном для данного фермента рН.
По мере увеличения времени инкубации скорость реакции снижается. Это может происходить вследствие уменьшения концентрации субстрата, увеличения скорости обратной реакции (в результате накопления продукта прямой реакции), ингибирования фермента продуктом реакции, денатурации фермента.
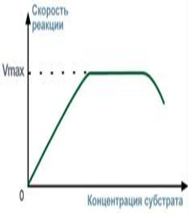
При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает.
Для определения количества фермента в практике пользуются условными величинами, характеризующими активность фермента: одна международная ед. активности (МЕ) соответствует такому количесву фермента,которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведеия ферментативной реации. Оптимальные условия индивидуальны для каждого фермента и зависят от температы среды,pH раствора,при отсутсвии активаторов и ингибиторов.
![]()
В медицинской практике для оценки активности ферментов используют международные единицы активности .Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность фермента численно равную количеству единиц активности фермента в образце ткани, деленному на массу белка в ткани.
Количество молекул фермента:
![]()
2. Глюконеогенез, ключевые ферменты, значение для организма. Регуляция гликолиза и гликонеогенеза в печени. Цикл Кори. Глюкозо-аланиновый цикл.
Глюконеогенез – путь образования глюкозы denovo из низкомолекулярных метаболитов углеводного обмена цикла Кребса и соединений неуглеводной природы. Поддерживает уровень глюкозы в крови в период длительного голодания и интесивных физических нагрузок.Локализуется в печени,в корковом веществе почек, в слизистый оболочке кишечника.Первичные субстраты: лактат, аминокислоты и глицерол. Ключевые реакции гликонеогенеза: 1.Гексокеназная реакция обходится за счет глюкозо-6-фосфатазы. 2.Фосфофруктокеназная реакция обходится за счет фруктозо-1,6-дифосфатазы. 3.Пируваткеназная реакция протекает по двум путям. В первом пути ПВК под влиянием пируваткарбоксилазы превращается в ЩУК. А затем ФЭП-карбоксиназа превращает ЩУК в ФЭП. Во втором пути – при помощи малатфермента ПВК -> малат -> (малатдегидрогениза) ЩУК. ФЭП-карбоксикеназа превращает ЩУК в ФЭП в цепи гликонеогенеза, его недостаток приводит к смерти «в колыбели».
Регуляция глюконеогенеза
Гормональная активация глюконеогенеза осуществляется глюкокортикоидами, которые увеличивают синтез пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы. Глюкагон стимулирует те же самые ферменты через аденилатциклазный механизм путем фосфорилирования.
Также имеется метаболическая регуляция, при которой аллостерически активируется пируваткарбоксилаза при помощи ацетил-SКоА, фруктозо-1,6-дифосфатаза при участии АТФ.
Гормональные и метаболические факторы, регулирующие гликолиз и глюконеогенез
Регуляция гликолиза
Гликолиз стимулируется инсулином, повышающим количество молекул гексокиназы, фосфофруктокиназы, пируваткиназы.
В печени активность глюкокиназы регулируется гормонами: активацию вызывает инсулин и андрогены, подавляют ее активность глюкокортикоиды и эстрогены.
Для метаболической регуляции чувствительной является фосфофруктокиназа. Она активируется АМФ и собственным субстратом, ингибируется – АТФ, лимонной кислотой, жирными кислотами. Пируваткиназа активируется фруктозо-1,6-дифосфатом. Гексокиназа непеченочных клеток ингибируется продуктом собственной реакции – глюкозо-6-фосфатом.
Цикл Кори(глюкозолактатный цикл)
Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень .в печени отношение NADH/NAD ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в обратном направление, т.е. в сторону образования пирувата из лактата .Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглащается скелетным мышцами.Цикл Кори включает 2 важные функции:
1-обеспечивает утилизация лактата.
2-предотвращает накопление лактата.
Глюкозо- аланиновый цикл:
Глюкоза в мышцах – пируват в мышцах - аланин в мышцах- аланин в печени – глюкоза в печени – глюкоза в мышцах.
Весь цикл не приводит к увеличению количества глюкозы в мышцах,но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
3. В инфекционное отделение
У больного паренхиматозный гепатит. Катаболизм осуществляется в лизосомах: гемоглобин-метгемоглобин-холегемоглобин-верлоглобин-биливердин-билирубин-УДФглюкуронат-
Критерии паренхиматозной желтухи: снижение кол-ва альбумина, увеличен гамма глобулин, увеличен общ билирубин, увеличен не конъюгированный и конъюгированный билирубин. Уробелиноген определяется.
Билет 9
1)Обратимые ингибиторы связ с ферментом слабыми нековолентными связями и при опред условиях легко отделяются от ф-тов.
Бывают: конкурентными (обратимое снижение скорости ферментативной реккции,вызванное ингибитором,связываясь с активным центром и препятствывая образованию фермент-субстратного комплекса); неконкурентные (ингибитор взаимодействует с фер-том в участке, отличном от активного центра). Необратимое ингибирование наблюдается в случае образования ковалентных связей между молекулами ингибитора и ф-та. Модификации подвергается актив центр, и ф-т не вып кат ф-ий (ионы Ме: Hg, Ag). Многие лек препараты оказывают терапевтическое действие по мех конкурентного ингибирования. Четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катализирующюю р-ю гидролиза ацетилхолина на холин и уксусную к-ту. При добавлении ингибиторов, активность ацетилхолистеразы уменьшается, конц субстрата увелич, что сопровождается усилением проведения нервного импульса. Ингибитора холинэстеразы используются про лечении мышечных дистрофий.
2) Глюконеогенез – путь образования глюкозы из низкомолекулярных метаболитов углеводного обмена цикла Кребса и соединений неуглеводной природы. По своей значимости вводит гораздо больший вклад в поддержание глюкозы в крови, чем гликогенолиз. Ключевые реакции гликонеогенеза: 1.Гексокеназная реакция обходится за счет глюкозо-6-фосфатазы. 2.Фосфофруктокеназная реакция обходится за счет фруктозо-1,6-дифосфатазы. 3.Пируваткеназная реакция протекает по двум путям. В первом пути ПВК под влиянием пируваткарбоксилазы превращается в ЩУК. А затем ФЭП-карбоксиназа превращает ЩУК в ФЭП. Во втором пути – при помощи малатфермента ПВК -> малат -> (малатдегидрогениза) ЩУК. ФЭП-карбоксикеназа превращает ЩУК в ФЭП в цепи гликонеогенеза, его недостаток приводит к смерти «в колыбели».
Цикл Кори(глюкозолактатный цикл)
Реакци
Источники субстрата гликонеогенеза.Мышечная ткань-главный источник субстратов гликонеогенеза. Существуют гликогенные аминокислоты(аланин,аспарагиновая кислота)
В ходе реакций переаминирования они превращаются в кетокислоты. По схеме глюкозоаланиновый цикл.
РЕАКЦИЯ
При длительном голодании белки мышечной ткани явл. важнейшим резервом гликонеогенеза. Эндокринная регуляция гликонеогенеза. Важнейшими активаторами гликонеогенеза – гормоны глюкокортикоиды. Они осуществляют эффект на уровне генома способствуя биосинтезу ферментов: ФЭП и карбоксикеназы и трансаминаз.
3) у больного наблюдается гемолитическая желтуха как результат сильного гемолиза эритроцитов, обусловленным чрезмерным образованием билирубина. Главный признак-повышенное содержание в крови непрямого билирубина. Концентрация общ. Билирубина (75% непрямого билирубина)
Дефект мембраны->повышение хрупкости и снижение элластичности мембраны->ускорение их разрушение в сосудистом русле и селезенке->усиление образования свободного гемоглобина->усиленное образование билирубина-> накопление в кровяном русле и тканях->желтушность костных покровов и слиз оболочек
Билет№10
1.Различия ферментного состава органов и тканей. Энзимодиагностика и энзимотерапия. Кофакторы ферментов – ионы металлов.
Большинство ф-тов имеет внутриклет локализацию и распределены в орг нереавномерно. Все ф-ты одного метаболитического пути находятся в одном отделе клетки. Особенно разделение метаболических путей важно для противоположно направленных катаболических и анаболических процессов (синтез жирных к-т происх в цитопл, а их распад в митохондриях).



2.Метаболизм фруктозы и галактозы. Наследственные нарушения их обмена
Фруктоза и галактоза вовлекаются в гликолиз следующим образом. D-фруктоза фосфорилируется с помощью неспецифической гексокиназы с образованием фруктозо-6-фосфата. Фруктозо-6-фосфат является метаболитом гликолиза.Имеется и другой путь включения фруктозы в гликолиз. Она фосфорилируется с помощью фруктокиназы печени с образованием фруктозо-1-фосфа¬та, который далее расщепляется фруктозо-1-фосфат-альдолазой на дигидроксиацетонфосфат и глицеральдегид. Галактоза сначала также фосфорилируется в печени с помощью галактокиназы:
D-Галактоза + АТФ ->D-Галактозо-1-фосфат + АДФ.
Далее галактозо-1-фосфат превращается в глюкозо-1 -фосфат. Для этой реак¬ции изомеризации необходимы уридиндифосфатглюкоза (УДФ-глюкоза) и фермент галактозо-1-фосфат-уоидилтрансфераза:
Галактозо-1-фосфат+УДФ-глюкоза-—► УДФ-галактоза+Глюкозо-1-фосфат
Глюкозо-1-фосфат подключается к гликолизу, а УДФ- галактоза превращается в УДФ-глюкозу с помощью УДФ-глюкозоэпимеразы. Гала́ктоземи́я — наследственное заболевание, в основе которого лежит нарушение обмена веществ на пути преобразования галактозы в глюкозу (мутация структурного гена, ответственного за синтез фермента галактозо-1-фосфатуридилтрансферазы). Заболевание проявляется выраженной желтухой, увеличением печени, неврологической симптоматикой (судороги, нистагм (непроизвольное движение глазных яблок), гипотония мышц), рвотой; в дальнейшем обнаруживается отставание в физическом и нервно-психическом развитии, возникает катаракта. Фруктоземия состоит в непереносимости больным фруктозы вследствие недостаточности фермента фруктозо-1-фосфат-альдолазы в печени, почках, слизистой оболочке кишечника. Возникшая при этом фруктозурия сопровождается протеинурией и аминоацидурией. В крови накапливаются фруктоза и продукты ее обмена, обладающие токсическими свойствами.
3.Больной, 39 лет.
Механическая желтуха,вызвана закупоркой желчного хода камнем желчного пузыря. Билирубин в кишечник не попадает, продукт его катаболизма уробелин в моче и кале нет, кал обеспечен. Происходит утечка билирубина в кровь, поэтому у больного повышенное содержание конъюгированного билирубина. Растворенный билирубин выводится с мочой придавая ей насыщенный цвет . Общ билирубин 8,5-20,5 мкмоль/л
Билет№11
1.Коферментные функции водорастворимых витаминов
Для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Кофермент может быть связан с белковой частью молекулы ковалентными (липоевая кислота) и нековалентными связями (например тиаминдифосфат). Традиционно к коферментам относят производные витаминов, геммы входящие в состав цитохромов. Дегидрогеназы катализируют реакции отщепления водорода (пример: НАД и ФАД). Все ферменты этой группы обладают высокой субстратной специфичностью. Витамин В2. в основе его структуры лежит структура изоаллоксазина, соединенного со спиртом ребитолом. В слизистой оболочке кишечника после всасывания витамина происходит образование кофермента ФАД. Он входит в состав флавиновых ферментов, принимающих участие в окислит.-востанов. реакциях. Вит В6. Все его формы используются в организме для синтеза коферментов: перидоксальфосфата и передоксаминфосфата. коферменты образуются путем фосфорилирования по гидроксиметильной группе в 5-ом положении перемидинового кольца. Вит РР. Никотиновая кислота входит в организме в состав НАД, выполняющего функцию кофермента различных дегидрогеназ.
2.Классификация липидов.
Имеются 3 клас
сификации липидов: А.структурная: 1.Липидные мономеры: высшие углеводы, высшие алифатические спирты, альдегиды, кетоны, изопреноиды и их производные, высшие аминокислоты (сфингозины), высшие полиолы, жирные кислоты. 2.Многокомпонентные липиды: 1)простые липиды: воски, простие диольные липиды, глицериды, стериды. 2)смешанные (сложные липиды): фосфолипиды, фосфоглицериды, диольные фосфатиды, сфингофосфатиды, гликолипиды. Б.по физико-химическим свойствам. Учитывает степень полярности: нейтральные и полярные. В.по физиологическому значению: резервные и структурные.
Глицериды или аглицерины – наиболее распространенная группа простых липидов. Являются эфирами жирных кислот и терхатамного спирта глицерина. Их называют нейтральными липидами. Глицериды делятся на моно-, ди-, три-глицерины, содержащие соответственно 1, 2 и 3 эфиросвязанных ацила (RCO-). Триацилглицерины определяют энергетическое значение пищевых липидов, которые составляют от 1/3 до 1/2 энергетической ценности пищи.
Источниками витамина F явл. растительные масла. Сут. потребность в нем взрослого человека 5-10 гр. Витамина F представляет собой сумму незаменимых ненасыщенных жирных кислот. Однако не все жирные кислоты обладают совойствами витамина F. Необходим для нормального роста и регенерации кожного эпителия, а так же для построения таких важных регуляторов, как простогландины. Поддерживает запасы витамина А и облегчает его действие на обмен веществ в тканях. Снижает содержание холестерина в крови. Очевидно, истинной не заменимой жирной кислотой явл. арахидоновая, которая одна устраняет все признаки недостаточности.
3)
. 1. Это классический случай подагры. В данном случае присутствовали все признаки воспаления, и лабораторно была подтверждена гиперурикемия. Почечная колика могла быть обусловлена почечным уратным камнем. Подагра чаще встречается у мужчин, чем у женщин, страдающих ожирением, более распространена при гипертриглицеридемии, гипертензии, переедании и злоупотреблении алкоголем.
2. У человека мочевая кислота является конечным продуктом обмена пуриновых нуклеотидов и выводится из организма с мочой. Полиморфизм ферментов, участвующих в синтезе пуриновых нуклеотидов de novo (фосфорибозилпирофосфатсинтетаза - ФРПФ-синтетаза), сопровождается образованием белков с низкой ферментативной активностью или нечувствительных к действию аллостерических эффекторов. При этом нарушается регуляция синтеза пуриновых нуклеотидов по механизму отрицательной обратной связи. Избыточно синтезирующиеся нуклеотиды подвергаются катаболизму, и образование мочевой кислоты повышается. Тот же результат получается при снижении активности путей реутилизации пуринов (фермент гипоксантин-гуанин-фосфорибозиптрансфераза). Аденин, гуанин и гипоксантин не используются повторно, а превращаются в мочевую кислоту, возникает гиперурикемия. Следствием гиперурикемии (состояния организма, при котором содержание мочевой кислоты в сыворотке крови превышает уровень растворимости) является кристаллизация уратов в мягких тканях и связках. Кристаллы урата натрия, формирующиеся в суставах, захватываются нейтрофилами, но повреждают мембраны их лизосом, вызывая разрушение клеток. Образование
свободных супероксидных радикалов и высвобождение лизосомальных ферментов в полость сустава вызывают острую воспалительную реакцию. Выброс интерлейкина-1 из моноцитов и тканевых макрофагов обеспечивает дополнительный воспалительный стимул. Отложение уратов в ткани почек приводит к развитию почечной недостаточности - частому осложнению подагры. Ураты могут откладываться и в почечных лоханках, образуя почечные камни (примерно у половины больных подагрой).
3. Требуется назначить больному аллопуринол. Аллопуринол - это структурный аналог гипоксантина. Ксантиноксидаза окисляет аллопуринол в оксипуринол (аналог ксантина), но этот продукт реакции остается прочно связан с активным центром фермента: таким образом, фермент оказывается инактивированным (суицидный катализ): При этом конечным продуктом катаболизма пуринов становится гипоксантин, растворимость которого в моче и в других жидкостях организма примерно в 10 раз больше, чем растворимость мочевой кислоты, и поэтому гипоксантин легче выводится из организма.
Билет№12
.1 Обмен веществ: питание, метаболизм и выделение продуктов метаболизма. Состав пищи человека.
Белки: общая суточная потребность 80-100гр из них половина должна быть животного происхождения. Любые пищевые белки сравниваются по составу аминокислот с эталоном (в качестве эталона – белок куриного яйца, наиболее отвечающий физиологическим потребностям организма). Углеводы: биологическую ценность имеют полисахариды (крахмал гликоген), дисахариды (сахароза, лактоза, мальтоза). Основная функция углеводов – энергетическая, но они выполняют структурные и др. функции. Суточная потребность 400-500 гр. из них 400 приходится на крахмал. Жиры: суточная потребность 80-100 гр. из них 20-25 гр. растительные. С жирами пищи поступают не заменимые для организма жирорастворимые витамины и витаминоподобные соединения. Вода относится к незаменимым компонентам пищи, хотя небольшие количества воды образуются из белков, жиров и углеводов при обмене их с тканями. Суточная потребность 1750-2200 гр.
Пищевые вещества могут быть заменимыми и не заменимыми. К не заменимым относятся все минеральные соединения, витамины, некоторые аминокислоты (Валин, лейцин, изолейцин, треонин, метионин, аргенин, лизин, фенилаланин, триптофан, гистидин) и полиненасыщенные жирные кислоты.
Обмен веществ складывается из 3 этапов: поступление веществ в организм, межуточный обмен (тканевое превращение веществ), образование и выведение конечных продуктов. Пища человека содержит множество химических соединений, как органических, так и минеральных, они делятся на основные пищевые вещества (белки, жиры, углеводы) и минорные (витамины и минеральные соединения). Основные пищевые вещества – полимеры в ЖКТ гидрализуются при участии ферментов до мономеров, которые проникают через клеточные мембраны кишечного эпителия. Полимеры практически не всасываются. С кровью мономеры транспортируются во все органы и ткани и используются клетками. Пищевые вещества могут быть заменимыми и не заменимыми. К не заменимым относятся все минеральные соединения, витамины, некоторые аминокислоты (Валин, лейцин, изолейцин, треонин, метионин, аргенин, лизин, фенилаланин, триптофан, гистидин) и полиненасыщенные жирные кислоты (ленолевая, линоленовая). Метаболизм: выделяют 2 направления превращения веществ: катаболизм и анаболизм. При катаболизме органические вещества распадаются до СО2 и Н2О, процесс эгзэрганический (выделение энергии). У взрослого человека за сутки высвобождается 8-12 тысяч кДж. Анаболизм – превращение простых веществ в более сложные. Многие реакции анаболизма являются эндэргоническими (поглощение энергии) источником которой служит процесс катаболизма.
2.Стеролы и стериды. Холестерин, структура, содержание в сыворотке крови, биологическая роль.
Стероиды-это изопреноиды. Бльшинство стероидов являются спиртами, которые именуются стеринами или стеролами. Стерины животного происхождения-зоостерины, а растительные-фитостерины. Родоначальник этой группы-холестерин-важная составная часть клеточных мембран животных клеток .Суточная потребность в холестерине (1 г) может в принципе покрываться за счет биосинтеза. При смешанной диете примерно половина суточной нормы холестерина синтезируется в кишечнике, коже и главным образом в печени (примерно 50%), а остальной холестерин поступает с пищей. Значительная часть холестерина включена в липидный слой плазматических мембран. Большое количество холестерина расходуется в биосинтезе желчных кислот (см. с. 306), часть выделяется с желчью. Ежесуточно из организма выводится примерно 1 г холестерина. Очень небольшая часть холестерина используется для биосинтеза стероидных гормонов, включая кортизол, кортизон, альдостерон, женских половых гормонов эстрогенов и прогестерона, мужского полового гормона тестостерона, а по последним данным — играет важную роль в передаче нервных импульсов в головном мозге. В тканях он находится в свободном виде или в виде эфиров(стериды). Холестерином богаты ткани животных, в больших кол-ах содержится в нервной ткани, надпочечниках печени. Холестерин относят к стр-ным липидам. Стериды- это эфиры стеринов и жирных кислот. Чаще встречаются эфиры холестерина. Они содержатся в продуктах животного происхождение. Растительные стериды типа жирнокислотнык эфиров стигмастерина, эргостерина, бета-ситостерина составляют значительную часть общих стеринов растений.
3Описано наследственное заболевание, при котором в детском возрасте для больных характерно отставание
.Это заболевание - первичная наследственная оротовая ацидурия. Заболевание связано с утратой во всех тестированных типах клеток функции фермента, катализирующего две последние реакции синтеза УМФ образование и декарбоксилирование оротидиловой кислоты. В результате возникает недостаточность пиримидиновых нуклеотидов, необходимых для синтеза нуклеиновых кислот, а оротовая кислота, наоборот, накапливается. Накоплению оротовой кислоты способствует также и отсутствие в этих условиях регулирующего действия УТФ (аллостерического ингибитора фермента, способствующего образованию оротовой кислоты), поскольку концентрация в клетках УТФ, как и других пиримидиновых нуклеотидов, постоянно низка. Вследствие этого синтез оротовой кислоты происходит с большей скоростью, чем в нормё. При отсутствии лечения наследственная оротацидурия приводит к развитию необратимого резкого отставания умственного и физического развития; обычно больные погибают в первые годы жизни. Оротовая кислота не токсична, нарушения развития являются следствием "пиримидинового голода". Поэтому для лечения этой болезни применяют уридин (нуклеозид) в дозах 0,5-1,0 г в сутки. Это обеспечивает образование УМФ и других пиримидиновых нуклеотидов в обход нарушенных реакций:
Уридин + АТФ УМФ + АДФ Такое лечение устраняет "пиримидиновый голод" и, кроме того, снижает выделение оротовой кислоты, поскольку включается механизм ингибирования первой реакции метаболического пути. Лечение должно продолжаться без перерыва на протяжении всей жизни, уридин для таких больных является незаменимым пищевым фактором наряду с витаминами и незаменимыми аминокислотами.
Причиной оротацидурии может быть также введение аллопуринола при лечении подагры. Аллопуринол в организме частично превращается в аналог природного мононуклеотида (оксипуринолмононуклеотид), который является сильным ингибитором реакции декарбоксилирования оротидиловой кислоты, вследствие чего и вызывает накопление оротовой кислоты в тканях.
Билет №13
1.Витамины. Классификация, функции витаминов. Алиментарные и вторичные авитаминозы и гиповитаминозы. Гипервитаминозы
17 Витамины: их концентрация и суточная потребность невелики, но при недостаточном поступлении в организм наступают характерные и опасные патологические изменения. Бывают: 1) Жирорастворимые (А, Д, Е. К) и водорастворимые (группа В). 2) Витамины выполняющие в организме коферментные функции (группа В), витамины – гормоны (А, Д, К) и витамины-антиоксиданты (С, Е). Гиповитаминозы возникают из-за: недостатка пищи, дисбактериоза и бывают наследственной формы гиповитаминоза (дефект ферментов, превращение витаминов в кофермент, отсутствие синтеза апоферментов). Гипервитаминозы – избыточное потребление приводит к нарушениям обмена и функций организма.
2.Эйкозаноиды (простациклины, простагландины, тромбоксаны и лейкотриены), ферменты,
Эйкозаноиды(Э)- биологически активные вещ-ва, синтезируемые большинством клеток из полиеновых жирных кислот, содержащих 20 углеродных атомов. Э, включающие в себя простогландины, тромбоксаны, лейкотриены- высокоактивные регуляторы клеточных функций. Э регулируют секрецию воды и натрия почками, влияют на образование тромбов. Главный субстрат для синтеза Э у человека арахидоновая кислота. Структура и номенклатура: 1-простогландины- обозначают символы(PG A, PG- простогландин, А-заместитель в пятичленном кольце в молекуле Э). Фермент, катализирующий 1-й этап синтеза простогландинов называется PG H2 синтазой и имеет 2 каталитических центра- циклооксигеназа и пероксидаза. Фермент представляет собой димер гликопротеинов, состоящий из идентичных полипептидных цепей. 2-простациклины. Имеют 2 кольца- одно 5-и членное, а другое с участием атомов кислорода. Их подразделяют в зависимости от кол-ва двойных связей в радикале. 3-тромбоксаны- синтезируются в тромбоцитах, имеют 6-и членное кольцо, включающее атом кислорода. 4- лейкотриены- имеют три сопряженные двойные связи. Липоксигеназный путь синтеза, приводящий к образованию большого кол-ва разных Э, начинается с присоединения молекулы кислорода к одному из атомов углерода у двойной связи, с образованием гидроксипероксидов. Э: образуются в различных тканях и органах, действуют по аутокринному механизму. Механизм действия аспирина и других противовоспалительных препаратов нестероидного действия: аспирин- препарат, подавляющий основные признаки воспаления. Он уменьшает синтез медиаторов воспаления, следовательно уменьшает воспалительную реакцию. Использование производных Э в качестве лекарств: PG E1 и PG E2 подавляют секрецию соляной кислоты в желудке, блокируя гистаминовые рецепторы 2-го типа в клетках слизистой оболочки желудка. Эти лекарства, известные как Н2 блокаторы, ускоряют заживление язв желудка и 12 перстной кишки
3.Известна тяжелая форма гиперурикемии, которая наследуется как рецессивный признак, сцепленный с Х-хромосомой (проявляется у мальчиков).
. Речь идет о синдроме Леша-Нихена. Эта болезнь связана с дефектом гипоксантин : - гуанин - фосфорибозилтрансферазы, катализирующий превращение гипоксантина и гуанина в ИМФ и ГМФ соответственно (путь реутилизации); активность этого фермента у больных в тысячи раз ниже, чем в норме или вообще не активен. Вследствие этого гипоксантин и гуанин не используются повторно для синтеза нуклеотидов, а целиком превращаются в мочевую кислоту, что ведет к гиперурикемии. Что вызывает неврологическую симптоматику, пока неизвестно.
Билет №14
1. Минеральные элементы. Классификация. Биологическая роль макро- , микро-
Минеральные вещ-ва поступают в организм с пищей и водой 90% живых клеток C,H2,O2,N.
Классификация: 1. Макроэлементы: Na,Cl,P,Ca,Mg,K,S – составляют 9% веса тела; 2. Микроэлементы: Fe,I,Cu,Mn,Zn,Co,Hb,Se,Vd,Ni; 3. Ультрамикроэлементы: все остальные. Роль: I Макроэлементов: Ме этой группы используются клетки для создания электрич биопотенциалов и биотопов, а также в качестве «спусковых крючков» опосредущих передачу сигналов. II
Микроэлементы: 1.входит в состав актив центров различ ферментов; 2.входят в состав прогармонов и активных гармонов; 3.входят в состав транс белков (Fe в гемоглобин); 4.входят в состав редокс систем, участвующих в продукции анактивации кислородных радикалов в организме. Недостаток или избыток поступления мин вещ-в в организм приводит к развитию патол процессов
Обмен железа. В ор-ме чел-ка содер-ся 3-4 гр Fe, 70%-в Нв эритроцитов, 20%-в гемоглобине мышц, до 15% в печени и селезенке, около 1% в составе гиминовых ферменов, а также белков содержит не геминовое. В процессе эволюции возникли белки способные поддерживать Fe в форме удобной для транспартировки и использовании при синтезе гемма. Это белки трансферин, феритин. Трансферин – гликопротеин плазмы крови, имеет 2 центра связывания Fe, в составе трансферина Fe3Т в форме карбонана. Трасферин содержащий Fe, эндоцитируется в клетки при участии мембранных рецепторов. Главная ф-ция перенос Fe с током крови к местам дипонирования и использования. Содержание трансферрина в плазме крови 4 гр на 1 литр. Ферритин – крупый белок, молек м=450 тыс, содержит 24 едентичных протомера, образующих полую сферу кот=12нм, в белковой оболочке 6 каналов ведущих в полость через них проникают ионы Fe, образуя железное ядро молекулы кол-во атомов Fe от 0 до 4500. Содержится в виде формы гидроксит фосфата Fe3+ . ф-ция: депонирование Fe. Его много в печени, селезенке, кост мозге. Fe освобождается из гемма при распаде эритроцитов и используется повторно.1 мг в сутки теряется с желчью, а суточное потребление 10-20 мг. Всасывание Fe в кишечнике весьма ограничено и происходит при участии белка, сходного с трансферином. Затем Fe поступает на трансфеорин крови, кот передает его феретину в клетках разных органов. В соединении с белками Fe3+, но при переходе с одного белка на другой, валентность каждый раз дважды меняется Fe3+Fe2+Fe3+ Этот процесс катализируется он-вост ферментами или самими белками переносчиками и необходимым для освобождения Fe и соединения с белком.
2.Фосфатиды-глицериды,структура, биологическая роль


3.Редкое заболевание – синдром преждевременного старения связано с генетическим дефектом репарационной системы ДНК. Перечислите возможные повреждения ДНК и приведите примеры репарации ДНК.
. Агенты, вызывающие повреждения ДНК, разнообразны: внешние облучения(ультрафиолетовое, инфракрасное, радиоактивное и пр.), самопроизвольные локальные изменения температуры, свободные радикалы, химические мутагены и т.д. Повреждения ДНК разделяются на: 1) повреждения оснований и 2) повреждения цепей. Повреждения оснований:
1) Гидролитическое выщепление оснований происходит спонтанно или под влиянием вышеперечисленных факторов. Пентозофосфатный остов цепи при этом сохраняется.
2) Гидролитическое дезаминирование оснований: цитозин превращается в урацил; 5- метилцитозин - в тимин; аденин - в гипоксантин.
3) Образование димеров тимина (инициируется ультрафиолетовым облучением)
Повреждения цепей ДНК:
1) Одноцепочечные разрывы
2) Поперечные сшивки
Пример репарации тиминового димера. осуществляется ДНК-полимеразой- р, последняя межнуклеотидная связь образуется ДНК- лигазой.
Билет 15
1)биогеохимические провинции- регионы биосферы в пределах которых по недостат или избыт определенного хим элемента выделяется естественные геохим аномалии. В Чел обл распространены болезни связанные с недостатком I (эндемический зоб). Нехватка йода приводит к базедовой болезни, угнетает деятельность центральной нервной системы, снижает эмоциональный тонус. Симптомами недостатка йода в организме являются плохое самочувствие, снижение работоспособности. У детей при недостатке йода наблюдаются отставание в росте, отклонения в умственном развитии. Ежедневная норма потребления йода – 0.1-0.2 миллиграмма. Йодом богаты, прежде всего, морепродукты – морская рыба, кальмары, креветки, мидии, морская капуста. Содержится йод и в наших повседневных продуктах: сыре, мясе, животном жире, яйцах, грибах, зерновых продуктах.
Селен является синергистом витамина Е и способствует повышению его антиоксидантной активности. Селен входит в состав фермента - йодтиронин-5-дейодиназы (контролирующего образование трийодтиронина состав белков мышечной ткани и, что особенно важно, белков миокарда. В виде селенпротеина является составной частью тестикулярной ткани. Поэтому дефицит селена приводит к ослаблению антиоксидантного статуса, антикацерогенной защиты, обусловливает миокардиодистрофию, нарушение сексуальной функции, иммунодефицита. Помимо этого селен проявляет антимутагенный, антитератогенный, радиопротекторный эффекты, стимулирует антитоксическую защиту, нормализует обмен нуклеиновых кислот и белков, улучшает репродуктивную функцию, нормализует обмен эйкозаноидов (простагландинов, простациклинов, лейкотриенов), регулирует функцию щитовидной и поджелудочной желез. В силу изложенного селен относится к геропротекторам.
2) Переваривание липидов пищи происходит в кишечнике. Основные продукты гидролиза(жирные кислоты и 2-моноацилглицеролы) после всасывания подвергаются ресинтезу и последующей упаковке в хиломикроны в клетках слизистой оболочки кишечника. Переваривание жиров происходит в тонком кишечнике, но уже в желудке небольшая часть жиров гидролизуется под действием ”липазы языка”. Этот фермент синтезируется железами на дорсальной пов-ти языка и устойчив при кислых значениях pH желудочного сока. Поэтому он действует в течение 1-2 часов на жиры пищи в желудке. Действию панкреатической липазы,гидролизирующей жиры, предшествует эмульгирование жиров. Эмульгирование(смешивание жира с водой) происходит в тонком кишечнике под действием солей желчных кислот. Желчные кислоты синтезируются в печени из холистерола и секретируются в желчный пузырь. Содержимое желчного пузыря-желчь. Это вязкая жёлто-зелёная жидкость, содержащая главным образом желчные кислоты; в небольшом кол-ве имеются холестерол и фосфолипиды. Желчные кислоты действуют как детергенты, располагаясь на пов-ти капель жира и снижая пов-ое натяжение. В результате крупные капли жира распадаются на множество мелких. При поступление пищи в желудок, а затем в кишечник клетки слизистой оболочки тонкого кишечника начинают секретаровать в кровь пептидный гормон-холецистокинин. Этот гормон действует на желчный пузырь, стимулируя его сокращение, и на экзокринные клетки поджелудочной железы, стимулируя секркцию пищ-ых ферментов. Секретин-гормон пептидной природы, стимулирующий секрецию бикарбоната в сок поджелуд. железы. Наиболее активно соли желчных кислот всасываются в подвздошной кишке. Желчные кислоты попадают через воротную вену в печень, из печени вновь секретируется в желчный пузырь и далее опять участвует в эмульгировании жиров. Этот путь желчных кислот называют «энтерогепатическая циркуляция». Каждая молекула желчных кислот за сутки проходит 5-8 циклов, и около 5% желчных кислот выделяется с фекалиями. Всасывание жирных кислот со средней длиной цепи, происходит без участия смешанных мицелл. Эти жирные кислоты из клеток слизистой оболочки тонкого кишечника попадают в кровь, связываются с белком альбумином и транспортируются в печень..Нарушение переваривания жиров может быть следствием нескольких причин. 1-на из них-нарушение секреции желчи из желчного пузыря при механическом препятствии оттоку желчи. Уменьшение секреции желчи приводит к нарушению эмульгирования жиров и к снижению способности панкреатической липазы гидролизовать жиры. При нарушении переваривания жиров плохо перевариваются и вещ-ва нелипидной природы, т.к. жир обволакивает частицы пищи и препятствует действию на них ферментов.
