
- •1Вопрос Основные положения теории химического строения а.М. Бутлерова
- •2 Вопрос. Предельные углеводороды
- •Химические свойства
- •Способы получения циклоалканов
- •Алгоритм составления названий предельных углеводородов
- •2.3.1.Прямое галогенирование углеводородов.
- •13 Аминокислоты: классификация, номенклатура, физические и химические св-ва,практическое применение.
- •Некоторые важнейшие a-аминокислоты общей формулы
- •Применение
- •Химические свойства
- •Применение
- •33. Органические соединения, содержащие серу: классификация, получение, свойства, применение
- •15 ВопросХимические свойства белков
- •21 Вопрос. Жиры и масла. Получение ,гидролиз и гидрогенизация жиров.
- •Вопрос 22.Карбоновые кислоты ароматического ряда: получение ,свойство ,применение.
- •25.Нитросоединения
- •20 Вопрос.Высокомолекулярные соединения.
- •27 Вопрос
- •Физические свойства спиртов.
- •30 Вопрос.Ароматические альдегиды и кетоны
- •3.Амины.
- •4.Арены
- •28. Органические соединения содержащие кремний.
25.Нитросоединения
Нитросоединения — органические соединения, содержащие одну или несколько нитрогрупп —NO2. Под нитросоединениями обычно подразумевают C-нитросоединения, в которых нитрогруппа связана с атомом углерода. O-нитросоединения и N-нитросоединения выделяют в отдельные классы — нитроэфиры (органические нитраты) и нитрамины[1].
В зависимости от радикала R, различают алифатические (предельные и непредельные), ациклические, ароматические и гетероциклические нитросоединения. По характеру углеродного атома, с которым связана нитрогруппа, нитросоединения подразделяются на первичные, вторичные и третичные.
Нитрогруппа имеет строение, промежуточное между двумя предельными резонансными структурами:
![]()
Физические свойства. Простейшие нитроалканы-бесцв. жидкости. Физ. св-ва нек-рых алифатических нитросоединений приведены в таблице. Ароматические нитросоединения-бесцв. или светло-желтые высококипящие жидкости или низкоплавкие твердые в-ва, обладающие характерным запахом, плохо раств. в воде, как правило, перегоняются с паром.
Химические свойства
По химическому поведению нитросоединения обнаруживают определенное сходство с азотной кислотой. Это сходство проявляется при окислительно-восстановительных реакциях.
Восстановление нитросоединений (Реакция Зинина):
![]()
Реакции конденсации
Таутомерия нитросоединений.
Применение. Поли-нитросоединения, особенно ароматические, применяют в качестве взрывчатых веществ и в меньшей степени как компонентыракетных топлив. Алифатические нитросоединения используют как р-рители в лакокрасочной пром-сти и в произ-ве полимеров, в частности эфиров целлюлозы; для очистки минер. масел; депарафинизации нефти и др.
Ряд нитросоединений находят применение в качестве биологически активных в-в. Так, эфиры фосфорной к-ты, содержащие нитроарильный фрагмент,-инсектициды; производные 2-нитро-1,3-пропандиола и 2-нитростирола - фунгициды; производные 2,4-динитрофенола - гербициды; a-нитрофураны -важнейшие антибактериальные препараты, на их основе созданы лекарства, обладающие широким спектром действия (фуразолидин и др.). Нек-рые ароматические нитросоединения-душистые в-ва.
Нитросоединения- полупродукты в произ-ве синтетич. красителей, полимеров, моющих препаратов и ингибиторов коррозии; смачивающих, эмульгирующих, диспергирующих и флотац. агентов; пластификаторов и модификаторов полимеров, пигментов и пр. Они находят широкое применение в орг. синтезе и в качестве модельных соед. в теоретич. орг. химии.
26.Органические соединения фосфора
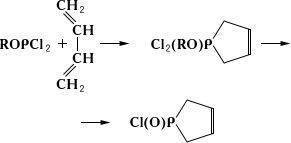
Фосфорорганические соединения, обширный класс органических соединений, содержащих в своём составе фосфор. Различают Ф. с., в молекулах которых фосфор непосредственно связан с углеродом, и Ф. с., в которых фосфор связан с органической частью молекулы через гетероатом – кислород, азот, серу (это главным образом эфиры и др. производные кислот фосфора). Ф. с. второго типа широко распространены в природе преимущественно в виде эфиров фосфорной, пирофосфорной и трифосфорной кислот (см.Фосфорные кислоты); к ним относятся нуклеиновые кислоты, многие важные коферменты, аденозинтрифосфат (см. Аденозинфосфорные кислоты) – переносчик энергии в живых организмах, некоторые витамины. В 60-е гг. 20 в. в природе были найдены Ф. с., содержащие связь фосфор – углерод, например (b-аминоэтилфосфоновая кислота (цилиатин).
Применение. Ф. с. используются в технике, сельском хозяйстве, медицине, а также в научных исследованиях. Больших масштабов достигло производство фосфорорганических пестицидов(инсектицидов, акарицидов, дефолиантов и др.). Однако, отличаясь высокой эффективностью, пестициды в большинстве своём токсичны для людей и животных, поэтому их применение требует мер предосторожности; вместе с тем они не накапливаются во внешней среде и тем выгодно отличаются от пестицидов др. типов. В медицине Ф. с. используются главным образом в офтальмологии; большое значение имеют также биологически важные фосфаты, например аденозинтрифосфат, кокарбоксилаза, ряд витаминов. Как комплексообразователи Ф. с. употребляют в экстракционном обогащении руд (в производстве урана и др. металлов). Многие Ф. с. применяют в качестве присадок к смазочным маслам, повышающих их эксплуатационные свойства (см. Присадки), компонентов пластмасс и волокон, придающих негорючесть (т. н. антипиренов), растворителей, гидравлических жидкостей и др. Получила развитие также область фосфорорганических комплексонов, используемых для разделения, например, металлов и для др. целей.
Получение. В
синтезе Ф. с. большое значение имеют
методы образования связи С–Р. К ним
относятся: Арбузова реакция: (PO)3P
+ R’X (R’PO (OR)2 +
RX; реакция Михаэлиса – Беккера: (RO)2PONa
+ R’X (R’PO (OR)2 +
NaX; синтезы с металлоорганическими
соединениями, например: PСl3 +
SRMgX (R3P
+ 3MgXCl; фосфорилирование по типу реакции
Фриделя – Крафтса: С6H6 +
PСl3![]() С6H5PСl2 +
HСl; присоединение пятихлористого фосфора
к олефинам: С6H5СH
= СH2 +
2PCl5 (C6H5CHCl
– СH2PСl4×PCl5;
алкилирование элементарного фосфора,
например: 3RCl + 2P
С6H5PСl2 +
HСl; присоединение пятихлористого фосфора
к олефинам: С6H5СH
= СH2 +
2PCl5 (C6H5CHCl
– СH2PСl4×PCl5;
алкилирование элементарного фосфора,
например: 3RCl + 2P ![]() RPCl2 +
R2PCl
RPCl2 +
R2PCl
24 вопрос.Фенол
ФЕНОЛЫ – класс органических соединений. Содержат одну или несколько группировок С–ОН, при этом атом углерода входит в состав ароматического (например, бензольного) кольца.
Химические свойства фенола
Фенол представляет собой кристаллическое вещество белого цвета, с характерным резким сладковато-приторным запахом, которое легко окисляется при взаимодействии с воздухом, приобретая сначала розоватый, а спустя некоторое время насыщенный бурый цвет. Особенностью фенола является прекрасная растворимость не только в воде, но и в спирте, щелочной среде, бензоле и ацетоне. Кроме этого, фенол обладает очень низкой температурой плавления и легко переходит в жидкое состояние при температуре +42°C, а также имеет слабые кислотные свойства. Поэтому при взаимодействии со щелочами фенол образует соли, именуемые фенолятами.
Способы получения фенола
В чистом виде в природе фенол не встречается, он является искусственным продуктом органической химии. В настоящее время существует три основных способа получения фенола в промышленных объемах. --Основная доля его производства приходится на так называемый кумпольный метод, который подразумевает окисление воздухом ароматического органического соединения изопропилбензола. --Для производства также используется метилбензол (толуол), в результате окисления которого образуется данное химическое вещество и бензойная кислота. Кроме этого, в некоторых видах промышленности, таких, как производство металлургического кокса, фенол выделяется из каменноугольной смолы. Однако этот способ получения является нерентабельным из-за повышенной энергоемкости. Среди последних достижений химической промышленности – получение фенола путем взаимодействия бензола и уксусной кислоты, а также окислительное хлорирование бензола.
Область применения фенола\Первоначально фенол использовался для производства различного рода красителей, благодаря своему свойству изменять цвет в процессе окисления с бледно-розового до бурого оттенка. Это химическое вещество вошло в состав многих видов синтетических красок. Кроме этого, свойство фенола уничтожать бактерии и микроорганизмы, было взято на вооружение в кожевенном производстве при дублении шкур животных. Позже фенол успешно использовался в медицине как одно из средств обеззараживания и дезинфекции хирургических инструментов и помещений, а в качестве 1,4-процентного водного раствора - как болеутоляющее и антисептик для внутреннего и наружного применения. В настоящее время основное предназначение фенола – химическая промышленность, где это вещество применяется для изготовления пластмассы, фенолформальдегидных смол, таких искусственных волокон, как капрон и нейлон, а также различных антиоксидантов. Кроме этого, фенол применяется для производства пластификаторов, присадок для масел, является одним из компонентов, входящих в состав препаратов по защите растений.
