
- •1Вопрос Основные положения теории химического строения а.М. Бутлерова
- •2 Вопрос. Предельные углеводороды
- •Химические свойства
- •Способы получения циклоалканов
- •Алгоритм составления названий предельных углеводородов
- •2.3.1.Прямое галогенирование углеводородов.
- •13 Аминокислоты: классификация, номенклатура, физические и химические св-ва,практическое применение.
- •Некоторые важнейшие a-аминокислоты общей формулы
- •Применение
- •Химические свойства
- •Применение
- •33. Органические соединения, содержащие серу: классификация, получение, свойства, применение
- •15 ВопросХимические свойства белков
- •21 Вопрос. Жиры и масла. Получение ,гидролиз и гидрогенизация жиров.
- •Вопрос 22.Карбоновые кислоты ароматического ряда: получение ,свойство ,применение.
- •25.Нитросоединения
- •20 Вопрос.Высокомолекулярные соединения.
- •27 Вопрос
- •Физические свойства спиртов.
- •30 Вопрос.Ароматические альдегиды и кетоны
- •3.Амины.
- •4.Арены
- •28. Органические соединения содержащие кремний.
Применение
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты[4].
14. Моносахариды: классификация, номенклатура, физические и химические св-ва,практическое применение.
Моносахариды (от греческого monos: единственный, sacchar: сахар), — органические соединения, одна из основных групп углеводов; самая простая форма сахара; являются обычно бесцветными, растворимыми в воде, прозрачными твердыми веществами. Некоторые моносахариды обладают сладким вкусом. Моносахариды — стандартные блоки, из которых синтезируются дисахариды (такие, как сахароза, мальтоза, лактоза), олигосахариды и полисахариды (такие, как целлюлоза и крахмал), содержат гидроксильные группы и альдегидную(альдозы) или кетогруппу (кетозы). Каждый углеродный атом, с которым соединена гидроксильная группа (за исключением первого и последнего), является хиральным, что дает начало многим изомерным формам. Например, галактоза и глюкоза — альдогексозы, но имеют различные химические и физические свойства. Моносахариды представляют собой производные многоатомных спиртов, содержащие карбонильную группу — альдегидную или кетонную[1].
Виды моносахаридов
Моносахариды подразделяют на триозы, тетрозы, пентозы, гексозы и т. д. (3, 4, 5, 6 и т. д. атомов углерода в цепи); природные моносахариды с углеродной цепью, содержащей более 9 атомов углерода, не обнаружены. Моносахариды, содержащие 5-членный цикл, называются фуранозами, 6-членный — пиранозами.
Для моносахаридов, содержащих n асимметричных атомов углерода, возможно существование 2n стереоизомеров
Классификация моносахаридов
Не все следующие монозы найдены в природе, некоторые были синтезированы:альдоза,кетоза.
Химические свойства
Моносахариды вступают в химические реакции, свойственные карбонильной и гидроксильной группам. Характерная особенность моносахаридов — способность существовать в открытой (ациклической) и циклической формах и давать производные каждой из форм. Большинство моноз циклизуются в водном растворе с образованием гемиацеталей илигемикеталей (в зависимости от того, являются ли они альдозами или кетозами) между спиртом и карбонильной группой того же самого сахара. Глюкоза, например, легко образуетполуацетали, соединяя свои своим С1 и О5, чтобы сформировать 6-членное кольцо, названное пиранозид. Та же самая реакция может иметь место между С1 и О4, чтобы сформировать 5-членное фуранозид.
Применение
Некоторые свободные моносахариды и их производные (например, глюкоза, фруктоза и её дифосфат и др.) используются в пищевой промышленности и медицине.
33. Органические соединения, содержащие серу: классификация, получение, свойства, применение
СЕРАОРГАНИЧЕСИЕ СОЕДИНЕНИЯ – класс органических соединений (см. ХИМИЯ ОРГАНИЧЕСКАЯ), содержащих фрагмент C–S. К этому же классу причисляют и соединения, в которых атом S соединен с С не непосредственно, а через О или N. Многообразие этих соединений увеличивается, т.к. сера может проявлять в соединениях различную степень окисления: S(II), S(IV), S(VI).
Наиболее многочисленны соединения S(II), где сера выступает как аналог кислорода. Тиолы или тиоспирты R–S–H представляют собой серосодержащие аналоги спиртов. Тиоэфиры R–S–R соответствуют простым эфирам. Существуют и тиофенолы Ph–S–H, тиокарбонильные соединения: тиоальдегиды RC(=S)H, тиокетоны R2C=S), тиокарбоновые кислоты RC(=S)OH.
В сераорганических соединениях встречается фрагмент –S–S–, аналогичный пероксидному –О–О– в органических соединениях, например, диалкилдисульфиды R–S–S–R. Среди соединений с высокой степенью окисления серы распространены сульфоксиды R2S=O, а также сульфоновые кислоты R–SO2–OH, представляющие собой, по существу, серную кислоту с одним органическим заместителем, и сульфоны – серная кислота с двумя органическими заместителями R–SO2–R. Многие химические превращения с участием сераорганических соединений сопровождается изменением степени окисления серы.
Химические свойства сераорганических соединений, в основном, тех, что содержат S(II), напоминают свойства кислородсодержащих органических соединений.
Тиолы
– слабые кислоты и, подобно спиртам,
могут реагировать с активными металлами,
образуя тиоляты (рис. 1А). При действии
мягких окислителей, например, пероксида
водорода, они образуют дисульфиды
(аналоги пероксидов) (рис. 1Б). Более
сильные окислители (перманганаты)
переводят их в алкилсульфоновые кислоты,
в которых степень окисления серы VI (рис.
1В). В присутствии каталитических
количеств кислоты тиолы присоединяются
к олефинам по двойной связи (рис. 1Г). При
взаимодействии тиолов с альдегидами
или кетонами (катализатор – кислота)
образуются тиоацетали или тиокетали
(рис. 1Д) – аналоги соответствующих
кислородных соединений. Подобно спиртам,
тиолы реагируют с хлорангидридами
карбоновых кислот (в присутствии
оснований, связывающих образующийся HCl),
образуя тиоэфиры карбоновых кислот
(рис.1Ж) – близкие к органическим сложным
эфирам.
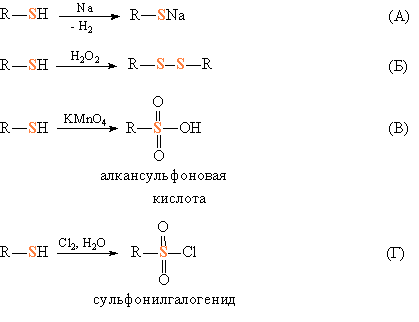
ПОЛУЧЕНИЕ ТИОЛОВ
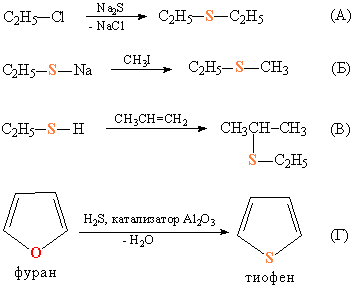
Тиоэфиры получают взаимодействием галогеналкилов с неорганическими сульфидами (рис. 6А). Когда нужно получить тиоэфиры с различающимися органическими группами, проводят взаимодействие галогеналкилов с тиолятами щелочных металлов (рис. 6Б), либо присоединением тиолов к олефинам (рис. 6В). О В некоторых простых эфирах, имеющих циклическое строение, можно заменить атом О атомом S, при этом образуется циклический тиоэфир, например, тиофен, который относят к гетероциклическим соединениям
Применение сераорганических соединений.
При автоокислении многих органических соединений возникают свободные радикалы (соединения, содержащие неспаренный электрон у атома углерода), которые далее ведут цепной процесс окисления. Тиолы и тиоэфиры используют как эффективные ловушки свободных радикалов, при этом они окисляются подобно тому, как показано на рис. 1Б и 2В. Это свойство позволяет использовать ихв качестве стабилизаторов, защищающих моторные топлива и масла от окисления. Для стабилизации каучуков используют трудно испаряющиеся соединения, например, додекантиол С12Н23SH.
Свойство тиолов «гасить» свободные радикалы нашло применение в создании радиопротекторов – веществ, защищающих от радиоактивного излучения. Для этих целей используют различные аминотиолы и их производные, например, H2N(CH2)nSH.
Радиопротекторы вводят в организм до облучения перед радиотерапевтическим лечением в медицине при долговременных космических полетах для защиты от солнечных вспышек. В результате заметно снижается доза полученной радиации.
На основе сераорганических соединений, содержащих дисульфидные группировки –S–S–, созданы полимеры – полисульфидные каучуки (промышленное название – тиоколы), которые получают поликонденсацией дигалогенпроизводных алифатических соединений Cl–R–Cl [R = (CH2)2, (CH2)3] и дисульфида натрия Na2S2, в результате образуются полисульфиды [–R–S–S–]n. Такие каучуки при добавлении окислителей (например, бихроматов) образуют сшитые резиноподобные материалы – вулканизаты, которые по прочности уступают обычным каучукам, но превосходят их по бензо- и маслостойкости, а также по атмосферостойкости, они не теряют механических свойств при действии влаги, смене температур и воздействии солнечной радиации. Это позволяет применять их при изготовлении бензо- и маслопроводов как внутренние покрытия резервуаров для хранения топлива, для герметизации швов между бетонными панелями при строительстве домов и к
