
- •Основные положения теории химического строения а.М. Бутлерова
- •2.Формулы строения
- •3. Понятие о изомерии
- •4. Структурные изомеры
- •5. Стереоизомеры
- •6. Электронные представления в органической химии
- •7. Свойства электрона
- •8. Атомные орбитали
- •9. Форма и энергия атомных орбиталей
- •2 Вопрос
- •Физические свойства алканов
- •Химические свойства алканов
- •Получение алканов
- •Изомеры и гомологи
- •Химические свойства
- •Способы получения циклоалканов
- •Алгоритм составления названий предельных углеводородов
- •27 Вопрос
- •1Я группа
- •2Я Группа
4. Структурные изомеры
Структурные изомеры - соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением.
Например, составу C5H12 соответствует 3 структурных изомера:

Другой пример:

5. Стереоизомеры
Пространственные изомеры (стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле.
Пространственными изомерами являются оптические и цис-транс изомеры (шарики разного цвета обозначают разные атомы или атомные группы):

Молекулы таких изомеров несовместимы в пространстве.
Стереоизомерия играет важную роль в органической химии. Подробнее эти вопросы будут рассматриваться при изучении соединений отдельных классов.
6. Электронные представления в органической химии
Применение электронной теории строения атома и химической связи в органической химии явилось одним из важнейших этапов развития теории строения органических соединений. Понятие о химическом строении как последовательности связей между атомами (А.М. Бутлеров) электронная теория дополнила представлениями об электронном и пространственном строении и их влиянии на свойства органических соединений. Именно эти представления дают возможность понять способы передачи взаимного влияния атомов в молекулах (электронные и пространственные эффекты) и поведение молекул в химических реакциях.
Согласно современным представлениям свойства органических соединений определяются:
· природой и электронным строением атомов;
· типом атомных орбиталей и характером их взаимодействия;
· типом химических связей;
· химическим, электронным и пространственным строением молекул.
7. Свойства электрона
Электрон имеет двойственную природу. В разных экспериментах он может проявлять свойства как частицы, так и волны. Движение электрона подчиняется законам квантовой механики. Связь между волновыми и корпускулярными свойствами электрона отражает соотношение де Бройля:
…………………………..
- длина волны электрона; m - его масса; v - скорость;где h = 6.62 • 10-34 Дж • с - постоянная Планка.
Энергию и координаты электрона, как и других элементарных частиц, невозможно одновременно измерить с одинаковой точностью (принцип неопределенностиГейзенберга). Поэтому движение электрона в атоме или в молекуле нельзя описать с помощью траектории. Электрон может находиться в любой точке пространства, но с разной вероятностью.
Часть пространства, в котором велика вероятность нахождения электрона, называют орбиталью или электронным облаком.
Например:
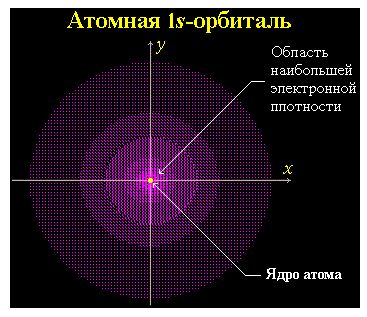
8. Атомные орбитали
Атомная орбиталь (АО) - область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома.
Положение элемента в Периодической системе определяет тип орбиталей его атомов (s-, p-, d-, f-АО и т.д.), различающихся энергией, формой, размерами и пространственной направленностью.

Для элементов 1-го периода (Н, He) характерна одна АО - 1s.
В элементах 2-го периода электроны занимают пять АО на двух энергетических уровнях: первый уровень 1s; второй уровень - 2s, 2px, 2py, 2pz. (цифры обозначают номер энергетического уровня, буквы - форму орбитали).
Состояние электрона в атоме полностью описывают квантовые числа.
