
- •Каноническое уравнение состояния
- •Метод термодинамических потенциалов. Соотношения Максвелла
- •Потенциалы и термодинамическое равновесие
- •Идеальные газы
- •Свободная энергия Гельмгольца и устойчивость термодинамического равновесия
- •Свободная энергия Гельмгольца и максимальная работа
- •Свободные энергии Гельмгольца и Гиббса
- •Определение
- •Связь с термодинамической устойчивостью системы
- •Энергия Гиббса и направление протекания реакции
- •Объединенный газовый закон
- •Связь с другими законами состояния идеального газа
- •Теплоемкость. Газовые смеси
- •Газовые смеси
- •Изменение энтропии
- •Энтропия при изохорном процессе
- •Работа газа
- •Внутренняя энергия идеального газа
- •Уравнение Пуассона для идеального газа Адиабата Пуассона
- •Вывод уравнения
- •Показатель адиабаты
- •Энтропия и обратимость
- •Цикл Карно
- •Кпд тепловой машины Карно
- •Связь между обратимостью цикла и кпд
- •Частные случаи
- •Следствия Недостижимость абсолютного нуля температур
- •Поведение термодинамических коэффициентов
- •Нарушения третьего начала термодинамики в моделях
- •Уравнение состояния
- •Вывод уравнения
- •Традиционный вывод
- •Кпд цикла
- •Применение
- •Обратный цикл Ренкина
- •Изменение энергии
- •Изменение температуры
- •Применение
- •Частный случай: два тепловых резервуара
- •Общий случай: много тепловых резервуаров
- •Следствия
Свободная энергия Гельмгольца и устойчивость термодинамического равновесия
Можно показать, что в системе с фиксированными температурой и объемом положение устойчивого равновесия соответствует точке минимума свободной энергии Гельмгольца. Другими словами, в этой точке (для такой системы) никакие изменения макроскопических параметров невозможны.
Свободная энергия Гельмгольца и максимальная работа
Свободная энергия Гельмгольца получила своё название из-за того, что она является мерой работы, которую может совершить термодинамическая система над внешними телами.
Пусть система переходит из состояния
![]() в состояние
в состояние
![]() .
Поскольку работа
не является функцией
состояния системы, работа,
совершенная системой в данном процессе
будет зависеть от пути, по которому этот
переход будет осуществляться.
.
Поскольку работа
не является функцией
состояния системы, работа,
совершенная системой в данном процессе
будет зависеть от пути, по которому этот
переход будет осуществляться.
Зададимся целью определить максимальную работу, которую система может совершить в этом случае.
Можно показать, что эта максимальная работа равна убыли свободной энергии Гельмгольца :
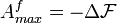 .
Здесь индекс f означает, что
рассматриваемая величина является
полной работой системы в данном процессе.
.
Здесь индекс f означает, что
рассматриваемая величина является
полной работой системы в данном процессе.
Свободные энергии Гельмгольца и Гиббса
В приложениях «свободной энергией» иногда называют не свободную энергию Гельмгольца, а энергию Гиббса. Это связано с тем, что энергия Гиббса также является мерой максимальной работы, но в данном случае рассматривается только работа над внешними телами, исключая среду:
, где — энергия Гиббса.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
![]()
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Определение
Классическим определением энергии Гиббса является выражение
где — внутренняя энергия, — давление, — объём, — абсолютная температура, — энтропия.
Дифференциал энергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных — через давление p и температуру T:
![]()
Для системы с переменным числом частиц этот дифференциал записывается так:
![]()
Здесь — химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
Связь с термодинамической устойчивостью системы
Покажем, что минимум потенциала Гиббса соответствует устойчивому равновесию термодинамической системы с фиксированными температурой, давлением и числом частиц.
Запишем обобщённое уравнение первого и второго начал термодинамики:
![]()
При
![]() .
.
![]()
![]()
Таким образом в системе при постоянных температуре и давлении энергия Гиббса достигает минимального значения.
