
- •1. Роль химии в народном хозяйстве.
- •2. Основные законы химии
- •3. Строение атома, квантовые числа и их физический смысл.
- •4. Строение электронных оболочек атомов. Принцип Паули, правила Гунда, принцип наименьшей энергии.
- •5. Энергия ионизации атомов, сродство к электрону. Электроотрицательность.
- •6. Правила Клечковского, порядок заполнения атомных орбиталей.
- •7. Периодич. Закон Менделеева, как один из основных законов природы. Группы, периоды, подгруппы. Порядковый номер Эл-та.
- •8. Периодическая сист-ма Менд., св-ва атомов в звыисим от полож в системе.
- •9. Типы химических связей. Ковалентная, ионная, металлическая, химические связи между молекулами.
- •11. Гибридизация атомных орбиталей (ао). Возбужденное состояние атома.
- •12. Метод валентных связей. Механизмы образования ковалентной химической связи
- •13. Гибридизация атомных орбиталей. Пространственная конфигурация молекул
- •14. Химическая связь в комплексных соединениях (донорно-акцепторное взаимодействие).
- •16. Изменение энтальпии, энтропии, энергии Гиббса при химических процессах.
- •17. Обратимые и необратимые хим. Реакции. Химическое равновесие.
- •18. Константа химического равновесия. Принцип Ле-Шателье.
- •19. Понятие об активных молекулах, энергия активации.
- •20. Кинетика химических реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ, температуры и наличия катализатора.
- •21.Общая хар-ка и классификация растворов. Способы выра-жения состава раствора.
- •22. Растворы неэлектролитов. Законы Рауля.
- •23. Осоматическое давление. Закон Вынт-Гоффа.
- •24. Криоскопия и эбуллиоскопия.
- •25. Растворы электролитов. Отклонения от законов Рауля и Вант-Гоффа для растворов электролитов.
- •26. Электролитическая диссоциация, ее причины, ход диссоциации от характера химических связей в молекуле.
- •27. Степень электролитической диссоциации. Сильные и слабые электролиты. Ступенчатая диссоциация и константа диссоциации.
- •28. Электролитическая диссоциация воды. Ионное произведение воды, водородный показатель рН.
- •29. Ионные реакции обмена.
- •30. Гидролиз солей. Константа и степень гидролиза.
- •31. Степень окисления и валентность элементов. Окислительные числа. Процессы окисления и восст-ния, окислитель и восстановитель.
- •32. Типы окислительно-восстановительных реакций (овр).
- •33. Граница раздела электрод-электролит. Двойной электрический слой и его строение.
- •34. Электродный потенциал, его понятие. Стандартный электродный потенциал.
- •35. Стандартный водородный электрод сравнения. Ряд стандартных потенциалов металлов
- •36. Электролиз. Последовательность разряда ионов на электродах. Электролиз с растворимым и нерастворимым анодом.
- •37. Законы Фрадея. Выход по току.Электрическое получение и рафинирование металлов.
- •38.Катодное выделение цинка, никеля из водных растворов. Перенапряжение водорода.
- •2 Закон Фарадея.
- •39. Первичные и вторичные источники электрической энергии. Хар-ки хим. Источников Эл. Энергии (хиээ.)
- •40. Гальванические элементыю Концентрационные элементы.
- •41. Аккумуляторы (а). Свинцовый аккумулятор
- •43. Коррозия металлов. Виды коррозии. Вопросы экономики, связанные с коррозией металлов.
- •44. Химическая и электрохимическая коррозия.
- •45. Методы защиты от коррозии: воздействие на среду, на металл и на изделие.
- •47. Электрохимическая размерная обработка.
- •48. Классификация органических соединений. Предельные углеводороды.
- •49. Непредельные углеводороды. Номенклатура и химические свойства.
- •50. Полимеры. Реакции полимеризации и поликонденсации.
9. Типы химических связей. Ковалентная, ионная, металлическая, химические связи между молекулами.
Образование из атомов молекул, молекулярных ионов, ионов, кристаллических, аморфных и других веществ сопровождается 1) уменьшением энергии по сравнению с невзаимодействующими атомами. 2)При этом минимальной энергии соответствует определенное расположение атомов друг относительно друга, которому отвечает существенное перераспределение электронной плотности.
Силы, удерживающие атомы в новых образованиях, получили обобщенное название «химическая связь». Важнейшие виды химической связи: ионная, ковалентная, металлическая
Согласно электронной теории валентности, химическая связь возникает за счет перераспределения электронов валентных орбиталей.
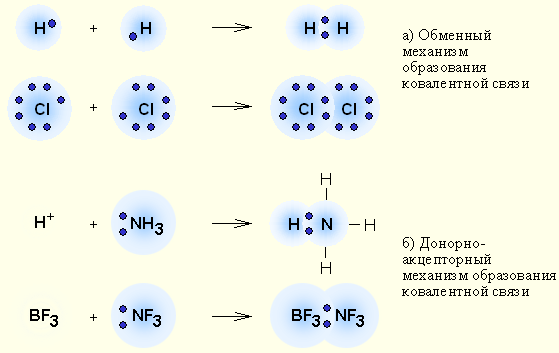
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору)
Ионная связь образуется при передаче электронов более электроотрицательному атому, т.е. за счёт электростатического притяжения разноимённо заряженных ионов. Ионы могут быть как простыми, так и сложными. Все ионные соединения имеют в твёрдом состоянии ионную кристаллическую решётку, в которой каждый ион окружён несколькими ионами противоположного знака.При этом все связи данного иона с соседними ионами равноценны, так что весь кристалл можно рассматривать как единую "молекулу". В ионных соединениях не происходит полного разделения зарядов на + и -, т.е. полного перехода электрона от одного атома к другому. Это можно объяснить взаимной поляризацией ионов, т.е. влиянием их друг на друга, которое приводит к деформации электронных оболочек. Поляризация ионов оказывает заметное влияние на свойства образуемых ими соединений (н-р: на диссоциацию солей в водных растворах
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
10. Св-ва ковалентной связи: энергия, насыщаемость, направленность. Пи-связь и сигма-связь.
В природе наиболее распространена ковалентная связь. Ей образованы молекулы всех органических ве-ществ.Если ковалентная связь образована перекрыванием электронных облаков вблизи прямой, соеди-няющей ядра взаимодействующих атомов, то она называется сигма-связью. В её образовании могут при-нимать участие как s-,так и p-электронные облака, ориентированные вдоль оси связи. При взаимодействии p-электронных облаков, ориентированных перпендикулярно оси связи, образуется не одна, а две области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется пи-связью.
Рассмотрим характеристики ковалентной связи.
1. Прочность. От прочности зависит реакционная способность вещества (сигма-связь-прочная, а пи-связь-непрочная). Прочность связи можно охарактеризовать количественно. Мероя является энергия связи.
2. Энергия связи - это количество энергии, затрачиваемой на разрыв связи (чем больше энергия, тем прочнее связь). Энергию выражают в килоджоулях или в джоулях. Если разность суммарной энергии связи исходных элементов и продуктов реакции положительна, то реакция экзотермическая, если отрицательна, то эндотермическая.
3. Насыщенность - это валентные возможности атомов, т.е. определённое число ковалентных связей. Ионная связь и металлическая связь не обладают насыщенностью, т.к. ионы притягиваются ко всем окру-жающим их противоположно заряженным ионам.
4. Направленность. Когда атом соединяется с другим атомом. происходит перестройка его валентных ор-биталей в новые гибридные орбитали удлинённой формы, которые более полнее перекрываются, образуя связь. За счёт этого достигается выигрыш в энергии. Образующаяся связь является более прочнее.
5. Длина связи – расстояние между ядрами атомов, образующих связь.
