
- •1. Роль химии в народном хозяйстве.
- •2. Основные законы химии
- •3. Строение атома, квантовые числа и их физический смысл.
- •4. Строение электронных оболочек атомов. Принцип Паули, правила Гунда, принцип наименьшей энергии.
- •5. Энергия ионизации атомов, сродство к электрону. Электроотрицательность.
- •6. Правила Клечковского, порядок заполнения атомных орбиталей.
- •7. Периодич. Закон Менделеева, как один из основных законов природы. Группы, периоды, подгруппы. Порядковый номер Эл-та.
- •8. Периодическая сист-ма Менд., св-ва атомов в звыисим от полож в системе.
- •9. Типы химических связей. Ковалентная, ионная, металлическая, химические связи между молекулами.
- •11. Гибридизация атомных орбиталей (ао). Возбужденное состояние атома.
- •12. Метод валентных связей. Механизмы образования ковалентной химической связи
- •13. Гибридизация атомных орбиталей. Пространственная конфигурация молекул
- •14. Химическая связь в комплексных соединениях (донорно-акцепторное взаимодействие).
- •16. Изменение энтальпии, энтропии, энергии Гиббса при химических процессах.
- •17. Обратимые и необратимые хим. Реакции. Химическое равновесие.
- •18. Константа химического равновесия. Принцип Ле-Шателье.
- •19. Понятие об активных молекулах, энергия активации.
- •20. Кинетика химических реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ, температуры и наличия катализатора.
- •21.Общая хар-ка и классификация растворов. Способы выра-жения состава раствора.
- •22. Растворы неэлектролитов. Законы Рауля.
- •23. Осоматическое давление. Закон Вынт-Гоффа.
- •24. Криоскопия и эбуллиоскопия.
- •25. Растворы электролитов. Отклонения от законов Рауля и Вант-Гоффа для растворов электролитов.
- •26. Электролитическая диссоциация, ее причины, ход диссоциации от характера химических связей в молекуле.
- •27. Степень электролитической диссоциации. Сильные и слабые электролиты. Ступенчатая диссоциация и константа диссоциации.
- •28. Электролитическая диссоциация воды. Ионное произведение воды, водородный показатель рН.
- •29. Ионные реакции обмена.
- •30. Гидролиз солей. Константа и степень гидролиза.
- •31. Степень окисления и валентность элементов. Окислительные числа. Процессы окисления и восст-ния, окислитель и восстановитель.
- •32. Типы окислительно-восстановительных реакций (овр).
- •33. Граница раздела электрод-электролит. Двойной электрический слой и его строение.
- •34. Электродный потенциал, его понятие. Стандартный электродный потенциал.
- •35. Стандартный водородный электрод сравнения. Ряд стандартных потенциалов металлов
- •36. Электролиз. Последовательность разряда ионов на электродах. Электролиз с растворимым и нерастворимым анодом.
- •37. Законы Фрадея. Выход по току.Электрическое получение и рафинирование металлов.
- •38.Катодное выделение цинка, никеля из водных растворов. Перенапряжение водорода.
- •2 Закон Фарадея.
- •39. Первичные и вторичные источники электрической энергии. Хар-ки хим. Источников Эл. Энергии (хиээ.)
- •40. Гальванические элементыю Концентрационные элементы.
- •41. Аккумуляторы (а). Свинцовый аккумулятор
- •43. Коррозия металлов. Виды коррозии. Вопросы экономики, связанные с коррозией металлов.
- •44. Химическая и электрохимическая коррозия.
- •45. Методы защиты от коррозии: воздействие на среду, на металл и на изделие.
- •47. Электрохимическая размерная обработка.
- •48. Классификация органических соединений. Предельные углеводороды.
- •49. Непредельные углеводороды. Номенклатура и химические свойства.
- •50. Полимеры. Реакции полимеризации и поликонденсации.
45. Методы защиты от коррозии: воздействие на среду, на металл и на изделие.
1) Воздействие на металл- Легирование, термообработка, ингибиторы, смазки, покрытия органическими и неорганическими веществами, металлические покрытия.
Легирование металлов Введение в состав сплава компонентов, вызывающих пассивацию металла. - жаростойкость – стойкость по отношению к газовой коррозии при высоких температурах; обеспечивается легированием стали, напр., Cr, Al, Si, которые окисляются энергичнее, чем железо, и образуют плотные защитные пленки . - жаропрочность – свойство конструкционного материала сохранять высокую механическую прочность при значительном повышении температуры. Для металлов термообработка-воронение. Катодные покрытия. Покрытия, потенциалы которых в данной среде имеют более высокое значение, чем потенциал основного металла. Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. 2) Воздействие на среду - ингибиторы, обескислороживание, создание инертной атмосферы, осушение атмосферы. 3) Воздействие на конструкцию – наличие проветриваемых полостей, наличие дренажа, рациональное крепление деталей. 46. Металлические покрытия, ингибиторная защита, электрическая защита, ингибиторы. Катодные покрытия. Покрытия, потенциалы которых в данной среде имеют более высокое значение, чем потенциал основного металла. Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла. Ингибиторная защита
Методы электрической защиты
1)Катодная защита.
Деталь подключают к – внешнего источника тока и смещают стационарный потенциал коррозии до потенциала анода.
2)Анодная защита.
Используется для металлов склонных к пассивации.(Ni, Cr, Fe, Al)
Деталь подключают к + внешнего источника тока и смещают потенциал коррозии в зону пассивации.
3)Протекторная защита(протектор-жертвенный анод).
Изделие электрически соединяют с металлом потенциал которого более электроотрицателен.
Ингибиторы – вещества, при добавлении которых в среду, где находится Ме, значительно уменьшается скорость коррозии. Их применяют в системах, работающих с постоянным объемом раствора (напр., химические аппараты, системы охлаждения, парогенераторы и др.) Ингибиторы Жидкофазные ♦ для нейтральной среды ♦ для щелочной среды ♦ для кислой среды Газофазные применяются при транспортировке, хранении, при эксплуатации на воздухе
47. Электрохимическая размерная обработка.
Электрохимическая размерная обработка выполняется в струе электролита, прокачиваемого под давлением через межэлектродный промежуток.
Электролит растворяет образующиеся на поверхности заготовки – анода соли и удаляет их из зоны обработки. Высокая производительность процесса заключается в том, что одновременно обрабатывается вся поверхность заготовки.
Участки, не требующие обработки, изолируют. Инструменту придают форму, обратную форме обрабатываемой поверхности. Формообразование происходит по методу копирования ( рис. 21.6).
Р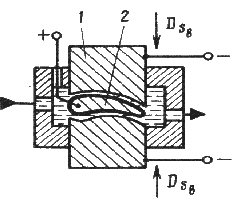 ис.
21.6. Схема электрохимической размерной
обработки:
ис.
21.6. Схема электрохимической размерной
обработки:
1 – инструмент – катод; 2 – заготовка – анод
Точность обработки повышается при уменьшении рабочего зазора. Для его контроля используют высокочувствительные элементы, которые встраивают в следящую систему.
Этот способ рекомендуют для обработки заготовок из высокопрочных сталей, карбидных и труднообрабатываемых материалов. Также можно обрабатывать тонкостенные детали с высокой точностью и качеством обработанной поверхности (отсутствует давление инструмента на заготовку).
