
- •1. Роль химии в народном хозяйстве.
- •2. Основные законы химии
- •3. Строение атома, квантовые числа и их физический смысл.
- •4. Строение электронных оболочек атомов. Принцип Паули, правила Гунда, принцип наименьшей энергии.
- •5. Энергия ионизации атомов, сродство к электрону. Электроотрицательность.
- •6. Правила Клечковского, порядок заполнения атомных орбиталей.
- •7. Периодич. Закон Менделеева, как один из основных законов природы. Группы, периоды, подгруппы. Порядковый номер Эл-та.
- •8. Периодическая сист-ма Менд., св-ва атомов в звыисим от полож в системе.
- •9. Типы химических связей. Ковалентная, ионная, металлическая, химические связи между молекулами.
- •11. Гибридизация атомных орбиталей (ао). Возбужденное состояние атома.
- •12. Метод валентных связей. Механизмы образования ковалентной химической связи
- •13. Гибридизация атомных орбиталей. Пространственная конфигурация молекул
- •14. Химическая связь в комплексных соединениях (донорно-акцепторное взаимодействие).
- •16. Изменение энтальпии, энтропии, энергии Гиббса при химических процессах.
- •17. Обратимые и необратимые хим. Реакции. Химическое равновесие.
- •18. Константа химического равновесия. Принцип Ле-Шателье.
- •19. Понятие об активных молекулах, энергия активации.
- •20. Кинетика химических реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ, температуры и наличия катализатора.
- •21.Общая хар-ка и классификация растворов. Способы выра-жения состава раствора.
- •22. Растворы неэлектролитов. Законы Рауля.
- •23. Осоматическое давление. Закон Вынт-Гоффа.
- •24. Криоскопия и эбуллиоскопия.
- •25. Растворы электролитов. Отклонения от законов Рауля и Вант-Гоффа для растворов электролитов.
- •26. Электролитическая диссоциация, ее причины, ход диссоциации от характера химических связей в молекуле.
- •27. Степень электролитической диссоциации. Сильные и слабые электролиты. Ступенчатая диссоциация и константа диссоциации.
- •28. Электролитическая диссоциация воды. Ионное произведение воды, водородный показатель рН.
- •29. Ионные реакции обмена.
- •30. Гидролиз солей. Константа и степень гидролиза.
- •31. Степень окисления и валентность элементов. Окислительные числа. Процессы окисления и восст-ния, окислитель и восстановитель.
- •32. Типы окислительно-восстановительных реакций (овр).
- •33. Граница раздела электрод-электролит. Двойной электрический слой и его строение.
- •34. Электродный потенциал, его понятие. Стандартный электродный потенциал.
- •35. Стандартный водородный электрод сравнения. Ряд стандартных потенциалов металлов
- •36. Электролиз. Последовательность разряда ионов на электродах. Электролиз с растворимым и нерастворимым анодом.
- •37. Законы Фрадея. Выход по току.Электрическое получение и рафинирование металлов.
- •38.Катодное выделение цинка, никеля из водных растворов. Перенапряжение водорода.
- •2 Закон Фарадея.
- •39. Первичные и вторичные источники электрической энергии. Хар-ки хим. Источников Эл. Энергии (хиээ.)
- •40. Гальванические элементыю Концентрационные элементы.
- •41. Аккумуляторы (а). Свинцовый аккумулятор
- •43. Коррозия металлов. Виды коррозии. Вопросы экономики, связанные с коррозией металлов.
- •44. Химическая и электрохимическая коррозия.
- •45. Методы защиты от коррозии: воздействие на среду, на металл и на изделие.
- •47. Электрохимическая размерная обработка.
- •48. Классификация органических соединений. Предельные углеводороды.
- •49. Непредельные углеводороды. Номенклатура и химические свойства.
- •50. Полимеры. Реакции полимеризации и поликонденсации.
40. Гальванические элементыю Концентрационные элементы.
Гальванический
элемент – любое устройство, позволяющее
получать электрический ток, за счет
протекания химических реций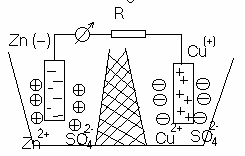
Гальванический элемент Даниэля-Якоби. Система состоит из двух электродов нах. в растворах собственных ионов. При работе элемента протекает следующие процессы: 1)реакция окисления цинка
Zn - 2e –> Zn2+
Процессы окисления в электрохимии получи название анодных процессов, а электроды, на которых идут процессы окисления назв. анодами; 2)реакция восстановления ионов меди
Cu2+ + 2e–>Cu
Процессы восстановления в электрохимии получи название катодных процессов, а электроды, на которых идут процессы восстановления, назв. катодами; 3)движение электронов во внешней цепи; 4) движение ионов в растворе: анионов к аноду, катионов к катоду. Ионы с большей концентрацией будут переходить в банку с меньшей, т.к. перегородка пористая и имеет место диффузия. Суммируя электродные реакции, получаем Zn+Cu2+=Cu+Zn2+
Вследствие этой реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т.е. электрический ток. В гальваническом элементе происходит превращение химической энергии в электрическую. При помощи гальванического элемента можно совершить электрическую работу за счет энергии химической реакции.
Максимальная разность потенциалов электродов, которая может быть поучена при работе гальванического элемента, называется электродвижущей силой (ЭДС) элемента. Она равна разности равновесных потенциалов катода и анода элемента.
Максимальная электрическая работа W=nFEэ, где Еэ-ЭДС гальв. элемента.
Максимально полезная работа W= – G.
Стандартной назв. ЭДС элемента, если парциальные относительные давления исходных веществ и продуктов реакции равны единице или активности исходных веществ и продуктов реакций равны единице. Стандартная ЭДС элемента Даниэля-Якоби при 298К Еэ0=1,1В.
Концентрационные элементы (К.Э), концентрационные цепи, один из видов гальванических элементов. Различают К. э. двух типов: с переносом ионов и без переноса ионов. К. э. с переносом ионов получают погружением двух одинаковых электродов (например, серебряных) в разделённые полупроницаемой перегородкой растворы одного и того же электролита (например, нитрата серебра) различной концентрации. Электродвижущая сила в таких К. э. возникает в результате непосредственного переноса электролита из более концентрированного раствора в менее концентрированный. В К. э. второго типа выравнивание концентраций электролита происходит в результате химических процессов, происходящих на двух различных электродах.
41. Аккумуляторы (а). Свинцовый аккумулятор
А служат для накопления энергии, чтобы в нужный момент расходовать её. Накопление энергии осуществляется при пропускании постоянного электрического тока через А. При этом происходит преврщение электрической энергии в химическую (электролиз). Под влиянием эл.тока идёт окислит-восстановит реакция (ОВР) и А заряжается. При разрядке идёт та же реакция, но в обратонм направлении: химическая энергия превращается в эектрическую.
Существует два вида А: кислотный( синцовый) и щелочной(никель-кадмиевый и никель-железный)
Анод заряженного свинцового аккумулятора состоит из свинца, катод – из диоксида свинца. Металлический тип проводимости PbO2 делает его пригодным для работы в качестве электрода. Электролитом служит раствор H2SO4 (32–39 %), в котором PbSO4 и PbO2 малорастворимы.
Схему аккумулятора можно изобразить так:
![]()
Анодный процесс работающего аккумулятора
![]()
катодный процесс –
![]()
Таким образом, в свинцовом аккумуляторе осуществляется реакция
При зарядке протекает обратная реакция и электроды меняют свои функции: катод становится анодом, а анод – катодом. ЭДС свинцового аккумулятора зависит от отношения активности кислоты и воды:
![]()
В процессе работы аккумулятора концентрация кислоты падает, а следовательно, падает и ЭДС. Когда ЭДС достигает 1,85 В, аккумулятор считается разрядившимся. При более низкой ЭДС пластины покрываются тонким слоем PbSO4 и и аккумулятор разряжается необратимо. Во избежание этого аккумулятор периодически подзаряжают.
Показателем того, что зарядка закончена является кипение А. Он даёт напряжение 2В. Позволительный разряд 1,7В. При более сильной разрядке происходит сульфатация и А выходит из строя. Свинцовые А нельзя долго хранить в заряженном виде, т.к. на пластинах происходит саморазряд. Свинцовый А даёт более высокое напряжение, чем щелочной, у него высокий КПД, большая ёмкость, но большие габориты. Таке недостатком является то, что электролит и серная кислота должны быть очень чистыми (без примесей). Свинцовые А применяются для питания радио- и телефонной аппаратуры, для питания оборудования на автотранспорте.
42. Никель-кадмиевый и никель железный аккумуляторы. Герметичный никель кадмиевый аккумулятор.
Щелочные А бывают железно-никелевые, кадмиев-никелевые, серебренно-цинковые. При разрядке первого образуется гидроксид железа (II) и гидроксид никеля (II). Зарядка идёт в обратном направлении и образуется железо и гидроксид никеля (III). Даёт напряжение 1.45-1.48В, Позволительный разряд 1В. Саморазряд возможен, но в меньшей степени, чем у свинцового. Он меньше по габоритам и лучше выдерживает толчки вибрации, но у него меньше КПД и ёмкость. Применяется для освещения вагонов на ж/д транспорте, для питания ламп шахтёров.
Рассмотрим процесс работы . В заряженном щелочном железо-никелевом аккумуляторе анодом служит железо, катодом – гидроксид никеля (III), электролит – 20%-й раствор KOH:
![]()
При работе аккумулятора на аноде происходит окисление железа:
![]()
на катоде –
восстановление гидроксида никеля (III):
![]()
Суммарная активность процесса:
ЭДС щелочного аккумулятора не зависит от концентрации щелочи.
Аналогично работают
щелочные кадмий-никелевый
![]()
и серебряно-цинковый аккумуляторы:
![]()
В потребительской электронике, большинство аккумуляторов - никель-кадмиевые. Это самый популярный тип подзаряжаемых батареек. Обычно их обозначают NiCad. Катоды в таких элементах сделаны из никеля, а аноды - кадмиевые
Особую группу никель-кадмиевых аккумуляторов составляют герметичныеаккумуляторы
Как и в свинцовых аккумуляторах, в никель-кадмиевых батарейках возможен электролиз - распад воды в электролите на потенциально взрывоопасные водород и кислород.
Производители батареек предпринимают различные меры для предотвращения этого эффекта. Обычно элементы для предотвращения утечки герметично упаковывают. Кроме того, батарейки устроены так, чтобы сначала вырабатывался не водород, а кислород, который предотвращает реакцию электролиза.
Для того чтобы герметичные аккумуляторы не взрывались, и чтобы в них не скапливался газ, обычно в батарейках предусматривают клапаны. Если закрыть эти вентиляционные отверстия, то возникнет опасность взрыва. Обычно эти отверстия настолько малы, что остаются незамеченными. Работают они автоматически. Это предостережение (не закрывать вентиляционные отверстия) относятся в основном к производителям устройств. Стандартные отсеки для батареек предполагают возможность вентиляции, но вот если залить батарейку в эпоксидной смоле, то вентиляции не будет.
