
- •1. Роль химии в народном хозяйстве.
- •2. Основные законы химии
- •3. Строение атома, квантовые числа и их физический смысл.
- •4. Строение электронных оболочек атомов. Принцип Паули, правила Гунда, принцип наименьшей энергии.
- •5. Энергия ионизации атомов, сродство к электрону. Электроотрицательность.
- •6. Правила Клечковского, порядок заполнения атомных орбиталей.
- •7. Периодич. Закон Менделеева, как один из основных законов природы. Группы, периоды, подгруппы. Порядковый номер Эл-та.
- •8. Периодическая сист-ма Менд., св-ва атомов в звыисим от полож в системе.
- •9. Типы химических связей. Ковалентная, ионная, металлическая, химические связи между молекулами.
- •11. Гибридизация атомных орбиталей (ао). Возбужденное состояние атома.
- •12. Метод валентных связей. Механизмы образования ковалентной химической связи
- •13. Гибридизация атомных орбиталей. Пространственная конфигурация молекул
- •14. Химическая связь в комплексных соединениях (донорно-акцепторное взаимодействие).
- •16. Изменение энтальпии, энтропии, энергии Гиббса при химических процессах.
- •17. Обратимые и необратимые хим. Реакции. Химическое равновесие.
- •18. Константа химического равновесия. Принцип Ле-Шателье.
- •19. Понятие об активных молекулах, энергия активации.
- •20. Кинетика химических реакций. Зависимость скорости химической реакции от концентрации реагирующих веществ, температуры и наличия катализатора.
- •21.Общая хар-ка и классификация растворов. Способы выра-жения состава раствора.
- •22. Растворы неэлектролитов. Законы Рауля.
- •23. Осоматическое давление. Закон Вынт-Гоффа.
- •24. Криоскопия и эбуллиоскопия.
- •25. Растворы электролитов. Отклонения от законов Рауля и Вант-Гоффа для растворов электролитов.
- •26. Электролитическая диссоциация, ее причины, ход диссоциации от характера химических связей в молекуле.
- •27. Степень электролитической диссоциации. Сильные и слабые электролиты. Ступенчатая диссоциация и константа диссоциации.
- •28. Электролитическая диссоциация воды. Ионное произведение воды, водородный показатель рН.
- •29. Ионные реакции обмена.
- •30. Гидролиз солей. Константа и степень гидролиза.
- •31. Степень окисления и валентность элементов. Окислительные числа. Процессы окисления и восст-ния, окислитель и восстановитель.
- •32. Типы окислительно-восстановительных реакций (овр).
- •33. Граница раздела электрод-электролит. Двойной электрический слой и его строение.
- •34. Электродный потенциал, его понятие. Стандартный электродный потенциал.
- •35. Стандартный водородный электрод сравнения. Ряд стандартных потенциалов металлов
- •36. Электролиз. Последовательность разряда ионов на электродах. Электролиз с растворимым и нерастворимым анодом.
- •37. Законы Фрадея. Выход по току.Электрическое получение и рафинирование металлов.
- •38.Катодное выделение цинка, никеля из водных растворов. Перенапряжение водорода.
- •2 Закон Фарадея.
- •39. Первичные и вторичные источники электрической энергии. Хар-ки хим. Источников Эл. Энергии (хиээ.)
- •40. Гальванические элементыю Концентрационные элементы.
- •41. Аккумуляторы (а). Свинцовый аккумулятор
- •43. Коррозия металлов. Виды коррозии. Вопросы экономики, связанные с коррозией металлов.
- •44. Химическая и электрохимическая коррозия.
- •45. Методы защиты от коррозии: воздействие на среду, на металл и на изделие.
- •47. Электрохимическая размерная обработка.
- •48. Классификация органических соединений. Предельные углеводороды.
- •49. Непредельные углеводороды. Номенклатура и химические свойства.
- •50. Полимеры. Реакции полимеризации и поликонденсации.
32. Типы окислительно-восстановительных реакций (овр).
1) Межмолекулярные ОВР
Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами:
S0 + O20 -> S+4O2-2
( S - восстановитель; O2 – окислитель)
Cu+2O + C+2O -> Cu0 + C+4O2
( CO - восстановитель; CuO – окислитель)
Zn0 + 2HCl -> Zn+2Cl2 + H20
( Zn - восстановитель; HСl – окислитель)
Сюда же относятся реакции между веществами, в которых атомы одного и того же элемента имеют разные степени окисления
2H2S-2 + H2S+4O3 -> 3S0 + 3H2O
2).Внутримолекулярные ОВР
Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель.
2KCl+5O3-2 -> 2KCl-1 + 3O20
Cl+5 - окислитель; О-2 – восстановитель
3)Диспропорционирование - окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления.
3HN+3O2 -> HN+5O3 + 2N+2O + H2O
(Азотистая кислота -> азотная + оксид азота + вода)
33. Граница раздела электрод-электролит. Двойной электрический слой и его строение.
Принципы, лежащие в основе действия гальванических элементов, тесно связаны с особенностями кристаллической структуры металлов. В узлах кристаллической решетки любого металла размещаются не нейтральные атомы, а положительно заряженные ионы. Эти ионы оказывают лишь незначительное влияние на свои валентные электроны. Связь между этими электронами и ионами настолько мала, что электроны могут свободно перемещаться внутри кристаллической решетки, образуя как бы “электронный газ”. Таким образом, в металле всегда имеется некоторое количество свободных электронов. Их наличие и обусловливает общие свойства металлов, а именно: для металлов характерно отдавать электроны и превращаться в положительно заряженные ионы. При погружении металлической пластинки в воду ионы поверхностного слоя металла взаимодействуют с полярными молекулами воды (гидратируются) и переходят в раствор, который заряжается при этом положительно. Переход ионов металла в воду создает в самом металле избыток свободных электронов, придающихего поверхностному слою отрицательный заряд. На границе раздела (между металлом и прилегающей к нему жидкостью) возникает двойной электрический слой (рис 1)характеризующийся определенным скачком потенциала (разностью потенциалов), который условно называют электродным потенциалом металла.
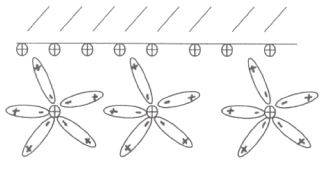
![]() рис2.
рис2.
По мере дальнейшего перехода ионов металла в раствор отрицательный заряд металла растет, Растет и скачек потенциала на границе раздела металл - электролит. При этом возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла (рис 2)
34. Электродный потенциал, его понятие. Стандартный электродный потенциал.
Устройства, которые применяют для непосредсьвенного преобразования энергии химической реакции в электрическую энергию, называются гальвоническими элементами.
Когда Окисл-вост реакция протекает в Гальван Эл-те или осуществляется путём электролиза, то каждая полуреакция (Окисл или Восст) протекает на соответствующем электроде: на аноде - окисление, на катоде - восстановление.; поэтому полуреакции называют также электродными процессами. В соответствии с разделением ОВР на две полуреакции, ЭДС также принято представлять в виде разности двух величин, каждая из кторых отвечает данной полуреакции. Эти величины называются электродными потенциалами.
В
результате изучения потенциалов
различных электродных процессов
установлено, что их величины зависят
от следующих факторов: 1) от природы
веществ - участников электродного
процесса, 2) от активностей веществ и 3)
от температуры. Эта зависимость выражается
уравнением:
![]() .
Для ЭДС ГЭ имеем аналогичную
зависимость:
.
Для ЭДС ГЭ имеем аналогичную
зависимость:![]() .Для
стандартной температуры имеем
соответственно:
.Для
стандартной температуры имеем
соответственно:
![]() .
Здесь
0-
стандартный электродный потенциал
данного процесса - константа; Е0-
стандартная ЭДС. Последняя зависимость
носит название формулы Нернста.
.
Здесь
0-
стандартный электродный потенциал
данного процесса - константа; Е0-
стандартная ЭДС. Последняя зависимость
носит название формулы Нернста.
Физический смысл стандартного потенциала становится ясным при рассмотрении случая, когда концентрации, а значит и активности всех веществ, участвующих в данном процессе, равны единице. При этом условии второе слагаемое правой части уравнения обращается в нуль и уравнение принимает вид:.Концентрации (активност), равные единице, называются стандарнтными. Поэтому и потенциал, отвечающий этому условию, называется стандартным потенциалом.
