
- •Билет 1 Проблема начала наук.
- •Билет 2 Научные знания на древнем востоке
- •Билет 3 Античная наука
- •Билет 4 Мировоззрение и ее черты
- •Билет 5 Особенности мировоззрения
- •Билет 13 Закон сохранения электрического заряда и закон Кулона
- •Закон Кулона
- •Магнитные.
- •Билет 15. Электромагнитное поле.Гипотеза Максвелла.
- •Билет 19 Классификация элементарных частиц
- •Билет 20.Квантово-полевая картина мира.
- •Билет 22 . Электромагнитные и гравитационные взаимодействия
- •Гравитация
- •Билет 24 Классическая модель вселенной
- •Билет 25.Космологические парадоксы
- •[Править]Фотометрический парадокс
- •[Править]Гравитационный парадокс
- •Билет 26. Модель расширяющейся Вселенной
- •Строение
- •Квантовые числа
- •Билет 31. Химическая кинетика
- •Билет 32.
- •Билет 33
- •Билет 34
- •[Править]
- •Строение клетки
Билет 32.
Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях илиэлектрону в окислительно-восстановительных реакциях[1][2].
Например, в реакции:
NaOH + HCl = NaCl + H2O
эквивалентом будет реальная частица — ион Na+, в реакции
Zn(OH)2 + 2HCl = ZnCl2 + 2H2O
эквивалентом будет являться мнимая частица ½Zn(OH)2.
Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число моль вещества, эквивалентное одному моль катионов водорода в рассматриваемой реакции.
Молярная
масса эквивалентов
обычно обозначается как ![]() или
или ![]() .
Отношение эквивалентной молярной массы
вещества к его собственно молярной
массе называется фактором
эквивалентности (обозначается
обычно как
.
Отношение эквивалентной молярной массы
вещества к его собственно молярной
массе называется фактором
эквивалентности (обозначается
обычно как ![]() ).
).
Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества.
Mэкв = fэкв×M
Билет 33
Предметом технической термодинамики является главным образом изучение процессов взаимного преобразования теплоты и работы в различных тепловых машинах. В тепловых двигателях преобразование теплоты в работу осуществляется с помощью так называемого рабочего тела. Например, в двигателях внутреннего сгорания, а также в газотурбинных установках рассматриваются процессы, в которых рабочим телом является газ. В паровых двигателях рассматриваются процессы, в которых рабочим телом является пар, легко переходящий из парообразного состояния в жидкое и, наоборот, из жидкого в парообразное. Физическое состояние тела вполне определяется некоторыми величинами, характеризующими данное состояние, которые в термодинамике называют параметрами состояния. Параметрами состояния может быть целый ряд величин: удельный объем, давление, температура, внутренняя энергия, энтальпия, энтропия, концентрация, изохорно-изотермный потенциал и др. Однако при отсутствии силовых полей (гравитационного, электромагнитного и др.) состояние однородного тела может быть однозначно определено тремя параметрами, в качестве которых в технической термодин-мике принимают удельный объем, абсолютную температуру и давление. Эти три параметра, называемые обычно основными, не являются независимыми величинами и, как будет показано далее, связаны между собой вполне определенными математическими зависимостями.
Билет 34
* 1-й закон — первое начало термодинамики: Представляет собой формулировку обобщённого закона сохранения энергии для термодинамических процессов. В наиболее простой форме его можно записать как
![]() ,
,
где ![]() есть
полный дифференциал внутренней энергии
системы, а
есть
полный дифференциал внутренней энергии
системы, а ![]() и
и ![]() есть
элементарное количество теплоты,
переданное системе, и элементарная
работа, совершенная системой соответственно.
Нужно учитывать, что
и
нельзя
считать дифференциалами в обычном
смысле этого понятия, поскольку эти
величины существенно зависят от типа
процесса, в результате которого состояние
системы изменилось.
есть
элементарное количество теплоты,
переданное системе, и элементарная
работа, совершенная системой соответственно.
Нужно учитывать, что
и
нельзя
считать дифференциалами в обычном
смысле этого понятия, поскольку эти
величины существенно зависят от типа
процесса, в результате которого состояние
системы изменилось.
В
литературе можно встретить и другие
варианты приведённого выше соотношения,
отличающиеся от него знаками (![]() или
или ![]() )
перед
и
.
Отличия вызваны тем, что конкретный вид
этого уравнения зависит от соглашений,
называемых «правилами знаков для работы
и теплоты». Выше использовано
«теплотехническое правило знаков для
работы» (положительной считают работу,
совершаемую системой, когда она отдаёт
энергию, а отрицательной — работу,
совершаемую над системой, когда она
получает энергию) и «термодинамическое
правило знаков для теплоты» (положительной
считают теплоту, получаемую системой,
а отрицательной — теплоту, отдаваемую
системой). В «термодинамическом правиле
знаков для работы» положительной считают
работу, совершаемую над системой, а
отрицательной — работу, совершаемую
системой. Наконец, в «термохимическом
правиле знаков для теплоты» положительной
считают теплоту, отдаваемую системой,
а отрицательной — теплоту, получаемую
системой. Мнемоническое правило: в
термодинамической системе знаков
имеет
тот же знак, что и энергия, передаваемая
системе в виде работы или теплоты; в
остальных случаях знак
противоположен
знаку передаваемой энергии. Стандарта,
предписывающего использовать конкретный
набор правил знаков, не существует, так
что уместно рассматривать только степень
распространённости того или иного
правила в научной и учебной литературе.
По этому поводу однозначно можно говорить
лишь о том, что в современной литературе
предпочитают использовать термодинамическое,
а не термохимическое правило знаков
для теплоты.
)
перед
и
.
Отличия вызваны тем, что конкретный вид
этого уравнения зависит от соглашений,
называемых «правилами знаков для работы
и теплоты». Выше использовано
«теплотехническое правило знаков для
работы» (положительной считают работу,
совершаемую системой, когда она отдаёт
энергию, а отрицательной — работу,
совершаемую над системой, когда она
получает энергию) и «термодинамическое
правило знаков для теплоты» (положительной
считают теплоту, получаемую системой,
а отрицательной — теплоту, отдаваемую
системой). В «термодинамическом правиле
знаков для работы» положительной считают
работу, совершаемую над системой, а
отрицательной — работу, совершаемую
системой. Наконец, в «термохимическом
правиле знаков для теплоты» положительной
считают теплоту, отдаваемую системой,
а отрицательной — теплоту, получаемую
системой. Мнемоническое правило: в
термодинамической системе знаков
имеет
тот же знак, что и энергия, передаваемая
системе в виде работы или теплоты; в
остальных случаях знак
противоположен
знаку передаваемой энергии. Стандарта,
предписывающего использовать конкретный
набор правил знаков, не существует, так
что уместно рассматривать только степень
распространённости того или иного
правила в научной и учебной литературе.
По этому поводу однозначно можно говорить
лишь о том, что в современной литературе
предпочитают использовать термодинамическое,
а не термохимическое правило знаков
для теплоты.
Иногда в рассматриваемое выражение для первого начала наряду с работой и теплотой включают ещё и работу переноса массы (химическую работу), выделяя её из общего выражения для работы в отдельное слагаемое.
* 2-й закон — второе начало термодинамики: Второй закон термодинамики исключает возможность создания вечного двигателя второго рода. Имеется несколько различных, но в то же время эквивалентных формулировок этого закона.
1 — Постулат Клаузиуса. Процесс, при котором не происходит других изменений, кроме передачи теплоты от горячего тела к холодному, является необратимым, то есть теплота не может перейти от холодного тела к горячему без каких-либо других изменений в системе. Это явление называют рассеиванием или диссипацией энергии.
Приведем
второе начало термодинамики в ещё одной
формулировке Рудольфа
Юлиуса Клаузиуса (1865):
для любой квазиравновесной термодинамической
системы существует однозначная функция
термодинамического состояния ![]() ,
называемая энтропией, такая, что ее
полный дифференциал
,
называемая энтропией, такая, что ее
полный дифференциал ![]() . [3]
. [3]
2 — Постулат Кельвина. Процесс, при котором работа переходит в теплоту без каких-либо других изменений в системе, является необратимым, то есть невозможно превратить в работу всю теплоту, взятую от источника с однородной температурой, не проводя других изменений в системе.
Билет 35
Закон гесса
Закон Гесса — математическое следствие первого начала термодинамики, которое формулируется следующим образом:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
![]()
Закон открыт русским химиком Г. И. Гессом в 1840 г.; он является частным случаем первого начала термодинамики применительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него.
Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц.
Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенных температуре и давлении.
Если термомеханическую систему рассматривать как состоящую из макротела (газа) и поршня площадью S с грузом весом Р = pS, уравновешивающего давление газа р внутри сосуда, то такая система называется расширенной.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV
![]()
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергии и другим термодинамическим потенциалам — имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в процессе изменения состояния
![]()
Изменение
энтальпии (или Тепловой
эффект химической реакции)
не зависит от пути процесса, определяясь
только начальным и конечным состоянием
системы. Если система каким-либо путём
возвращается в исходное состояние
(круговой процесс), то изменение любого
её параметра, являющегося функцией
состояния, равно нулю, отсюда ![]() ,
или же
,
или же
![]()
Дифференциал энтальпии, выраженный в собственных переменных — через энтропию S и давление p:
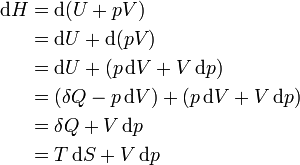
Поскольку
в квазиравновесных
процессах ![]() —
количество теплоты, подведенной к
системе, отсюда вытекает физический
смысл введения понятия энтальпии: ее
изменение — это тепло, подведенное
к системе в изобарическом
процессе (при
постоянном давлении). Практическое
применение этой функции основано на
том, что множество химических процессов
в реальных или лабораторных условиях
реализуются именно при постоянном
(атмосферном) давлении, когда резервуар
открыт. Так, энтальпия
образования —
количество энергии, которое выделяется
или поглощается при образовании сложного
вещества из простых веществ.
—
количество теплоты, подведенной к
системе, отсюда вытекает физический
смысл введения понятия энтальпии: ее
изменение — это тепло, подведенное
к системе в изобарическом
процессе (при
постоянном давлении). Практическое
применение этой функции основано на
том, что множество химических процессов
в реальных или лабораторных условиях
реализуются именно при постоянном
(атмосферном) давлении, когда резервуар
открыт. Так, энтальпия
образования —
количество энергии, которое выделяется
или поглощается при образовании сложного
вещества из простых веществ.
Все химические реакции сопровождаются выделением (экзотермические) или поглощением (эндотермические) тепла. Мерой теплоты реакции служит изменение энтальпии ΔН, которая соответствует теплообмену при постоянном давлении. В случае экзотермических реакций система теряет тепло и ΔН — величина отрицательная. В случае эндотермических реакций система поглощает тепло и ΔН — величина положительная.
Энтальпией системы удобно пользоваться в тех случаях, когда в качестве независимых переменных, определяющих состояние системы, выбирают давление р и температуру Т
![]()
В
этом случае изменение энтальпии в
изобарическом процессе практически
удобно рассчитывать, зная теплоемкость
при постоянном давлении ![]() (термохимический
закон Кирхгофа):
(термохимический
закон Кирхгофа):
Энтропи́я (от др.-греч. ἐντροπία — поворот, превращение) — в естественных науках мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике —мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).
Энтропия в информатике — степень неполноты, неопределённости знаний.
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
![]() ,
,
где ![]() —
приращение энтропии;
—
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
—
приращение энтропии;
—
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциалследующего вида:
![]()
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Билет 36 .
Основные концепции возникновения жизни на Земле
Так, в соответствии с гипотезой "Большого взрыва" Вселенная возникла из сгустка нейтронов в одной из так называемых черных дыр; согласно другим концепциям Вселенная существовала вечно (теория стационарного состояния) или же была создана всемогущим Творцом.
Вопреки бытующим распространенным мнениям наука принципиально не способна опровергнуть идею о божественном сотворении Вселенной, о божественном сотворении всего живого; так же как и теологические взгляды необязательно отвергают идею эволюционного развития жизни (каким-либо образом возникшей жизни, например, по воле Творца), подчиняющегося известным законам природы и объяснимого на основе известных законов природы.
Среди основных теорий (гипотез) возникновения жизни на Земле необходимо выделить пять следующих концепций:
)панспермия (жизнь на Земле была занесена извне - из Космоса, с других планет или иных космических тел);
)самопроизвольное неоднократное зарождение (жизнь возникала неоднократно и спонтанно из неживого вещества);
)гипотеза стационарного состояния (жизнь на Земле существовала всегда, вечно);
)эволюция, например, биохимическая эволюция (жизнь случайным образом возникла в результате физических и химических процессов (реакций) из неживого вещества);
)креационизм (жизнь была создана всемогущим Творцом, Создателем в определенное время).
Рассмотрим кратко каждую из этих теорий.
Билет 37
Гипотеза Абиогенеза или гипотеза самозарождения жизни гласит, что жизнь зародилась на Земле, сама собой, из неживой материи. Первым высказал эту гипотезу русский биохимик А. И. Опарин в 1924 году. Затем такую же гипотезу высказал в 1929 году английский учёный Дж. Холдейн. Они предположили, что жизнь на Земле, как уже было сказано ранее, возникла из неживой материи в результате химической эволюции, то есть сложных химических преобразований. Этому событию благоприятствовали сложившиеся в то время на Земле условия.
Билет 38
Биология – это наука о живом, его строении, формах активности, сообществах живых организмов, их распространении и развитии, связях друг с другом и с неживой природой. Множество учёных пытались дать определение живого организма, но ни одно из них не являлось истинным, в каждом из них были определённые недостатки. Современная биология при описании живого идёт по пути перечисления основных свойств живых организмов. При этом подчёркивается, что только совокупность данных свойств может дать представление о специфике живого. К числу этих свойств относятся:
Живые организмы характеризуются сложной, упорядоченной структурой. Уровень их организации значительно выше, чем в неживых системах.
Живые организмы получают энергию из окружающей среды. Большая часть организмов прямо или косвенно использует солнечную энергию.
Живые организмы активно реагируют на окружающуюся среду ( на внешние раздражители).
Живые организмы не только изменяются, но и усложняются (эволюционируют).
Всё живое размножается.
Живые организмы передают наследственную информацию своим потомкам.
Живые организмы хорошо приспособлены к среде обитания и соответствуют своему образу жизни.
Обобщая и немного упрощая вышесказанное, можно сказать, что все живые организмы (в отличии от неживых) питаются, дышат, растут, размножаются.
Билет 39
одно из общепризнанных биологических обобщений, утверждающих единство принципа строения и развития мира растений, животных и остальных живых организмов с клеточным строением, в котором клетка рассматривается в качестве единого структурного элемента живых организмов.
