
неорг / Дорохов АВ - Основы неорганического синтеза
.pdf4.Получение галогенидов
4.1.Хлорирование металлов и неметаллов хлором.
При выборе конструкции установки для хлорирования необходимо учитывать физические и химические свойства исходного вещества и получаемого хлорида, чистоту хлора и количество получаемого хлорида.
Реакции хлорирования протекают при нагревании и с выделением значительного количества теплоты. Поэтому, если хлор подают в реактор с равномерной скоростью и в нужном количестве, процесс протекает автотермично и подогревать вещество нужно только в начале реакции. Многие исходные вещества (цинк, кадмий, алюминий, сера, селен) плавятся, поэтому их следует помещать в реактор для хлорирования в лодочках. Если же вещество помещается без лодочки, то нужно обеспечить горизонтальное положение реактора, чтобы расплавленное вещество не вытекало из реактора.
Получаемые хлориды при температуре хлорирования могут испаряться или находиться в твёрдом или жидком состоянии, что влияет на скорость реакции. Испаряющиеся хлориды (ZnCl2, CdCl2, FeCl3, AlCl3, GeCl4, SnCl4, S2Cl2) током хлора уносятся из реакционного пространства и конденсируются на более холодных стенках прибора. Если же хлорид получается в твёрдом виде (CoCl2, NiCl2 и т.д.) или жидком состоянии (MnCl2), то он будет покрывать поверхность хлорируемого металла и замедлять реакцию хлорирования.
При давлении 100 кПа испарение хлоридов идёт с небольшой скоростью, поэтому возгонку можно вести в этих условиях. При 10 кПа возгонка идёт со значительной скоростью. В этом случае над хлорируемым веществом можно пропускать сильный ток хлора. Испарение хлоридов позволяет отделить продукт реакции от исходного вещества. Этим методом можно получить и плохо испаряющиеся хлориды, например, хлорид Mn(II), который кипит при 1231 оС. Если хлорирование марганца в виде кусочков 2-4 мм вести при температуре 700-800 оС, через 1-2 ч он полностью превращается в хлорид.
Оксидные плёнки, имеющиеся на поверхности металлов, в большинстве случаев хлорированию не подвергаются. Следовательно, они могут загрязнять получаемый хлорид, если он не возгоняется из реакционного пространства. К тому же они замедляют процесс хлорирования. При наличии в хлоре кислорода
ипаров воды эти примеси могут вступать в реакцию с хлорируемым веществом
идавать оксиды. В этих случаях хлорирование веществ, обладающих большим сродством к кислороду (кремний, бор, хром) и дающих плотные оксидные плёнки, сильно замеляется. В то же время хлорирование протекает при
33
комнатной температуре, если хлор идеально чист и вещества не содержат оксидных плёнок. Например, при размалывании кремния и бора в атмосфере чистого хлора хлориды легко образуются и без нагревания.
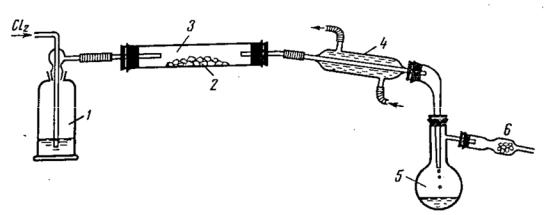
В зависимости от свойств исходных и конечных веществ для хлорирования применяют различные установки. Вещества, дающие жидкие и легкокипящие хлориды (фосфор, сера, селен, теллур, олово и др.), хлорируют в приборе, показанном на рис. 6). Для этого 5-10 г вещества помещают в трубку из тугоплавкого стекла, вытесняют хлором воздух и подогревают трубку газовой горелкой до начала реакции, что заметно по выделению теплоты и образованию своеобразного тумана. Размеры прибора и особенно размеры холодильника и приёмника выбирают в соответствии с навеской хлорируемого вещества. Отдельные части прибора желательно соединять на шлифах. В крайнем случае, резиновые переходы между отдельными деталями прибора должны быть по возможности короче, так как хлор и особенно хлориды действуют на каучук.
Рис. 6. Прибор для получения легкокипящих хлоридов хлорированием легкоплавких металлов или неметаллов.
1 – счётчик пузырьков с концентрированной серной кислотой, 2 – хлорируемое вещество, 3 – трубка из обычного стекла, 4 – холодильник, 5 – приёмник, 6 – хлоркальциевая трубка.
Для получения легкокипящих хлоридов из легкоплавких веществ, например, хлоридов олова, серы, удобна установка, приведённая на рис. 7. В реторту (или двугорлую колбу) помещают вещество (серу, гранулированное олово и т.д.) и при небольшом нагревании пропускают хлор. Пары хлорида конденсируются в холодильнике и стекают в приёмник.
34
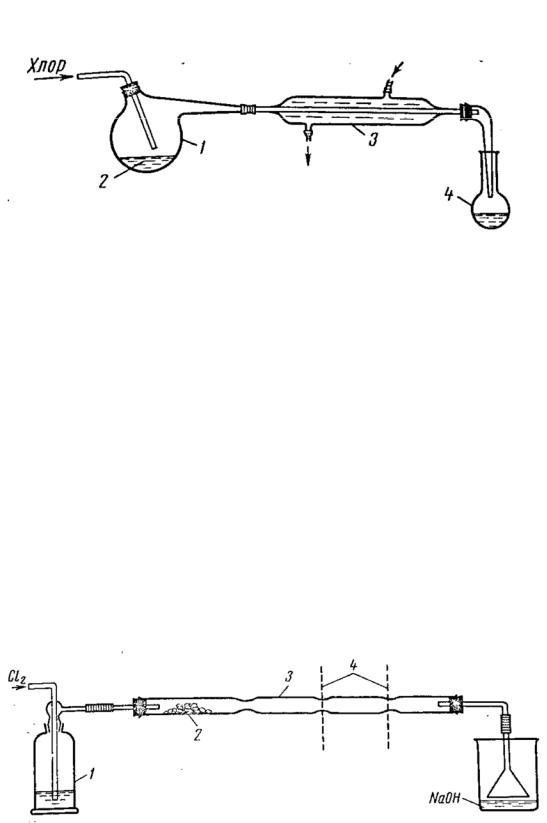
Рис. 7. Прибор для получения легкокипящих хлоридов хлорированием легкоплавких металлов или неметаллов.
1 – реактор, 2 – расплавленные металл или неметалл, 3 – холодильник, 4 – приёмник.
Хлориды, которые возгоняются при температуре 100-350 оС (FeCl3, AlCl3, CdCl2, ZnCl2), получают в другом приборе (рис. 8). Хлорируемое вещество помещают в первое колено трубки для хлорирования. После вытеснения из системы воздуха хлором вещество в трубке нагревают газовой горелкой и, продолжая пропускать хлор, проводят хлорирование. Хлорид собирается во втором колене трубки. После окончания хлорирования продукт перегоняют в слабом токе хлора в третье колено трубки, что позволяет получить его в более чистом виде. Для возгонки вещества нагревают соответствующее колено трубки. Необходимо следить, чтобы продукт не скапливался в узких местах трубки. Затем, после охлаждения в токе хлора, прибор разбирают, трубку с веществом быстро закрывают пробками для предупреждения попадания влаги и воздуха и запаивают его во втором или третьем коленах.
Рис. 8. Прибор для получения легковозгоняющихся хлоридов.
1 – счётчик пузырьков с серной кислотой, 2 – хлорируемое вещество, 3 – трубка для хлорирования, 4 – место запаивания продукта.
Большие количества легковозгоняющихся хлоридов удобно получать в приборе, схема которого приведена на рис. 9. Хлорирование проводят в
35
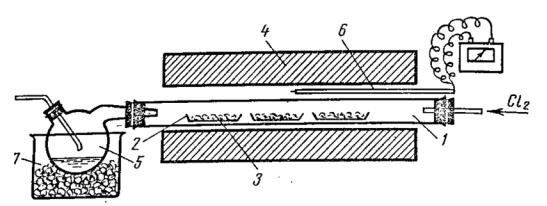
фарфоровой или кварцевой трубке, куда помещают вещество в лодочках. Трубку нагревают электропечью. Получаемый хлорид током хлора уносится в приёмник, который изготавливают из реторты. Его полезно охлаждать холодной водой.
Рис. 9. Прибор для получения больших количеств легковозгоняющихся хлоридов. 1 – фарфоровая или кварцевая трубка, 2 – лодочки, 3 – хлорируемое вещество, 4 – электропечь, 5 – приёмник хлоридов, 6 – термопара, 7 – охлаждающая смесь.
Хлор, получаемый в лабораторных условиях окислением хлороводородной кислоты перманганатом калия или оксидом марганца(IV), содержит кислород и пары воды. Примеси этих веществ окисляют алюминий, титан, цирконий, кремний, бериллий, бор и т.д. Поэтому хлориды загрязняются оксидами. Следовательно, для получения чистых хлоридов необходимо или подвергать специальной очистке хлор, или отгонять хлориды из реакционного пространства. Для очистки хлора от кислорода его пропускают через раскалённую трубку, наполненную углём. Кислород даёт с углём оксид углерода(II), который не мешает хлорированию. Некоторые оксиды, например, меди, свинца, кобальта, никеля, щелочных и щелочноземельных металлов, сравнительно легко превращаются в хлориды. Поэтому при хлорировании этих металлов хлор можно не очищать от кислорода.
4.1.1. Получение хлорида ванадия (IV)
Собрать прибор для получения хлора из перманганата калия и соляной кислоты (рис 10). В колбу Вюрца (вместо неё можно использовать двугорлую колбу) поместить 15-20 г перманганата калия. В капельную воронку налить 37%-й раствор соляной кислоты (прежде чем наполнить воронку кислотой, необходимо убедиться, что это действительно хлористоводородная кислота.
Следует помнить, что при взаимодействии концентрированной серной
36
кислоты с перманганатом калия может произойти взрыв). Промывалку,
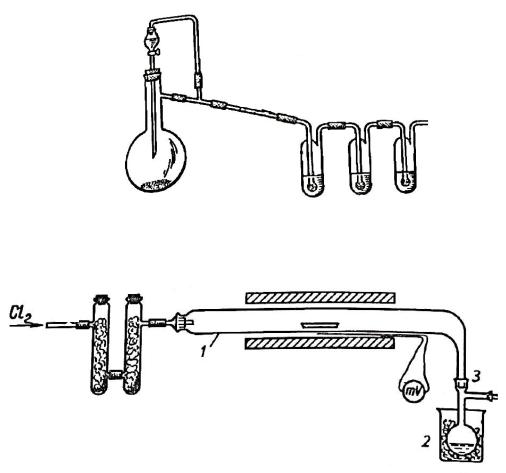
ближнюю к колбе, следует оставить пустой (почему?). Вторую и третью промывалку заполнить концентрированной серной кислотой (зачем?). Соединить установку для получения хлора с прибором для получения хлоридов (рис. 11). В качестве приёмника использовать круглодонную колбу с аллонжем, соединённую со шлифом (3). К аллонжу присоединить хлоркальциевую трубку с осушителем.
Рис. 10. Прибор для получения хлора.
Рис. 11. Прибор для хлорирования.
1 – реактор, 2 – стакан с охлаждающей смесью, 3 – аллонж со шлифами.
Металлический ванадий (~3 г), имеющий размер зёрен ~2 мм (но не порошок!) в фарфоровой лодочке поместить в реактор. Вытеснить из прибора воздух током сухого хлора и проводить нагревание при температуре 300-350 оС в течение 1-1.5 ч.
Очистить полученный продукт перегонкой при атмосферном давлении (рис. 12). Собрать фракцию, кипящую при 155 оС. Определить выход продукта, отметить его цвет.
37
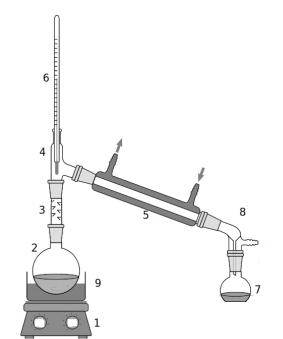
Рис. 12. Прибор для фракционной перегонки при атмосферном давлении.
1 – электроплитка, 2 – круглодонная колба, 3 – дефлегматор, 4 – насадка Вюрца, 5 – холодильник прямой, 6 – термометр, 7 – колба-приёмник, 8 – аллонж, 9 – песчаная баня
Несколько капель хлорида ванадия(IV) растворить в небольшом количестве воды. Каков цвет водного раствора? Почему изменилась окраска исходного продукта? Записать уравнения реакций.
4.1.2. Получение хлорида серы (I)
Собрать прибор для получения хлора из перманганата калия и соляной кислоты (рис 10). В колбу Вюрца (вместо неё можно использовать двугорлую колбу) поместить 15-20 г перманганата калия. В капельную воронку налить 37%-й раствор соляной кислоты (прежде чем наполнить воронку кислотой, необходимо убедиться, что это действительно хлористоводородная кислота.
Следует помнить, что при взаимодействии концентрированной серной кислоты с перманганатом калия может произойти взрыв). Промывалку,
ближнюю к колбе, следует оставить пустой (почему?). Вторую и третью промывалку заполнить концентрированной серной кислотой (зачем?). Соединить установку для получения хлора с прибором для получения легкокипящих хлоридов (рис. 7).
Поместить в реторту (или двугорлую колбу) 10 г технической серы. Нагреть реторту с серой на песчаной бане до 150-200 оС. Через расплавленную
38
серу пропускать ток сухого хлора с такой скоростью, чтобы практически весь хлор поглощался расплавом серы. Хлорид в виде зеленовато-жёлтой жидкости будет собираться в приёмнике. При сильном токе хлора хлорид серы(I) загрязняется хлоридом серы (II), а при сильном нагревании серы – серой, которая растворяется в хлориде серы(I).
Для получения чистого продукта добавить в него небольшое количество серы и перегнать при атмосферном давлении с дефлегматором (рис. 12). Собрать фракцию, кипящую выше 130 оС.
Небольшое количество жидкости добавить в стакан с водой (под тягой!).
Что при этом наблюдается? Как установить, какие продукты образовались в ходе гидролиза?
Жидкость перелить во взвешенную оттянутую пробирку (ампулу) и запаять (надеть очки!). Взвесить ампулу с веществом и остатком пробирки. Рассчитать выход в процентах.
4.2. Хлорирование металлов и неметаллов хлороводородом
Хлорирование металлов и неметаллов сухим хлороводородом протекает более спокойно, чем с хлором. Поскольку реакции идут с выделением водорода, хлориды всегда получаются в низшей степени окисления. Поэтому данный метод удобен для получения CrCl2, FeCl2, SnCl2, SbCl3 и некоторых других хлоридов. При использовании хлороводорода процесс идёт, как правило, при более высоких температурах, чем с хлором. Хлорирование проводят в фарфоровых или кварцевых трубках, куда помещают лодочку с веществом (рис. 1., вместо аппарата Киппа подключается источник хлороводорода) или в трёхколенных стеклянных трубках. Хлорид остаётся в лодочке или возгоняется и конденсируется на холодных стенках трубки. Собрать его и в том, и другом случае трудно. Для этого после охлаждения трубки лодочку быстро вынимают металлическим крючком, трубку устанавливают вертикально и, подставив к нижней её части приёмник (пробирку, бюкс и т.п.), быстро проталкивают возгон в приёмник металлическим прутом.
В некоторых случаях удобно проводить хлорирование в суспензии металла в неводном растворителе (нипример, в абсолютированном этаноле), насыщенном хлороводородом. В этом случае не требуются высокие температуры и сложная аппаратура, реакция проводится в двугорлой колбе
39
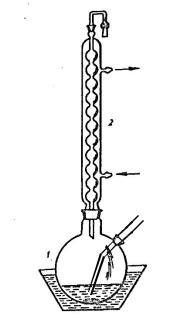
(рис. 12) или в трёхгорлой колбе, снабжённой, снабжённой мешалкой; для более эффективного перемешивания лучше использовать лопастную мешалку с верхним приводом, а не магнитную (рис. 13).
Рис. 13. Прибор для хлорирования хлороводородом в среде растворителя. 1 – двугорлая колба, 2 – обратный холодильник.
Вместо хлорирования металла в ряде случаев можно проводить вытеснительное хлорирование хлороводородом солей слабых кислот, замещая анион слабой кислоты (например, уксусной) хлорид-ионами в среде безводной кислоты или иного безводного растворителя.
4.2.1. Получение безводного хлорида марганца (II)
Собрать прибор (рис 13). Поместить в колбу 1г металлического марганца в виде небольших кусочков и 50 мл абсолютированного спирта. Включить мешалку. Охладить колбу сухим льдом и насыщать спирт тщательно осушенным хлористым водородом (1-2 ч). Снять охлаждение и оставить слабый ток хлористого водорода. В случае замедления реакции погрузить колбу в водяную баню, нагретую до 50-60 оС. После окончания реакции (как это определить?) декантацией отделить раствор от непрореагировавшего металла. Перенести раствор в круглодонную колбу и отогнать спирт в вакууме водоструйного насоса, обогревая колбу в стакане с кипящей водой. Что кристаллизуется в колбе?
40
Десольватацию хлорида марганца производить в вакууме водоструйного насоса при осторожном нагревании колбы пламенем горелки. Перенести полученное вещество во взвешенный бюкс, взвесить и рассчитать выход в процентах.
4.2.2. Получение безводного хлорида меди (II)
Собрать прибор (рис 14.). Поместить в колбу 5 г дигидрата ацетата меди (II), 200 мл ледяной уксусной кислоты, вымороженной дважды, и 10 мл уксусного ангидрида. Растворить соль при перемешивании и нагревании (450С) на водяной бане. Отметить цвет полученного раствора.
Рис. 14. Прибор для хлорирования в среде растворителя.
Прекратить нагревание и пропустить ток тщательно осушенного хлорида водорода. Насыщение вести до полного обесцвечивания раствора (1-1.5 ч). Вместо хлорида водорода можно прилить в колбу 4 мл (избыток) ацетилхлорида и продолжить перемешивание реакционной массы в течение 15 мин. Что образовалось в реакционной колбе? Записать наблюдения, уравнения реакций.
Отфильтровать осадок на стеклянном фильтре №4 при помощи водоструйного насоса в атмосфере сухого воздуха, промыть ледяной уксусной
41
кислотой, вымороженной дважды, и абсолютным эфиром. Просушить на фильтре до образования сыпучего продукта. Взвесить полученное вещество, защитив от влаги воздуха. Рассчитать выход.
Часть полученного вещества растворить в абсолютном этиловом спирте, ацетоне. Записать наблюдения.
4.3. Хлорирование оксидов
Хлорирование оксидов – процесс обратимый: 2MO + 2Cl2 2MCl2 + O2
Поскольку эта реакция гетерогенная, состояние равновесия определяется соотношением хлора и кислорода в газовой фазе. Следовательно, действуя избытком чистого хлора на оксид, можно сместить равновесие в сторону образования хлорида. Однако при таком методе хлорирования значительная часть хлора будет расходоваться непроизводительно.
Хлориды многих элементов при 25 оС более устойчивы, чем оксиды. Оксиды щелочных и щелочноземельных металлов под действием хлора легко переходят в хлориды. В состоянии равновесия при высоких температурах в газовой фазе находится большое количество кислорода и незначительное количество хлора. Оксиды бора, кремния, алюминия титана и некоторых других элементов хлорируются с трудом. Практически хлорирование этих оксидов проводят в присутствии кислородотнимающего агента, облегчающего смещение равновесие в сторону образования хлорида.
Наиболее удобен в этом отношении уголь. При хлорировании оксидов уголь окисляется главным образом до оксида углерода(II), который с хлором (при его избытке) даёт фосген. Если хлор пропускать медленно через смесь оксида с избытком угля, то содержание фосгена в отходящих газах уменьшается. Уголь удобен не только потому, что при его окислении образуются газы, легко выводимые из сферы реакции, но ещё и потому, что углерод практически не хлорируется (в отличие от других веществ, отнимающих кислород).
Для хлорирования готовят смесь из угля и оксида. Уголь берут в некотором избытке по сравнению с теоретическим расчётом, полагая, что он в данном процессе окисляется до оксида углерода(II). Смесь оксида и угля растирают в ступке, заливают густым крахмальным клейстером, перемешивают и полученную пасту помещают тонким слоем (0.5 см) на бумагу. После высушивания смеси в сушильном шкафу её разламывают на кусочки и
42
