
неорг / Дорохов АВ - Основы неорганического синтеза
.pdf2. Получение простых веществ
2.1. Восстановление водородом
Реакции восстановления оксидов водородом наиболее часто используют для получения металлов и некоторых неметаллов в чистом состоянии. Особенность этих реакций состоит в том, что они являются обратимыми и гетерогенными. Равновесие может быть смещено как в сторону получения металла и паров воды, так и в сторону исходных продуктов, что определяется прочностью восстанавливаемого оксида.
Водород относится к сравнительно слабым восстановителям, но равновесие смещается в сторону образования металла, так как один из продуктов – пары воды – легко удаляется из зоны реакции током водорода.
Восстановление высших оксидов многовалентных металлов протекает ступенчато. Особенно легко идёт восстановление оксидов элементов, находящихся в высшей степени окисления (Fe2O3, MnO2, V2O5 и т.д.). Равновесие в реакциях восстановления таких оксидов сильно смещено в сторону образования оксидов с низшей степенью окисления. Для смещения равновесия в сторону образования металла необходимо повысить концентрацию водорода в системе, то есть проводить восстановление в достаточно сильном токе водорода.
С понижением степени окисления прочность оксидов увеличивается, и константа равновесия подобных реакций сильно уменьшается. Таким образом, возможность получения металлов и неметаллов восстановлением оксидов определяется прочностью низших оксидов.
Такие устойчивые оксиды, как SiO2, MnO, TiO и др., практически не восстанавливаются водородом, так как для получения даже небольших количеств простого вещества нужны огромные количества абсолютно сухого водорода. Например, константа равновесия
SiO2 (т) + 2H2 (г) = Si (т) + 2H2O(г)
при 1200 оС равна 10–65. Поэтому для получения всего 1 г кремния восстановлением его оксида требуется 6 1064 г совершенно сухого водорода. Если же водород содержит даже следы паров воды, то они будут окислять кремний до его оксида.
Реакции восстановления водородом начинаются при температуре около 200-400 оС и в большинстве случаев идут с небольшими скоростями. Металлы, получаемые при умеренных температурах, часто обладают пирофорностью, т.е. самовоспламеняются на воздухе. Металлы, полученные при высоких
13
температурах, пирофорностью не обладают. Объясняется это тем, что при высоких температурах увеличивается подвижность атомов, поэтому образуются более крупные кристаллы металла.
Если температура восстановления близка к температуре плавления, металлы получаются в виде плотной губки. При температурах восстановления выше температуры плавления металлы получаются в сплавленном виде. Выбор метода восстановления определяется свойствами исходного оксида, а также требуемой формой получения металла.
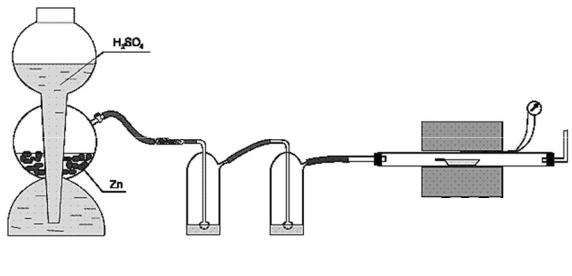
Если температура восстановления выше 600-650 оС, реакцию проводят в трубчатых электропечах (рис. 1). Исходное вещество помещают в фарфоровую или кварцевую лодочку, которую помещают в реактор (как правило, кварцевая трубка) и нагревают в токе водорода до нужной температуры. Водород для восстановления получают или в электролизёре, или в аппарате Киппа. Предварительно установку проверяют на герметичность. Для этого конец газоотводной трубки погружают на 4-5 см в воду и пропускают водород. Выделяющиеся пузырьки газа указывают на герметичность. Если источником водорода служит аппарат Киппа, герметичность установки можно проверить, перекрыв зажимом газоотводную трубку. Если установка герметична, реакция в аппарате Киппа прекратится и водород перестанет пробулькивать через промывочные склянки.
Рис. 1. Схема установки для восстановления оксидов водородом.
Перед нагреванием реактора воздух из него необходимо вытеснить водородом, после чего водород, выходящий из газоотводной трубки, собирают в пробирку и проверяют на чистоту. Только после этого трубку нагревают в токе водорода, пропуская его со скоростью 1-2 пузырька в секунду.
14
При восстановлении оксидов образуются пары воды. При восстановлении более устойчивых оксидов бóльшая часть паров воды уносится водородом в атмосферу. Если восстанавливаются непрочные оксиды (CuO, PbO и т.п.), то в конце трубки (реактора) собираются капельки воды. Поэтому в этом случае печь располагают с небольшим наклоном, чтобы конденсирующаяся вода не попадала на раскалённые части реактора.
При восстановлении водородом необходимо контролировать температурный режим, поэтому для измерения температуры используют термопару, которую располагают вне трубки (реактора) в непосредственной близости от лодочки.
При температуре 550-600 оС и ниже реакцию можно вести не в лодочке, а прямо в стеклянной трубке или в трубке с перетяжками. В такой реактор при помощи шпателя вводят 2-3 г оксида и нагревают его в токе водорода. Если полученный металл окисляется на воздухе, его следует по окончании реакции запаять в той же трубке. Для этого после охлаждения металла в токе водорода трубку отсоединяют от источника водорода, вынимают пробки, и оставляют её на 5-7 минут в наклонённом положении. Затем трубку запаивают.
Окончание реакции восстановления оксидов определить довольно трудно. Иногда об этом можно судить по изменению цвета или уменьшению массы оксида. Практически водород пропускают в избытке в течение 20-30 минут, после чего реакцию считают доведённой до конца.
После окончания реакции прибор охлаждают в токе водорода, отсоединяют газоподводящую трубку, вынимают лодочку, извлекают продукт реакции и при необходимости запаивают его в пробирке. Запрещается
разбирать прибор в горячем состоянии, так как воздух, попавший в реактор, может образовать с водородом взрывчатую смесь!
2.1.1. Получение молибдена (вольфрама)
Собрать прибор для получения металлов водородом (рис. 1). Тщательно проверить герметичность прибора. Взвесить в лодочке ~1 г триоксида молибдена (вольфрама) и поместить лодочку с металлом в кварцевую трубку. Ещё раз проверить герметичность прибора. Заполнить установку водородом, проверить водород на чистоту (как это сделать?) и только после этого включить печь. Восстановление проводить при температуре 800-900 оС в токе сухого водорода (чем можно осушать водород?). Для получения крупнозернистого металла, не прерывая тока водорода, постепенно повысить
15
температуру до 1000-1000 оС (для вольфрама до 1200-1300 оС, в этом случае вместо кварцевого необходимо использовать стальной реактор). Когда восстановление закончится (как в этом убедиться?), охладить прибор в токе водорода до комнатной температуры.
Испытать отношение полученного металла к 10%-м и концентрированным растворам кислот и щелочей на холоду и при нагревании.
2.1.2. Получение пирофорного железа
Собрать прибор для получения металлов водородом (рис. 1). Проверить герметичность прибора. Тщательно растереть в агатовой ступке оксид железа(III), взвесить в лодочке ~1 г оксида и поместить лодочку в реактор. Печь установить с небольшим наклоном в сторону газоотводной трубки (зачем?). Восстановление вести в токе водорода при температуре 400-500 оС в токе сухого водорода (чем можно осушать водород?). Когда восстановление закончится (как в этом убедиться?), охладить печь до 100 оС, вынуть лодочку и с некоторой высоты высыпать порошок железа в нагретую фарфоровую чашку. Что при этом происходит? Чем объясняется пирофорность железа?
2.2. Металлотермический метод
Металлотермическими реакциями называют реакции, протекающие между оксидами и металлами и приводящие к получению металла в сплавленном виде за счёт большого выделения теплоты в ходе реакции. Если же выделяющейся теплоты не хватает для расплавления продуктов, то металл получается в виде мельчайших капелек, т.е. в виде порошка.
Этот метод, открытый в 1856 г. Русским химиком Н.Н. Бекетовым, находит применение как в промышленности (например, магнийтермическое получение титана), так и для лабораторного получения металлов, сплавов и некоторых неметаллов.
Наиболее часто в качестве восстановителя применяют алюминий. Для образования сплавленного блока металла количества выделяющейся теплоты должно хватить на нагревание веществ выше температуры плавления наиболее тугоплавкого из получаемых компонентов, а также на тепловые потери за время от начала процесса до окончания расслаивания продуктов на шлак и металл. При восстановлении большинства оксидов (Fe2O3, Fe3O4, CoO, NiO, MnO2, CrO3, MoO3, V2O5, SnO2 и др) алюминием выделяющейся теплоты вполне
16
достаточно для этого. В этом случае получается металл, который оседает на дно тигля.
Восстановление Mn2O3, MnO2, Co3O4 алюминием происходит с большой скоростью, с разбрасыванием реакционной смеси. При этом в зоне реакции бóльшая часть этих оксидов разлагается ч выделением кислорода и образованием Mn3O4, CoO. Выделяющийся кислород разбрасывает реакционную массу и перемешивает продукты, что мешает полному осаждению получаемого металла. Поэтому эти оксиды нельзя применять для получения марганца, кобальта и их сплавов. Частичное разложение и испарение наблюдается и при алюминотермическом восстановлении оксида хрома(VI) и оксида молибдена(VI). Поэтому эти оксиды также нельзя использовать для алюминотермического получения металлов. Но их можно применять для получения сплавов в качестве добавок к другим оксидам. Для уменьшения испарения оксида молибдена(VI) в шихту добавляют фторид кальция.
При использовании в качестве восстановителей магния или кальция металлы получаются в виде порошка. Это можно объяснить тем, что образующийся оксид магния (или кальция) имеет высокую температуру плавления, поэтому во время реакции не расплавляется и изолирует друг от друга отдельные мельчайшие капли металла.
При проведении алюминотермических реакций необходимо соблюдать некоторые правила предосторожности. Алюминий берут в виде мелких крупинок. Порошкообразный алюминий (алюминиевая пудра) непригоден, так как с ним реакции протекают слишком бурно, происходит разбрызгивание смеси, что снижает выход получаемого металла.
Оксиды, а также реактор (тигель) необходимо просушить при 150-200 оС (так как при наличии влаги в ходе восстановления реакционная смесь разбрасывается). После этого оксиды растирают в порошок и отделяют на сите от неразмельчённых частичек. Высушенные и размельчённые исходные вещества отвешивают на технических весах и тщательно перемешивают. При проведении реакции следует брать не менее 25-30 г исходных веществ (суммарно). С бóльшими количествами веществ реакции идут ещё лучше и выход металлов увеличивается.
Масса алюминия должна быть равна теоретически рассчитанной. Чтобы получить металл или сплав без алюминия, следует брать его несколько меньше теоретически рассчитанного (на 1-2%).
В качестве восстановителя можно использовать смеси порошкообразных металлов, а также смеси металлов с кремнием, например:
17
4Cr2O3 + 3Mg + 6Al = 8Cr + 3Mg(AlO2)2
Несмотря на то, что алюминат магния плавится при 2135 оС, т.е. выше, чем оксид алюминия, реакции со смесью восстановителей идут лучше. Это объясняется тем, что при использовании данной смеси металлов теплоты выделяется больше, чем при использовании одного алюминия. Например, алюминий оксид хрома(III) непосредственно не восстанавливает, а смесь алюминия с магнием или кальцием этот оксид восстанавливает.
Для проведения реакции нужна зажигательная смесь. Существует несколько рецептов приготовления зажигательной смеси:
1)9 массовых частей растёртого пероксида бария смешивают с 1 м.ч. порошкообразного алюминия;
2)смешивают 3 м.ч. растёртого нитрата калия и 1.3 м.ч. алюминиевой пудры;
3)готовят смесь 4 м.ч. растёртого пероксида бария и 1 м.ч. порошкообразного алюминия и добавляют 0.7 м.ч. отдельно растёртого хлората калия. Зажигательную смесь хранят в сухой, хорошо закупоренной стеклянной банке; приготавливать её в больших количествах не рекомендуется.
Вкачестве реактора используют магнезиальные или корундовые тигли, так как
они термически стойки и вещества при работе с ними меньше загрязняются. Фарфоровые тигли, как правило, разрушаются. Поэтому их нужно помещать в песок, чтобы расплавленная масса не выливалась. Более удобны шамотовые или глиняные тигли, но в этом случае продукт загрязняется кремнием и другими веществами.
2 |
|
|
|
4 |
|
7 |
3 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
5
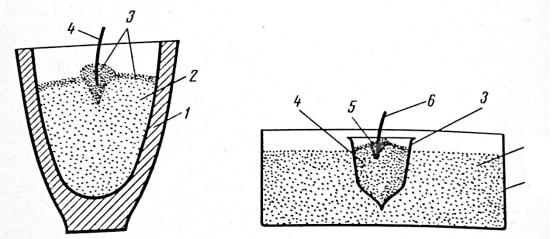
Рис. 2. Алюминотермическое восстановление оксидов в тигле (а) и в песке (б).
1 – тигель, 2 – смесь оксидов с алюминием, 3 – зажигательная смесь, 4 – магниевая лента, 5 – металлический ящик, 6 – песок, 7 – бумажный кулёк.
18
Тигель (рис. 2) заполняют смесью оксида и восстановителя на ¾ его высоты, утрамбовывают смесь, делают небольшое углубление и засыпают сверху тонким слоем (около 1-1.5 мм) зажигательной смеси. Ленту магния вставляют в углубление, которое затем заполняют зажигательной смесью в форме горки. Если магниевая лента покрыта слоем оксида, её предварительно очищают ножом.
Реакцию можно проводить также в предварительно прокалённых песке или оксиде магния. В таком материале, насыпанном в стальной ящик, делают углубление, в которое и помещают реакционную смесь в бумажном кульке.
Меры предосторожности: реакцию проводят в вытяжном шкафу, откуда убирают все легковоспламеняющиеся материалы. Тигель помещают на песок. Работать необходимо в защитных очках. Магниевую ленту поджигают лучиной, помещённой в длинную (не менее 1 м) стеклянную трубку.
После окончания реакции тигель охлаждают, разбивают и отделяют королёк металла от шлака. Иногда кусочки металла остаются в шлаке в виде включений. В этом случае шлак нужно разбить молотком на стальной плите и отделить от него металл. Выход продукта чаще всего составляет 60-70% и определяется в значительной степени чистотой отделения металла от шлака.
2.2.1. Получение марганца алюминотермическим методом
Опыт проводить в присутствии преподавателя, под тягой! Надеть очки или маску! 20 г тонкоизмельчённого оксида марганца(IV) поместить в фарфоровый тигель и прокалить в муфельной или тигельной печи при температуре 800 оС в течение 1 ч. Что при этом образуется? Почему для получения металлического марганца алюминотермическим способом не применяют непосредственно оксид марганца(IV)?
Полученный в результате прокаливания продукт тщательно растереть и перемешать в фарфоровой ступке с 5 г алюминиевых опилок. Смесь поместить в шамотовый или алундовый тигель, окруженный сухим песком (рис. 2а). Если нет тигля, можно использовать бумажный или картонный кулёк, свернув его в виде тигля и закрепив его проволокой или степлером (рис. 2б). Добавить в тигель 10 г зажигательной смеси (см. п. 2.2), вставить ленту магния и поджечь её горящей лучинкой, вставленной в длинную стеклянную трубку. После охлаждения смеси разбить тигель, освободить «королёк» металла от шлака, взвесить и сохранить для дальнейших опытов.
19
«Королёк» марганца разбить пестиком в стальной ступе или молотком, обратить внимание на хрупкость металла, отметить его цвет на свежем изломе, испытать магнитом, проверить отношение к воде, раствору щёлочи, а также разбавленным и концентрированным растворам кислот: хлористоводородной, серной и азотной (на холоду и при нагревании). Написать уравнения реакций.
2.2.2. Получение хрома алюминотермическим методом
Опыт проводить в присутствии преподавателя! Надеть очки или маску! Прокалить в железном тигле оксид хрома(III). Растереть в ступке дихромат калия, сплавить его в фарфоровом тигле на пламени газовой горелки, вылить на кафельную пластинку и снова растереть в порошок. Взвесить 6 г прокалённого оксида хрома(III), 6 г сплавленного дихромата калия и 5 г порошка алюминия, все вещества тщательно перемешать в ступке. Насыпать на дно шамотового тигля 4 г порошка фторида кальция (зачем?), а затем приготовленную смесь. Уплотнить массу пестиком и сделать отверстие пробиркой. Приготовить зажигательную смесь встряхиванием в банке 2.5 г порошка алюминия и 7.5 г пероксида бария. (Не растирать смесь в ступке!) Всыпать зажигательную смесь в сделанное ранее углубление в реакционной массе и вставить магниевую ленту, очищенную от оксида (рис. 2). Поставить тигель на сковороду (или в железный ящик) и засыпать со всех сторон сухим песком. Поджечь ленту магния горящей лучинкой, вставленной в длинную (0.5 – 0.8 м) стеклянную трубку, после чего отойти от тигля.
По окончании реакции дать тиглю остыть, разбить его, извлечь «королёк» хрома и взвесить. Определить выход в процентах. Объяснить течение реакции.
Измельчить в чугунной ступке полученный «королёк» хрома на мелкие кусочки. Отметить цвет металла на свежем изломе. Испытать его отношение к магниту и исследовать его твёрдость, для чего провести кусочком хрома по стеклянной пластинке.
Несколько кусочков хрома положить в пробирки и испытать отношение его к воде, раствору щёлочи, а также разбавленным и концентрированным растворам кислот: хлористоводородной, серной и азотной (на холоду и при нагревании). Написать уравнения реакций. Где находится хром в ряду напряжений металлов?
20

2.3. Электрохимический метод
Электролиз используется для получения электролитических покрытий металлов и для осаждения металлов в виде порошка. Плотные мелкокристаллические осадки, прочно сцепленные с катодом, выделяются из электролитов, содержащих металл в составе комплексного иона. Металлы в порошкообразном состоянии образуются при больших плотностях катодного тока. В этих условиях в прикатодном слое электролита мало ионов металла, поэтому на катоде выделяется и водород.
Электролиз в каждом конкретном случае проходит при определённой разности потенциалов на электродах, которая называется напряжением разложения. Оно равно разности потенциалов на электродах, к которой надо прибавить значение омического падения напряжения в электролите:
|
|
∙ |
|
|
|
через |
∙ |
|
|
где I – сила тока (А), идущего |
электролизёр, |
, l – расстояние между |
||
электродами (м), - удельная электрическая проводимость электролита (См/м), S – площадь поверхность электрода (м2).
Потенциал на отдельном электроде можно вычислить по уравнению Нернста. Полученное значение называется равновесным потенциалом и относится к неработающему электроду. Потенциал работающего электрода (электрода, на котором идёт электродный процесс) всегда больше равновесного вследствие поляризации. Поляризацией называется отклонение потенциала электрода от равновесного значения. Потенциал работающего электрода меняется в зависимости от силы тока. Эта зависимость, выраженная графически, называется поляризационной кривой. Чем круче поднимается поляризационная кривая, тем меньше поляризация.
На основании поляризационных кривых можно определить условия (потенциал – плотность тока), при которых будет выделяться одно вещество из смеси двух веществ или одновременно два вещества.
На рис. 3. Приведены поляризационные кривые четырёх веществ: A, B, C и D. Потенциалы выделения веществ А и Б близки. При потенциале Е1 и силе тока I1 будет выделяться только одно вещество B. Если же потенциал и силу тока уменьшить до E2 и I2, то будут одновременно выделяться два вещества. При потенциале E3 и силе тока I3 будет выделяться вещество A. Поляризация электродов при выделении веществ С и D происходит примерно в равной степени, так как наклон кривых одинаков. Но выделяются эти вещества при разных потенциалах, например, при E4 и E5, поэтому их легко разделить
21
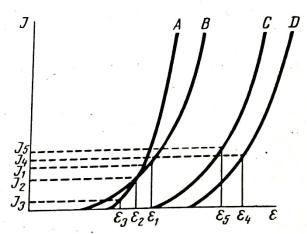
электролитическим методом. Однако в ходе электролиза по мере выработки (уменьшении концентрации) одного из ионов, согласно уравнению Нернста, потенциалы электродов могут сближаться.
Рис. 3. Поляризационные кривые.
Вэлектролит часто вводят различные добавки, изменяющие структуру осадков, улучшающие рассеивающую способность ванны и т.д. К добавкам относят комплексообразователи. Они, связывая ионы металла в комплекс, снижают их концентрацию в растворе и делают потенциал металла более отрицательным.
Некоторые металлы не удаётся выделить электролизом водных растворов. Это металлы, обладающие большим отрицательным потенциалом (щелочные, щелочноземельные), а также металлы, на которых имеется небольшое перенапряжение водорода (ванадий, ниобий, тантал, титан, цирконий). В определённых условиях они осаждаются на электроде тончайшим слоем, но затем процесс прекращается вследствие выделения водорода.
Влабораторных условиях электролиз обычно проводят в стеклянных электролизёрах или в самодельных электролизёрах, изготовленных, например, из органического стекла (рис. 4). Плотность тока регулируется изменением подаваемого напряжения. При значительной плотности тока и при большом сопротивлении электролита напряжение может достигать 20-30 В. Для уменьшения сопротивления ванны рекомендуется расстояние между электродами делать меньше.
22
