
неорг / Дорохов АВ - Основы неорганического синтеза
.pdfОглавление |
|
Введение....................................................................................................................... |
5 |
1. Правила работы в лаборатории.............................................................................. |
6 |
1.1. Порядок работы в лаборатории....................................................................... |
6 |
1.2. Рабочий журнал................................................................................................. |
7 |
1.3. Меры предосторожности при работе в лаборатории .................................. |
10 |
1.4. Оказание первой помощи в лаборатории..................................................... |
11 |
2. Получение простых веществ................................................................................ |
13 |
2.1. Восстановление водородом............................................................................ |
13 |
2.1.1. Получение молибдена (вольфрама)........................................................ |
15 |
2.1.2. Получение пирофорного железа ............................................................. |
16 |
2.2. Металлотермический метод........................................................................... |
16 |
2.2.1. Получение марганца алюминотермическим методом.......................... |
19 |
2.2.2. Получение хрома алюминотермическим методом................................ |
20 |
2.3. Электрохимический метод............................................................................. |
21 |
2.3.1. Получение хрома электрохимическим методом.................................... |
23 |
2.3.2. Получение марганца электрохимическим методом.............................. |
24 |
3. Получение оксидов ............................................................................................... |
26 |
3.1. Термическое разложение веществ................................................................. |
26 |
3.1.1. Получение оксида свинца (II) (желтая и красная модификации)........ |
27 |
3.1.2. Получение оксида марганца (II).............................................................. |
28 |
3.1.3. Получение оксида олова (II).................................................................... |
28 |
3.2. Окисление простых веществ.......................................................................... |
29 |
3.2.1. Получение оксида фосфора (III).............................................................. |
30 |
3.2.1. Получение оксида теллура (IV)............................................................... |
31 |
4. Получение галогенидов........................................................................................ |
33 |
4.1. Хлорирование металлов и неметаллов хлором............................................ |
33 |
4.1.1. Получение хлорида ванадия (IV) ............................................................ |
36 |
4.1.2. Получение хлорида серы (I)..................................................................... |
38 |
3
4.2. Хлорирование металлов и неметаллов хлороводородом............................ |
39 |
4.2.1. Получение безводного хлорида марганца (II)........................................ |
40 |
4.2.2. Получение безводного хлорида меди (II)............................................... |
41 |
4.3. Хлорирование оксидов................................................................................... |
42 |
4.3.1. Получение безводного хлорида хрома (III)............................................ |
44 |
4.3.2. Получение безводного хлорида алюминия (III) .................................... |
45 |
4.3.3. Получение тетрахлорида кремния .......................................................... |
46 |
5. Синтез комплексных соединений........................................................................ |
48 |
5.1.1. Получение нитрата карбонатотетраамминкобальта(III)....................... |
48 |
5.1.2. Получение хлорида хлоропентаамминкобальта (III)............................ |
49 |
5.1.3. Получение хлорида гексамминкобальта (III)......................................... |
49 |
5.1.4. Получение тетракис(тиоцианато)кобальтата(II) калия......................... |
50 |
5.1.5. Получение триоксалатокобальтата(III) калия........................................ |
50 |
5.1.6. Получение хлорида нитропентаамминкобальта(III)............................. |
51 |
5.1.7. Получение хлорида нитритопентаамминкобальта(III)......................... |
51 |
5.1.8. Получение сульфата тетраамминмеди(II).............................................. |
51 |
5.1.9. Получение хлорида гексаамминникеля(II)............................................. |
52 |
5.1.10. Получение хлорида -гидроксо-бис(пентаамминхрома(III))............. |
52 |
5.1.11. Получение гексакис(тиоцианато)хромата(III) калия .......................... |
53 |
5.1.12. Получение хлорида и нитрата гексаамминхрома(III)......................... |
53 |
5.1.13. Получение хлорида хлоропентаамминхрома(III)................................ |
55 |
5.1.14. Получение дипероксотриамминхрома(IV)........................................... |
55 |
5.1.15. Получение хлорида дихлороакватриамминхрома(III)........................ |
55 |
5.1.16. Получение гексагидроксоантимоната(V) калия.................................. |
56 |
6. Разные синтезы...................................................................................................... |
58 |
6.1.1. Получение безводной азотной кислоты ................................................. |
58 |
6.1.2. Получение хлорида тионила.................................................................... |
59 |
6.1.3. Получение хлорида сульфурила.............................................................. |
59 |
6.1.4. Электрохимический синтез хлората калия............................................. |
61 |
6.1.5. Синтез азида цезия.................................................................................... |
61 |
7. Литература ............................................................................................................. |
63 |
4
Введение
Данное практическое руководство предназначено для студентов бакалавриата и магистратуры, обучающихся по специальностям «Химия», «Химическая технология», «Биотехнология» и может быть использовано для проведения лабораторных работ при изучении курсов и «Неорганическая химия» и «Методы синтеза неорганических веществ», а также при проведении лабораторных работ в рамках междисциплинарного практикума.
Пособие содержит сведения по лабораторной методике получения неорганических веществ: металлов и неметаллов, оксидов, пероксидов, кислородных кислот и их солей, галогенидов и комплексных соединений. В практическом руководстве рассмотрены как теоретические основы неорганического синтеза, так и методики получения конкретных веществ.
5
1.Правила работы в лаборатории
1.1.Порядок работы в лаборатории
Работать в лаборатории разрешается только после тщательной предварительной подготовки. Учащийся обязан изучить по практическим руководствам к лабораторным работам описание опытов, которые он будет выполнять в практикуме, ознакомиться по печатным или электронным литературным источникам со свойствами изучаемых веществ, с теоретическим материалом, относящимся к текущей лабораторной работе, оформить лабораторный журнал (см. п. 1.2.), произвести все необходимые расчёты, отметить опыты, требующие от экспериментатора особого внимания и осторожности.
В данном пособии приведено описание методик ряда синтезов, требующих достаточно сложной аппаратуры. Прежде, чем приступить к выполнению эксперимента, студент должен тщательно продумать эксперимент в целом, составить краткий план последовательности проведения операций, уяснить назначение каждой части установки. Все приборы должны быть собраны компактно, целесообразно и эстетично.
Категорически запрещается приступать к выполнению работы без её предварительного обсуждения с преподавателем. Необходимые реактивы выдаются студентам только после того, как преподаватель проверит правильность и полноту оформления лабораторного журнала и проведёт обсуждение хода работы с учащимися.
Учащийся должен поддерживать своё рабочее место в полной чистоте и порядке. На рабочем столе должны находиться только те предметы, которые нужны в данное время работы.
Студентам не разрешается оставлять реактивы без присмотра на своих рабочих местах. После выполнения работы оставшиеся реактивы необходимо сдать лаборанту или преподавателю.
Сухие реактивы необходимо брать чистым шпателем или специальной ложечкой. Недопустимо использовать одну и ту же ложечку (шпатель) для насыпания разных реактивов. При наливании растворов из склянок последние следует держать таким образом, чтобы этикетка была повёрнута вверх (во избежание её загрязнения и порчи).
Крышки и пробки от сосудов с реактивами следует класть на стол поверхностью, не соприкасающейся с реактивами, таким образом, чтобы не перепутать друг с другом крышки от разных склянок (бутылей).
6
Неизрасходованные остатки реактивов ни в коем случае нельзя высыпать обратно в склянки (бутыли) или в раковину. Их следует сдать лаборанту или преподавателю.
Для приготовления водных растворов и для ополаскивания вымытой рабочей посуды следует использовать дистиллированную воду.
Все синтезированные вещества сдаются преподавателю. На бюксе (баночке, ампуле) должна быть этикетка с названием вещества, указанием его массы, температуры кипения (для жидких веществ), а также фамилия студента и дата получения препарата.
1.2. Рабочий журнал
Все наблюдения и выводы по лабораторной работе следует заносить в специально отведённый для этого рабочий журнал, отражающий всю работу студента. На обложке журнала должна быть указана фамилия и инициалы учащегося, номер группы и название предмета. Записи в журнале следует производить только ручкой, аккуратно, подробно, но лаконично.
Запись для каждой лабораторной работы должна содержать:
1.Дату выполнения работы.
2.Название лабораторной работы.
3.Последовательность проведения операций в ходе опыта (синтеза).
4.Список необходимых реактивов и оборудования.
5.Рисунок (схему) используемого прибора.
6.Уравнения всех протекающих в ходе опыта реакций.
7.Все необходимые расчёты (массы или объёмы исходных веществ, выход продукта), необходимые табличные данные (температуры кипения, плотность и т.д.).
8.Наблюдения (изменения окраски веществ, выделение и характер осадка, вид конечного продукта и т.п.).
9.Идентификация полученного продукта (измерение плотности и Ткип для жидкостей, Тпл для твёрдых веществ, качественные реакции и т.п.).
10.Ответы на поставленные в руководстве или преподавателем вопросы. 11.Выводы.
Все разделы, кроме пп. № 7-11, заполняются учащимися заблаговременно при подготовке к занятиям. Расчёт выхода продукта и заполнение пп. № 7-11 производится сразу после проведения опыта.
Для рабочего журнала рекомендуется использовать общую тетрадь в клетку формата А4 и вести запись так, как показано ниже:
7
Дата: 14.10. 2000 г.
Лабораторная работа № 3. Получение безводной азотной кислоты.
Порядок выполнения работы:
1.Собрать прибор.
2.Взвесить 50 г нитрата натрия на технических весах.
3.Поместить нитрат натрия в реторту.
4.Прилить 100 мл 98% го раствора серной кислоты.
5.Осторожно нагреть реторту с помощью горелки.
6.Отогнать азотную кислоту в охлаждаемую водой со льдом колбу приёмник. Отгонку вести до исчезновения в реторте оксидов азота.
7.Измерить плотность азотной кислоты ареометром и определить по таблице её концентрацию.
8.Собрать прибор для перегонки в вакууме. Проверить герметичность соединений.
9.Полученную дымящую азотную кислоту осторожно перенести в колбу (перегонный куб).
10.Колбу с азотной кислотой охладить льдом и осторожно внести в нее 100 мл 98% й серной кислоты, предварительно охлажденной до той же температуры.
11.Продуть установку сухим аргоном (или азотом) в течение 10 15 мин, подавая его через капилляр.
12.Подключить прибор через осушительную систему и предохранительную склянку к водоструйному насосу.
13.Включить водоструйный насос, оставив слабый ток аргона (или азота) через капилляр.
14.Нагреть колбу с реакционной смесью на водяной бане.
15.Собрать фракцию, кипящую при 30 40 оС.
Список необходимых реактивов: нитрат натрия (хч), серная кислота 98% (ч), оксид фосфора (V) (для осушительных склянок и хлоркальциевой трубки).
Список необходимого оборудования: электроплитка, газовая горелка с баллоном, водяная баня, термометр (0-100 оС, шлиф 14/23), реторта 250-500 мл, колба круглодонная 250 мл (29/32), насадка Кляйзена (29/32, 14/23, 14/23), холодильник прямой (14/23, 14/23), аллонж с отводом (14/23, 14/23), колба-приёмник 100 мл (14/23) (4 шт.), аллонж «паук» (14/23, 14/23), капилляр со шлифом 14/23, зажим, ареометр (1480-1540 кг/м3), осушительные склянки (или склянки Дрекселя) (4 шт), хлоркальциевая трубка, камера с аргоном (азотом), водоструйный насос, ртутный манометр.
8
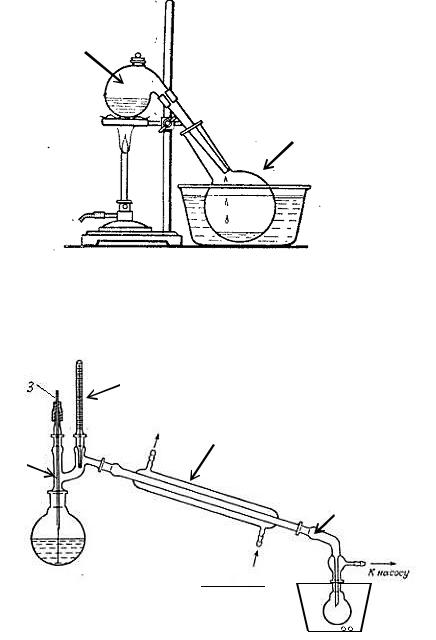
Схемы приборов:
а) прибор для получения азотной кислоты
1
2
 3
3
1 – реторта, 2 – колба-приёмник, 3 – баня с ледяной водой
б) прибор для перегонки азотной кислоты в вакууме
3 4
4
5
2
6
 1
1
 7 8
7 8


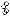



1 – круглодонная колба, 2 – насадка Кляйзена, 3 – капилляр, 4 – термометр, 5 – холодильник Либиха, 6 – аллонж, 7 - колба-приёмник, 8 – баня со льдом.
Уравнения реакций:
NaNO3 (т) + H2SO4 (конц.) = NaHSO4 + HNO3
Расчёт выхода продукта реакции: Теоретический выход: …
Плотность азотной кислоты: … Объём кислоты: … Масса кислоты (практическая): … Практический выход: …
Наблюдения:
9
При нагревании реакционной смеси в реторте наблюдается выделение бурого газа, постепенно исчезающего по мере прохождения через холодильник. В колбе-приёмнике конденсируется слегка желтоватая жидкость.
Идентификация полученного продукта:
Плотность азотной кислоты: … Массовая доля кислоты (согласно таблице): … Качественные реакции (проверка отсутствия примеси серной кислоты): …. Ответы на вопросы: … Выводы: ….
1.3.Меры предосторожности при работе в лаборатории
1.В химической лаборатории учащиеся должны работать в халате. При отсутствии халата студент не допускается к выполнению лабораторной работы.
Снекоторыми особенно опасными и едкими веществами (бром, твёрдые щёлочи и т.п.) необходимо работать в перчатках и защитных очках.
2.В лаборатории категорически запрещается принимать пищу и употреблять какие-либо напитки.
3.Все опыты с ядовитыми, неприятно пахнущими веществами, а также упаривание кислотных и щелочных растворов следует проводить только в вытяжном шкафу.
4.Работы с легковоспламеняющимися жидкостями (эфир, бензол и т.п.) должны проводиться в вытяжных шкафах вдали от источников огня. Категорически запрещается нагревать или перегонять такие жидкости с использованием горелки или спиртовки.
5.При работе со щелочными металлами следует избегать наличия воды на рабочем месте. Обрезки щелочных металлов следует сдавать лаборанту или преподавателю. Категорически запрещается бросать их в раковину или баки для мусора.
6.При нагревании растворов в открытых сосудах (пробирках и т.п.) всегда следует держать их таким образом, чтобы отверстие (горло) сосуда было направлено в сторону от себя и других работающих в лаборатории людей. Особенно важно соблюдать это правило при нагревании концентрированных растворов кислот или щелочей. Такие опыты рекомендуется проводить в вытяжном шкафу.
7.Ни в коем случае нельзя наклонять лицо над нагреваемой жидкостью или сплавляемыми веществами во избежание попадания на него брызг.
8.Не следует вдыхать пахучие вещества, в том числе выделяющиеся газы, близко наклоняясь к сосуду с этими веществами; нужно лёгким движением руки направить струю воздуха от отверстия сосуда к себе и осторожно понюхать.
10
9.При работе с твёрдыми щелочами (измельчение крупных кусков, наполнение щёлочью осушительных колонок, растирание смесей в ступке и т.д.) необходимо обязательно надевать защитные очки. Брать щёлочь разрешается только щипцами, пинцетом или шпателем (ложечкой). Необходимо тщательно убирать остатки щёлочи с рабочего места. Такие же серы предосторожности следует соблюдать при работе с оксидом фосфора(V).
10.При разбавлении концентрированных кислот (особенно серной) следует вливать кислоту в воду, а не наоборот.
11.Работу со ртутью можно производить только на специальных подносах с высокими бортами.
12.Остатки соединений ртути, мышьяка и других высокотоксичных веществ, а также остатки соединений редких и ценных металлов следует сливать исключительно в специально предназначенные для этого сосуды.
13.Приборы, содержащие остатки красного или белого фосфора, перед мытьём выдержать в ванне, наполненной раствором сульфата меди.
14.Категорически запрещается выполнять опыты, не предусмотренные в текущей лабораторной работе.
1.4.Оказание первой помощи в лаборатории
1.При попадании на кожу (рук, лица и т.д.) концентрированных кислот следует немедленно промыть поражённую поверхность сильной струёй воды в течении 3-5 минут, после чего промыть 5%-м раствором соды и ещё раз водой.
Вслучае возникновения химического ожога наложить повязку из ваты, смоченной спиртовым раствором таннина или 3%-м раствором перманганата калия. При сильных ожогах после оказания первой помощи следует немедленно обратиться к врачу.
2.При попадании на кожу раствора фтористоводородной кислоты необходимо промыть обожжённый участок проточной водой, а затем наложить повязку из ваты, смоченной 10%-м раствором хлорида кальция или насыщенным раствором сульфата магния).
3.При ожогах кожи растворами щелочей поражённый участок необходимо промывать проточной водой до тех пор, пока кожа не перестанет быть скользкой на ощупь. Дополнительно кожу можно промыть 3%-ным раствором уксусной или лимонной кислоты и ещё раз водой. При возникновении химического ожога наложить повязку из ваты, смоченной спиртовым раствором таннина или 3%-м раствором перманганата калия.
11
4.При попадании брызг кислоты или щёлочи в глаза немедленно промыть повреждённый глаз большим количеством воды комнатной температуры, после чего незамедлительно обратиться к врачу.
5.При термическом ожоге кожи (горячими предметами или пламенем) необходимо немедленно убрать поражающий фактор и охладить поражённое место (при ожогах 1-2 степени холодной проточной водой или льдом в течение 10-15 минут, при ожогах 3-4 степени наложить влажную повязку), после чего обработать поражённые участки специальными противоожоговыми средствами (спреем, гелем или мазью). После оказания первой помощи при сильных ожогах (3-4 степени) и/или большой площади поражения необходимо безотлагательно вызвать скорую помощь.
6.При ожогах фосфором необходимо наложить на обожжённое место повязку, смоченную 2%-м раствором сульфата меди, после чего обратиться к врачу.
7.При отравлении токсичными газами (хлором, парами брома, сероводородом, угарным газом и т.п.) необходимо вывести (вынести) пострадавшего на открытый воздух после чего незамедлительно обратиться к врачу.
8.При отравлении соединениями мышьяка или ртути, а также цианидами немедленно обратиться к врачу.
12
