
- •Часть I. Механика.
- •Механическое движение.
- •Три формы записи Второго закона Ньютона.
- •Решение основной задачи механики «в квадратурах». Роль начальных условий.
- •Третий закон Ньютона.
- •Плоское криволинейное движение.
- •Нормальное и тангенциальное ускорения. Их физический смысл.
- •Закон сохранения импульса.
- •Центр масс. Теорема о движении центра масс.
- •Элементарная работа. Работа произвольной силы при произвольном перемещении.
- •Кинетическая энергия абсолютно твердого тела.
- •Часть II. Термодинамика и статистическая физика.
- •Термодинамические параметры. Уравнение состояния термодинамической системы.
- •Модель идеального газа. Уравнение состояния Менделеева-Клайперона.
- •Модель газа Ван-дер-Ваальса.
- •Гипотеза о молекулярном хаосе. Средняя энергия частиц ансамбля. Модуль средней скорости.
- •Первое начало термодинамики.
- •Тепловые машины: замкнутый и незамкнутый циклы.
- •Цикл Карно.
- •Идеальная тепловая машина Карно, ее кпд.
- •Обратимые и необратимые термодинамические процессы.
- •Термодинамические формулировки Второго начала термодинамики.
- •Физический смысл понятия энтропии. Закон возрастания энтропии.
- •Равенство и неравенство Клаузиуса.
- •Теорема Нернста.
- •Вероятность дискретного события. Условие нормировки.
- •Непрерывные события. Функция распределения.
- •Нормировка функции распределения. Вычисление средних статистических величин.
- •Распределение Максвелла по скоростям. Нормировка.
- •Распределение Максвелла по модулям скоростей.
- •График распределения Максвелла по модулям скоростей и его особенности.
- •Распределение Больцмана. Барометрическое распределение.
- •Распределение Максвелла-Больцмана.
- •Формулировка Больцмана для энтропии.
- •Представление о кинетическом уравнении.
- •Линейная флуктуация и входящие в ее определенные величины.
- •Квадратичные флуктуации.
- •Кинетическое уравнение в приближении Блоха. Время релаксации.
- •Среднее время свободного пробега и средняя длина свободного пробега.
Модель газа Ван-дер-Ваальса.
В отличие
от идеального газа, модель Ван-дер-Ваальса
лучше соответствует реальным газам.
Она учитывает рассеяние частиц друг на
друге (то есть молекулярные силы) или
внутреннее давление
 ,
а также собственный объем моля частиц
,
а также собственный объем моля частиц
 . Внутреннее давление можно выразить
формулой
. Внутреннее давление можно выразить
формулой
 ,
где
,
где
 – константа для данного газа. Если газ
содержит
– константа для данного газа. Если газ
содержит
 молей, то уравнение состояния
Ван-дер-Ваальса имеет вид:
молей, то уравнение состояния
Ван-дер-Ваальса имеет вид:
 .
Поправки к уравнению идеального газа
должны быть много меньше параметров
.
Поправки к уравнению идеального газа
должны быть много меньше параметров
 .
Указанные примеры относятся к однородным
системам, в которых нет переноса массы,
импульса и энергии (отсутствие потоков
массы, импульса и энергии является
условием термодинамического
равновесия). Термодинамическое
равновесие – очень интересное состояние
системы. Не надо думать, что там нет
потоков энергии, импульса и вещества.
Потоки есть, но они одинаковы по всем
направлениям, то есть компенсируют
друга. Это динамическое равновесие.
.
Указанные примеры относятся к однородным
системам, в которых нет переноса массы,
импульса и энергии (отсутствие потоков
массы, импульса и энергии является
условием термодинамического
равновесия). Термодинамическое
равновесие – очень интересное состояние
системы. Не надо думать, что там нет
потоков энергии, импульса и вещества.
Потоки есть, но они одинаковы по всем
направлениям, то есть компенсируют
друга. Это динамическое равновесие.
Гипотеза о молекулярном хаосе. Средняя энергия частиц ансамбля. Модуль средней скорости.
Средняя
энергия частиц ансамбля. Модуль средней
скорости. Возникновение динамического
равновесия является следствием очень
давней гипотезы о молекулярном хаосе,
согласно которой все направления в
пространстве равноправны для
термодинамической системы (система
изотропна). Отталкиваясь от идеи
молекулярного хаоса после небольших
преобразований можно получить важное
соотношение, связывающее температуру
ансамбля со средней энергией, приходящейся
на одну частицу (атом или материальную
точку; для молекул картина несколько
сложнее):
 .
Указанное равенство считается определением
термодинамической или абсолютной
температуры. Из него следует возможность
определения средней скорости частиц:
.
Указанное равенство считается определением
термодинамической или абсолютной
температуры. Из него следует возможность
определения средней скорости частиц:
 ,
,
 .
Вектор средней скорости, по гипотезе о
молекулярном хаосе, равен нулю. В
статистической физике средние значения
энергии и скорости получают без гипотезы
о молекулярном хаосе на основе
статистических распределений. Если
термодинамическое равновесие нарушено
и в ансамбле возникли потоки, то говорят,
что возникают процессы переноса вещества
(диффузия), энергии (теплоперенос,
теплопроводность), импульса (внутреннее
трение или вязкость). Возможны и другие
процессы переноса, в частности,
возникновение электрического тока.
.
Вектор средней скорости, по гипотезе о
молекулярном хаосе, равен нулю. В
статистической физике средние значения
энергии и скорости получают без гипотезы
о молекулярном хаосе на основе
статистических распределений. Если
термодинамическое равновесие нарушено
и в ансамбле возникли потоки, то говорят,
что возникают процессы переноса вещества
(диффузия), энергии (теплоперенос,
теплопроводность), импульса (внутреннее
трение или вязкость). Возможны и другие
процессы переноса, в частности,
возникновение электрического тока.
Первое начало термодинамики.
Термодинамика
построена на базе нескольких постулатов,
которые называются началами. Первое
начало – это закон сохранения энергии,
учитывающий передачу системе энергии
в виде тепла
 или
или
 ,
изменение внутренней энергии –
кинетической энергии скрытого движения
частиц ансамбля
,
изменение внутренней энергии –
кинетической энергии скрытого движения
частиц ансамбля
 ,
и совершаемой системой работы
,
и совершаемой системой работы
 :
:
 ,
или, что точнее,
,
или, что точнее,
 .
Этим формам часто придают несколько
иной вид. Учтем, что
.
Этим формам часто придают несколько
иной вид. Учтем, что
 .
Тогда первое начало можно записать как
.
Тогда первое начало можно записать как
 .
Если система представляет собой идеальный
одноатомный газ и средняя энергия одной
частицы равна
,
то полная внутренняя энергия равна
.
Если система представляет собой идеальный
одноатомный газ и средняя энергия одной
частицы равна
,
то полная внутренняя энергия равна
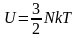 .
Изменение внутренней энергии можно
получить, продифференцировав
.
Изменение внутренней энергии можно
получить, продифференцировав
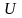 по
температуре (число частиц считается
постоянным):
по
температуре (число частиц считается
постоянным):
 ,
,
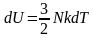 .
.
