
- •Вопрос 1. Кинематика материальной точки. Система отсчета. Перемещение, траектория, путь. Скорость. Ускорение. Нормальная и тангенциальная составляющие ускорения.
- •Модели твердого тела :
- •Материальная точка (мт).
- •Абсолютнотвердое тело (атт).
- •Модели движения твердого тела:
- •1)Координата (линейная, угловая).
- •4) Линейная скорость:
- •5.2) Средняя
- •Нормальная и тангенциальная составляющие ускорения.
- •Вопрос 30.Число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр молекул.
- •Вопрос 31. Явление переноса:диффузия, вязкость, теплопроводность.
- •Вопрос 32.Макроскопческие процессы(хаотические и упорядоченные).Термодинамические процессы(обратимые и необратимые).
- •Вопрос 33. Энтропия, ее свойства. Расчет изменения энтропии у идеального газа.
- •1)По Больцману
- •Вопрос 34.Второе начало термодинамики(формулировки) и его смысл.
- •Физический смысл второго начала термодинамики:
- •Вопрос 35.Тепловая машина: принцип действия, энергетическая схема работы кпд
- •Вопрос 36. Цикл Карно.Кпд идеальной машины, работающей по циклу Карно; сопоставление с кпд реальной тепловой машины.
- •Вопрос 37.Фазы и фазовые переходы. Фазы и фазовые переходы. Диаграмма состояний. Тройная точка. Критическая точка. Условия равновесия фаз. Уравнение Клайперона-Клаузиуса. Метастабильные состояния.
- •Вопрос 38. Закон Кулона. Электрический заряд и напряженность электрического поля.
- •Идеи Фарадея
- •Вопрос 39. Принцип суперпозиции. Электрический диполь.
- •Вопрос 40. Поток вектора напряженности электрического поля. Примеры применения теоремы Остроградского-Гаусса.
- •Вопрос 41. Работа электростатического поля. Потенциал. Связь потенциала с напряженностью поля. Циркуляция электростатического поля.
- •Вопрос 42. Равновесие зарядов на проводнике. Поверхностные заряды. Примеры поля вблизи проводника. Проводник во внешнем электрическом поле.
- •Вопрос 43. Электроемкость уединенного проводника. Типы конденсаторов, их электроемкость и другие характеристики.
- •Вопрос 44. Энергия конденсаторов. Плотность энергии электрического поля.
- •Вопрос 45. Постоянный электрический ток. Условия существования тока. Проводники и изоляторы. Закон Ома для однородного участка цепи. Сторонние силы. Эдс.
- •Вопрос 46. Последовательное и параллельное соединение проводников.Последовательное соединение проводников
- •П араллельное соединение проводников
- •Вопрос 47. Закон Джоуля-Ленца (интегральная и дифференциальная формы записи).
- •Вопрос 48. Закон Ома для полной цепи. Закон Ома для неоднородного участка цепи.
- •Вопрос 49. Правило Кирхгофа
- •1 Правило(для узлов)
- •2 Правило(для замкнутого контура)
- •Вопрос 50. Индукция магнитного поля. Закон Био-Савара-Лапласа. Принцип суперпозиции магнитных полей.
- •Вопрос 51. Применение закона Био-Савара-Лапласа в случае бесконечно прямого проводника с током.
- •Вопрос 52. Сила Лоренца. Движение заряженных частиц в электрическом и магнитных полях. Сила Ампера.
- •Сила Лоренца.
- •2. Сила Ампера.
- •Вопрос 53. Основные уравнения магнитостатики.
- •Основные уравнения
- •Основные уравнения, используемые в магнитостатике
- •Вопрос 54.Явление электромагнитной индукции. Явление самоиндукции.
- •Правило Ленца
- •Явление самоиндукции
- •Эдс взаимной индукции
- •Вопрос 55. Энергия магнитного поля. Плотность энергии магнитного поля.
- •Плотность энергии магнитного поля:
Вопрос 32.Макроскопческие процессы(хаотические и упорядоченные).Термодинамические процессы(обратимые и необратимые).
Порядок и беспорядок в природе. Макроскопические процессы
1)Хаотические макроскопические процессы-процессы, приводящие к хаотическому(беспорядоченному) размещению объектов.
Особенности хаотических макр. процессов:
1)Для их описания используются статистические представления
2)Хаотические макр. процессы имеют направленность к наиболее вероятному состоянию.
3)Возврат в предшествующие состояния, для большинства систем, практически нереализуем.
2)Упорядоченные макроскопические процессы-процессы, приводящие к строго структурированному, взаимообусловленному размещению объектов.
Биологические процессы- по своей сути упорядоченные процессы.
Термодинамические процессы
1)Обратимые термодинамические процессы- идеальный процесс в термодинамической системе, допускающий возврат системы в исходное состояние, с воспроизведением состояний, в которых была система.
Особенности обратимых термодинамических процессов:
1)Эти процессы присущи консервативным системам
2)Эти процессы являются квази-статическими (близровновесными): они выражают равновесные переходы системы, из одного состояния, в другие.
2)Необратимые хаотические процессы-реальный, самопроизвольный процесс термодинамической системы.
Для описания степени беспорядка в системе используется понятие ЭНТРОПИИ.
Вопрос 33. Энтропия, ее свойства. Расчет изменения энтропии у идеального газа.
Энтропия(S)-функция состояния системы, которая выражает степень беспорядка в ней.
При возврате системы в исходное состояние: ∆S=0
Энтропию можно выразить несколькими способами:
1)По Больцману

k-постоянная Больцмана.
W-термодинамическая вероятность реализации состояния системы.
Е

I
II

W(1)
W= W(1)*W(2)
W(2)
сли система состоит из двух независимых систем

S=S(1)+S(2)
Энтропия системы- сумма отдельных независимых подсистем.
2)По Клазиусу(расчет энтропии у ИДЕАЛЬНОГО газа)
 ,
,
где
 —приращение
энтропии;
—приращение
энтропии;
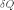 —минимальная
теплота, подведенная к системе;
—минимальная
теплота, подведенная к системе;
T — абсолютная температура процесса;




Это уравнение применимо к любому уравнению идеального газа.
Свойства энтропий:
1) энтропия – величина аддитивная, т.е. энтропия системы равна сумме энтропий отдельных элементов.
2) если в изолированной системе происходит обратимые процессы, то её энтропия остаётся неизменной.
3) если в изолированной системе происходит необратимые процессы, то её энтропия возрастает.
4) энтропия изолированной системы не может уменьшаться.
Возрастать энтропия может по двум причинам:
1)вследствие необратимого процесса перехода системы в равновесное (более вероятное) состояние;
2)вследствие сообщения системе определенного количества теплоты.
Вопрос 34.Второе начало термодинамики(формулировки) и его смысл.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Существуют несколько эквивалентных формулировок второго начала термодинамики:
1 )по
Кельвину: невозможен
круговой процесс, единственным результатом
которого является превращение теплоты,
полученной от нагревателя, в эквивалентную
ей работу;
2)
по Клаузиусу: невозможен
круговой процесс, единственным результатом
которого является передача теплоты
от менее нагретого тела к более нагретому.
)по
Кельвину: невозможен
круговой процесс, единственным результатом
которого является превращение теплоты,
полученной от нагревателя, в эквивалентную
ей работу;
2)
по Клаузиусу: невозможен
круговой процесс, единственным результатом
которого является передача теплоты
от менее нагретого тела к более нагретому.

/*
Эквивалентность
этих формулировок легко показать. В
самом деле, допустим, что постулат
Клаузиуса неверен, то есть существует
процесс, единственным результатом
которого была бы передача тепла от более
холодного тела к более горячему. Тогда
возьмем два тела с различной температурой
(нагреватель и холодильник) и проведем
несколько циклов тепловой
машины, забрав тепло  у
нагревателя, отдав
у
нагревателя, отдав  холодильнику
и совершив при этом работу
холодильнику
и совершив при этом работу 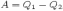 .
После этого воспользуемся процессом
Клаузиуса и вернем тепло
от
холодильника нагревателю. В результате
получается, что мы совершили работу
только за счет отъёма теплоты от
нагревателя, то есть постулат Томсона
тоже неверен.
.
После этого воспользуемся процессом
Клаузиуса и вернем тепло
от
холодильника нагревателю. В результате
получается, что мы совершили работу
только за счет отъёма теплоты от
нагревателя, то есть постулат Томсона
тоже неверен.
С другой стороны, предположим, что неверен постулат Томсона. Тогда можно отнять часть тепла у более холодного тела и превратить в механическую работу. Эту работу можно превратить в тепло, например, с помощью трения, нагрев более горячее тело. Значит, из неверности постулата Томсона следует неверность постулата Клаузиуса.
Таким образом, постулаты Клаузиуса и Томсона эквивалентны. */
Другая формулировка второго начала термодинамики основывается на понятии энтропии:
Второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
/* Здесь существенно, что речь идет о замкнутых системах, так как в незамкнутых системах энтропия может вести себя любым образом (убывать, возрастать, оставаться постоянной). Кроме того, отметим еще раз, что энтропия остается постоянной в замкнутой системе только при обратимых процессах. При необратимых процессах в замкнутой системе энтропия всегда возрастает. */
S
 , где k – постоянная
Больцмана, W – термодинамическая
вероятность, реализующая состояние
системы. Формула Больцмана, которая
определяет количественную связь между
энтропией S и термодинамической
вероятностью W.
, где k – постоянная
Больцмана, W – термодинамическая
вероятность, реализующая состояние
системы. Формула Больцмана, которая
определяет количественную связь между
энтропией S и термодинамической
вероятностью W.
Smax

t

Учитывая то, что в системе возможно локальное понижение энтропии с опорой на молекулярно-статистические представления, формулировка второго начала термодинамики принимает уточненный вид:

S
В замкнутой и адиобатически изолированной системе наиболее вероятным возможен процесс, сопровождающийся возрастанием энтропии.


Флуктация(отклонения)
t
