
- •1)Суть закона эквивалента: одним эквивалентом любого элемента соединяется один эквивалент другого элемента.
- •Закон эквивалентов:
- •2) Закон Авогадро. Открыт в 1811 г. Итальянским физиком а.Авогадро. В равных объемах различных газов при одинаковых давлении и температуре содержится одинаковое число молекул.
- •3) Теплота (тепловой эффект) реакции - это количество тепловой энергии, выделившееся или поглощенное системой в результате протекающих в ней химических превращений.
- •6) Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени. Различают среднюю скорость
- •7) Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени.
- •8) Катализаторами называют вещества, ускоряющие химические реакции и остающиеся после реакций химически неизменными. Физическое состояние катализатора может изменяться.
- •Гетерогенный катализ.
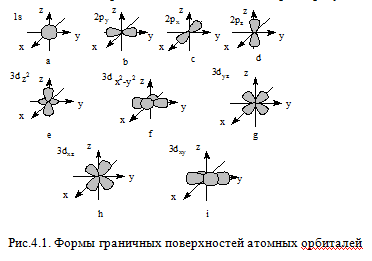
- •Состояние электрона в атоме полностью характеризуется с помощью четырех квантовых чисел n, l, ml.
- •Проявления в природе:
Состояние электрона в атоме полностью характеризуется с помощью четырех квантовых чисел n, l, ml.
11) Периодический закон Д. И. Менделеева — фундаментальный закон, устанавливающий периодическое изменение свойств химических элементов в зависимости от увеличения зарядов ядер их атомов. Открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс. Термин «периодический закон» Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». Графическим (табличным) выражением периодического закона является разработанная Менделеевым периодическая система элементов.
При последовательном увеличении заряда ядра периодически повторяется как количество электронов, находящихся на внешнем уровне, так и симметрия их облаков. Свойства химических элементов определяются строением электронных оболочек их атомов и прежде всего электронами, находящимися на внешнем уровне, которые выступают в роли валентных электронов, т.е электронов, ответственных за химические связи, образуемые данным атомом как с такими же, так и с другими атомами. Валентные электроны определяют все химическое поведение элемента. Поэтому с возрастанием атомного номера (заряда ядра) свойства химических элементов также изменяются периодически. Таким образом, именно периодическое появление аналогичных электронных конфигураций является физической причиной периодичности, составляющей сущность периодического закона, открытого Д.И. Менделеевым в 1869 г.
Структура периодической системы. Известно несколько сот вариантов представления ПС. Наиболее распространенными являются короткопериодный (восьмиклеточный) и длиннопериодный ( восемнадцатиклеточный) варианты.
Периодическая система состоит из семи периодов и восьми групп. Периоды начинаются s-элементом, имеющим электронную структуру ns1 и заканчиваются p-элементом с электронной структурой ns2np6, где n не только главное квантовое число, но и номер периода. Исключением является первый период, который заканчивается элементом с электронной структурой 1s2. Периоды подразделяются на три малых и четыре больших периода. Первый период содержит 2 элемента, второй и третий по 8 элементов. Четвертый и пятый периоды содержат по 18 элементов, шестой – 32. Последний, седьмой период не завершен. Малые периоды состоят из s- и р-элементов, четвертый и пятый большие периоды включают в себя также d-элементы, а шестой и седьмой периоды содержат s-, p-, d- и f-элементы.
Группы делятся на главные и побочные подгруппы, обозначаемые буквами А и В. Подгруппы содержат элементы с аналогичными электронными структурами внешнего уровня, а в случае d-элементов – на внешнем s и заполняющемся d-подуровне. Главные подгруппы начинаются с элементов первого и второго периодов. Главные подгруппы первой и второй групп состоят из s-элементов, а от третьей до восьмой – из р-элементов. Побочные подгруппы состоят из d-элементов за исключением IIIB-подгруппы, которая содержит также f-элементы. В короткопериодном варианте ПС f-элементы (лантаниды и актиниды) вынесены из III группы побочной подгруппы шестого и седьмого периодов и помещены отдельно.
Периодичность изменения свойств элементов. Периодическое изменение свойств элементов в периоде объясняется последовательностью заполнения электронами уровней и подуровней в атомах при увеличении порядкового номера элемента и заряда ядра атома.
Так как электронные конфигурации атомов элементов изменяются периодически, то соответственно периодически изменяются и свойства элементов, которые определяются их электронным строением: размерами атомов, энергетическими характеристиками, окислительно-восстановительнымим свойствами.
Главным химическим свойством атомов элементов является их окислительная или восстановительная способность, которая определяется положением элемента в ПСЭ. В периодах от начала к концу ослабляется восстановительная активность атомов и возрастает окислительная, т. е. наблюдается переход от атомов с типичными свойствами металлов к атомам с типичными свойствами неметаллов, электроотрицательность атомов при этом возрастает. В пределах группы элементов (главной подгруппы) с ростом заряда ядра атомов увеличивается количество энергетических уровней атомов. Таким образом, восстановительная активность атомов по группам сверху вниз возрастает, а окислительная – снижается, уменьшается и величина ЭО атомов. Самые сильные окислители (неметаллы) находятся в правом верхнем углу ПСЭ: F, Cl, O. Самые сильные восстановители (металлы) находятся в левом нижнем углу: Fr, Ba, Ra.
12) Заполнение электронами энергетических уровней и подуровней происходит в соответствии со следующими принципами (правилами):
1. Принцип исключения Паули (запрет Паули)
2. Принцип наименьшей энергии
3. Правило Клечковского
4. Правило Гунда
Запрет Паули: в атоме не может быть двух электронов, имеющих одинаковый набор всех четырех квантовых чисел. Принцип Паули означает, что на орбитали может находиться не более двух электронов. На s-подуровне (1 орбиталь) может находиться 2 электрона, на p-подуровне (3 орбитали) – 6 электронов, на d-подуровне (5 орбиталей) – 10 электронов, на f-подуровне (7 орбиталей) – 14 электронов. Максимальное число электронов на энергетическом уровне составляет 2n2, где n – главное квантовое число.
Принцип наименьшей энергии: электроны в первую очередь заполняют свободные орбитали с наименьшей энергией.
Атомные орбитали располагаются в порядке увеличения их энергии следующим образом: 1s2 <2s2 <2p6<3s2<3p6<4s2<3d104p6<5s2<4d10<5p6<6s2<4f14<5d10<6p6<7s2<5f14<6d10.
В многоэлектронных атомах энергия орбиталей определяется не только взаимодействием электронов с ядром, но и взаимодействием электронов между собой. Это проводит к появлению ряда нарушений вышеприведенной последовательности у отдельных d и f-элементов. Явление носит название провал электрона; проявляется в заполнении орбиталей с более высокой энергией при наличии незаполненных орбиталей с более низкой энергией.
Правило Клечковского: Заполнение орбиталей происходит в порядке увеличения суммы квантовых чисел n+l; при постоянной сумме n+l заполнение происходит в порядке возрастания n. Применение правила Клечковского дает последовательность возрастания энергии орбиталей.
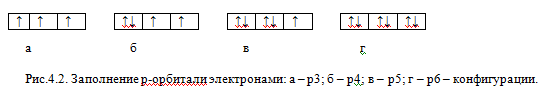
Правило Гунда: Электроны заполняют орбитали вначале в виде холостых с одинаковыми спинами, а затем в виде спаренных.
Рассмотрим заполнение трех орбиталей р-подуровня. Орбиталь принято обозначать графически в виде квадратиков или прямоугольников, называемых квантовыми ячейками, а электроны обозначают стрелками, направление которых связывают со спином. Первые три электрона заполнят три р-орбитали по-одному (холостые электроны) и с одинаковыми спинами (параллельные электроны) (рис.4.2,а). Последующие электроны будут заполнять эти же орбитали, но будут иметь противоположные спины (рис.4.2, б-г). Два электрона с противоположными спинами, занимающие одну орбиталь, называют спаренными, антипараллельными электронами. Неполностью заполненный подуровень или уровень называют ненасыщенным, а полностью заполненный – насыщенным.
13) Ковалентная связь (атомная связь) — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость — определяют химические и физические свойства соединений.
Направленность связи обусловливает молекулярное строение веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер.
Метод валентных связей (ВС)
Правило октета Льюиса. В 1916 г. английский ученый Д.Льюис предположил, что химическая связь образуется в результате обобществления электронов, принадлежащих до образования связи разным атомам. Согласно правилу октета Льюиса внешняя электронная оболочка каждого из атомов, образующих химическую связь, должна иметь электронную конфигурацию благородного газа (за исключением гелия), т.е. атом должен иметь во внешней оболочке восемь электронов.
В зависимости от числа обобществленных электронных пар связь может быть одинарной, двойной или тройной:
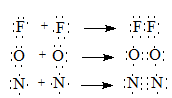
В формулах Льюиса химическая связь изображают парой точек, соответствующих двум электронам. Чаще химическую связь изображают черточками: Br−Br, O=O, N≡N.
Разработанная на этой основе теория химической связи получила название метода валентных связей (метод ВС). В основе метода ВС лежат следующие положения:
1) Ковалентная связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам.
2) Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака.
Комбинации двухэлектронных двухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем.
14) В молекулах положительные заряды ядер скомпенсированы отрицательными зарядами электронов. Однако положительные и отрицательные заряды могут быть пространственно разделены. Предположим, что молекула состоит из атомов разных элементов (СО2 и SO2 и т. д.). В этом случае электроны смещены к атому с большей электроотрицательностью и центры тяжести положительных и отрицательных зарядов не совпадают, образуется электрический диполь — система из двух равных по величине и противоположных по знаку зарядов q, находящихся на расстоянии l, называемом длиной диполя. Длина диполя — векторная величина. Ее направление условно принято от отрицательного заряда к положительному. Такие молекулы называют полярными молекулами или диполями.
Полярность молекулы тем больше, чем больше абсолютная величина заряда и длина диполя. Мерой полярности служит произведение q . l, называемое электрическим моментом диполя μ: μ = q . l.
Единицей измерения μ служит Дебай (Д). 1 Д = 3,3 . 10 -30 Кл . м.
В молекулах, состоящих из двух одинаковых атомов μ = 0. Их называют неполярными. Если такая частица попадает в электрическое поле, то в ней под действием поля произойдет поляризация — смещение центров тяжести положительных и отрицательных зарядов. В частице возникает электрический момент диполя, называемый наведенным диполем.
Дипольный момент двухатомной молекулы АВ можно отождествить с дипольным моментом связи А—В в ней. Если общая электронная пара смещена к одному из атомов, то электрический момент диполя связи не равен нулю. Связь в этом случае называется полярной ковалентной связью. Если электронная пара симметрично расположена относительно атомов, то связь называется неполярной.
В многоатомной молекуле определенный электрический момент диполя можно приписать каждой связи. Тогда электрический момент диполя молекулы может быть представлен как векторная сумма электрических моментов диполя отдельных связей. Существование или отсутствие момента диполя у молекулы связано с ее симметрией. Молекулы, имеющие симметричное строение, неполярны (μ = 0). К ним относятся двухатомные молекулы с одинаковыми атомами (Н2, С12 и др.), молекула бензола, молекулы с полярными связями BF3, A1F3, CO2, ВеС12 и др.
Электрический момент диполя молекулы является важным молекулярным параметром. Знание величины μ может указать на геометрическую структуру молекулы. Например, молекула СО2 неполярна, а молекула SO2 обладает электрическим моментом диполя. Отсюда следует, что молекула СО2 имеет линейное строение, а молекула SO2 – угловое.
15) Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %.
Рассмотрим способ образования на примере хлорида натрия NaCl.
Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na ls2 2s2 2p 6 3s1; 17 Cl ls2 2p 6 Зs2 3р7 Как это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е —> Na+ ион натрия, устойчивая восьмиэлектронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е --> .Cl - ион хлора, устойчивая восьмиэлектронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы окружённые диполями растворителя.
16) Металлическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Энергия связи — энергия, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества. Энергии ковалентных и ионных связей обычно велики и составляют величины порядка 100-800 кДж/моль.
17) При образовании химической связи атом может переходить в т.н. возбужденное состояние. В этом состоянии происходит образование неспаренных электронов из спаренных. Процесс сопровождается переходом половины образовавшихся холостых электронов на вакантные орбитали того же уровня.
В соответствии с электронной структурой атома (1s22s22p1) бор может быть одновалентным (один неспаренный электрон на энергетическом 2р-подуровне). Однако для бора наиболее характерны соединения, в которых он трехвалентен (при возбуждении атома три неспаренных электрона в энергетических 2s- и 2р-подуровнях).
Свободная 2р-орбиталь в возбужденном атоме бора обусловливает акцепторные свойства многих его соединений, в которых три ковалентные связи образованы по обменному ковалентному механизму (например, ВBr3). Эти соединения склонны к присоединению частиц с электронно-донорными свойствами, т. е. к образованию еще одной ковалентной связи по донорно-акцепторному механизму.
В соединениях с неметаллами степень окисления бора +3; все эти соединения ковалентны.
Простейшее соединение бора с водородом ВН3 в обычных условиях не существует, sp2-Гибридизация электронных орбиталей в атоме бора приводит к координационной ненасыщенности частицы ВНз, вследствие чего происходит объединение двух таких частиц в молекулу диборана: 2ВНз = В2Н6 (ΔG0298 = -127 кДж/моль).
В диборане В2Н6 бор находится в состоянии 5р3-гибридизации, причем у каждого атома бора одна из четырех гибридных орбиталей пуста, а три другие перекрыты s-орбиталями атомов водорода. Связи между группами ВНз в молекуле В2Н6 образуются по типу водородной связи за счет смещения электронной плотности от одного атома водорода группы ВНз к пустой орбитали другой группы ВНз.
18) Ван-дер-ваальсовы силы — силы межмолекулярного (и межатомного) взаимодействия с энергией 10 — 20 кДж/моль. Этим термином первоначально обозначались все такие силы, в современной науке он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Открыты Я. Д. ван дер Ваальсом в 1869 году.
Ван-дер-Ваальсовы силы межатомного взаимодействия инертных газов обусловливают возможность существования агрегатных состояний инертных газов (газ, жидкость и твёрдые тела).
К ван-дер-ваальсовым силам относятся взаимодействия между диполями (постоянными и индуцированными). Название связано с тем фактом, что эти силы являются причиной поправки на внутреннее давление в уравнении состояния реального газа Ван-дер-Ваальса. Эти взаимодействия в основном определяют силы, ответственные за формирование пространственной структуры биологических макромолекул.
Ван-дер-ваальсовы силы также возникают между частицей (макроскопической частицей или наночастицей) и молекулой и между двумя частицами.
Классификация ван-дер-ваальсовых сил: Ван-дер-ваальсовое взаимодействие состоит из трех типов слабых взаимодействий:
Ориентационные силы, диполь-дипольное притяжение. Осуществляется между молекулами, являющимися постоянными диполями. Примером может служить HCl в жидком и твердом состоянии. Энергия такого взаимодействия обратно пропорциональна кубу расстояния между диполями.
Дисперсионное притяжение (лондоновские силы). Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным). Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
До сих пор многие авторы исходят из предположения, что ван-дер-ваальсовые силы определяют межслоевое взаимодействие в слоистых кристаллах, что противоречит экспериментальным данным: масштабу анизотропии температуры Дебая и, соответственно, масштабу анизотропии решёточного отражения. Исходя из данного ошибочного[4] предположения построены многие двумерные модели, «описывающие» свойства, в частности графита и нитрида бора.
