
- •1)Суть закона эквивалента: одним эквивалентом любого элемента соединяется один эквивалент другого элемента.
- •Закон эквивалентов:
- •2) Закон Авогадро. Открыт в 1811 г. Итальянским физиком а.Авогадро. В равных объемах различных газов при одинаковых давлении и температуре содержится одинаковое число молекул.
- •3) Теплота (тепловой эффект) реакции - это количество тепловой энергии, выделившееся или поглощенное системой в результате протекающих в ней химических превращений.
- •6) Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени. Различают среднюю скорость
- •7) Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени.
- •8) Катализаторами называют вещества, ускоряющие химические реакции и остающиеся после реакций химически неизменными. Физическое состояние катализатора может изменяться.
- •Гетерогенный катализ.
- •Состояние электрона в атоме полностью характеризуется с помощью четырех квантовых чисел n, l, ml.
- •Проявления в природе:
Гетерогенный катализ.
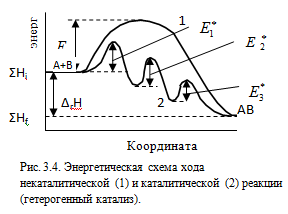
Исходной стадией гетерогенного катализа является адсорбция реагентов, т.е. связывание молекул реагирующих веществ с поверхностью другого вещества. Процесс адсорбции происходит в несколько стадий. Благодаря диффузии, молекулы реагирующих веществ подходят к поверхности, где происходит их адсорбция. Взаимодействие адсорбированных частиц реагентов с поверхностью катализатора ведет к увеличению их энергии. Процесс называется активированной адсорбцией, который протекает не на всей поверхности катализатора, а только на активных центрах (различные дефекты поверхности). Число активных центров определяет активность катализатора и зависит от способа приготовления катализатора и величины его поверхности. В результате активированной адсорбции изменяется электронная структура молекул реагентов, что ведет к снижению энергии активации и на поверхности катализатора протекает химическая реакция. Продукт химической реакции покидает поверхность катализатора, т.е. происходит десорбция и за счет диффузии переходит в окружающую среду.
Все три стадии – адсорбция, образование активированного комплекса и десорбция являются активационными процессами и характеризуются собственными энергиями активации. Скорость каталитической реакции возрастает, если энергии активации каждой из этих стадий будет ниже энергии активации соответствующей некаталитической реакции.
9) Многие химические реакции протекают в одном направлении до полного исчерпания реагирующих веществ. Такие реакции называются химически необратимыми. Другие реакции протекают вначале в прямом направлении, а затем в прямом и обратном благодаря взаимодействию продуктов реакции. В результате образуется смесь, содержащая одновременно исходные вещества и продукты реакции. Такие реакции называют химически обратимыми. В результате химически обратимого процесса наступает истинное (устойчивое) химическое равновесие, признаками которого являются:
1) в отсутствии внешних воздействий состояние системы остается неизменным неограниченно долго;
2) любое изменение внешних условий приводит к изменению состояния системы;
3) состояние равновесия не зависит от того, с какой стороны оно достигнуто.
Кроме истинных равновесий очень часто встречаются кажущиеся (ложные, заторможенные) равновесия, когда состояние системы сохраняется во времени очень долго, но небольшое воздействие на систему может привести к сильному изменению ее состояния.
Рассмотрим обратимую химическую реакцию между йодом и водородом
Скорости прямой и обратной реакций определяются соотношениями
Начиная с некоторого момента состав реакционной смеси перестает изменяться, что отвечает равенству скоростей прямой и обратной реакции
Это состояние реагирующей системы называется химическим равновесием. Состояние химического равновесия устойчиво и может сохраняться неограниченно долго при постоянных внешних условиях. В состоянии химического равновесия прямая и обратная реакции протекают с равными скоростями, следовательно, химическое равновесие является динамическим равновесием.
Отношение констант скоростей прямой и обратной реакций является также величиной постоянной и носит название константы химического равновесия. Величина константы химического равновесия зависит только от природы реагирующих веществ и температуры. Катализатор не влияет на величину константы химического равновесия.
Для обратимой реакции, записанной в общем виде аА + bB ↔ dD + eE константа химического равновесия, выраженная через молярные концентрации, запишется следующим образом:
через парциальные давления константа равновесия реакции будет выглядеть так:
Константа равновесия гетерогенных реакций не включает концентрации твердых веществ.
Смещение химического равновесия. Принцип Ле Шателье. Любое изменение условий химического равновесия (Т, р, с) приводит к изменению положения равновесия. Направление смещения равновесия определяется принципом Ле Шателье: Любое изменение одного из условий химического равновесия (температуры, давления, концентрации) приводит к смещению равновесия в направлении реакции, протекание которой уменьшает эффект произведенного изменения.
1) Влияние температуры. Повышение температуры смещает положение равновесия в сторону эндотермической реакции, а понижение – в сторону экзотермического процесса.
2) Влияние давления. Давление влияет на положение равновесия реакций, протекающих с участием газообразных веществ. Увеличение давления смещает положение равновесия реакции в сторону уменьшения числа моль газообразных веществ, т.е. в сторону уменьшения давления. При уменьшении давления равновесие смешается в сторону увеличения числа моль газообразных веществ, т.е. в сторону увеличения давления.
3) Влияние концентрации. Увеличение концентрации одного из реагирующих веществ смещает равновесие в сторону реакции, ведущей к его связыванию и наоборот, уменьшение концентрации вещества смещает равновесие в сторону процесса образования этого соединения.
10) До середины ХIХ века атом считался мельчайшей и неделимой частицей материи. Открытие электрона и радиоактивности доказали сложность строения атома. Электрон был открыт в 1897 г. английским ученым Дж. Дж. Томсоном; название было дано в 1891 г. англичанином Дж. Стони. Заряд и масса были определены в 1909 г. Р. Малликеном. Заряд электрона принят в настоящее время за единицу отрицательного электричества.
В 1926 г. Э.Шредингер предложил для описания движения электрона в атоме волновое уравнение, получившее название уравнения Шредингера. Решением уравнения Шредингера является волновая функция ψ, называемая также орбиталью. Волновая функция может иметь как действительные, так и мнимые решения. Поэтому, физический смысл имеет только |ψ|2 , который характеризует вероятность нахождения электрона в данном объеме пространства. Термином орбиталь обозначают также область пространства, в которой наиболее вероятно нахождение электрона. Решение уравнения Шредингера определяется набором четырех чисел, получивших название квантовых чисел.
Главное квантовое число n характеризует энергию электронной орбитали. Главное квантовое число принимает значения 1, 2, 3, 4, 5, 6, 7…∞, обозначаемые также буквами K, L, M, N , O, P, Q … Чем больше n, тем выше энергия орбитали. Переходы электронов с одной орбитали на другую сопровождается излучением или поглощением квантов энергии. (номер энергетического уровня – период)
Главное квантовое число характеризует также удаленность максимума электронной плотности от ядра. Чем больше n, тем больше объем орбитали. Совокупность электронов с одинаковым значением n называют энергетическим уровнем или оболочкой, слоем.
Орбитальное (побочное, азимутальное) квантовое число l принимает значения от 0 до (n-1) и характеризует форму граничной поверхности атомной орбитали. Обозначения: 0-s; 1-p; 2-d; 3-f и т.д. Совокупность электронов, имеющих одинаковые значения l и n, называют энергетическим подуровнем (подоболочкой). Граничная поверхность s-орбиталей имеет форму сферы (рис.4.1,а), р-орбиталей – гантели (рис.4.1,b-d). Граничные поверхности d-орбиталей показаны на рис.4.1,e-i. Форма граничных поверхностей f-орбиталей сложнее, чем d-орбиталей.
Орбитальное квантовое число характеризует также энергию электронов подуровня в пределах данного энергетического уровня.
Энергия подуровней возрастает в ряду s, p, d, f (Es<Ep<Ed<Ef).
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве и может принимать целочисленные значения от +l до –l, включая 0. d-подуровень содержит пять орбиталей, s-подуровень – одну (рис.4.1,a), p-подуровень – три (рис.4.1,b-d), а f-подуровень – семь орбиталей.
Атомной орбиталью называют также волновую функцию, характеризуемую определенным набором трех квантовых чисел
Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси и может принимать два значения - +1/2 и -1/2.
