
- •1)Суть закона эквивалента: одним эквивалентом любого элемента соединяется один эквивалент другого элемента.
- •Закон эквивалентов:
- •2) Закон Авогадро. Открыт в 1811 г. Итальянским физиком а.Авогадро. В равных объемах различных газов при одинаковых давлении и температуре содержится одинаковое число молекул.
- •3) Теплота (тепловой эффект) реакции - это количество тепловой энергии, выделившееся или поглощенное системой в результате протекающих в ней химических превращений.
- •6) Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени. Различают среднюю скорость
- •7) Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени.
- •8) Катализаторами называют вещества, ускоряющие химические реакции и остающиеся после реакций химически неизменными. Физическое состояние катализатора может изменяться.
- •Гетерогенный катализ.
- •Состояние электрона в атоме полностью характеризуется с помощью четырех квантовых чисел n, l, ml.
- •Проявления в природе:
3) Теплота (тепловой эффект) реакции - это количество тепловой энергии, выделившееся или поглощенное системой в результате протекающих в ней химических превращений.
Тепловой эффект обозначается символами Q или ΔH (Q = -ΔH). Реакции, идущие с выделением теплоты (Q > 0; ΔH < 0), относятся к экзотермическим, а с ее поглощением (Q < 0; ΔH > 0) - к эндотермическим. Химические уравнения, для которых указаны тепловые эффекты, называются термохимическими уравнениями.
Н2(г) + 1/2О2(г) = Н2О(ж),
где г – газ, ж – жидкость, r означает, что изменение энтальпии относится к химической реакции, (298) – температура системы; правый верхний индекс (о) указывает на стандартное состояние веществ, участвующих в реакции.
На теплоту образования веществ влияет их агрегатное и фазовое. Поэтому в термохимических уравнениях принято указывать это состояние (г - газ, ж - жидкость, т - твердое вещество, к - кристаллическая фаза).
В основе термохимических расчетов лежит закон постоянства количества теплоты, открытый русским химиком Г.И. Гессом в 1840 г.
Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ и не зависит от пути реакции (т.е. от числа стадий и промежуточных состояний).
Закон Гесса. Открыт в 1840 г российским ученым Г.И.Гессом. Тепловой эффект реакции, протекающей при постоянном давлении или постоянном объеме не зависит от пути протекания реакции и определяется только природой и состоянием исходных веществ и конечных продуктов.
Процессы, в которых система после ряда последовательных превращений возвращается в исходное состояние, называются круговыми процессами или термодинамическими циклами. Метод циклов используется для вычисления различных термодинамических свойств веществ.
Первое следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ. Энтальпия образования вещества В() это энтальпия реакции образования 1 моль соединения из простых веществ, устойчивых при стандартных условиях. Например. энтальпия образования нитрата натрия равна энтальпии реакцииNa(кр) + ½N2(г) + 3/2О2(г) = NaNO3(кр), Энтальпия образования простых веществ при стандартных условиях принята равной нулю. Энтальпия является свойством вещества, также как и масса, объем и т.д. Энтальпия _ функция состояния системы, т.е. ее изменение не зависит от пути процесса, а определяется только состоянием системы в конце и начале процесса.
Энтальпия химической реакции в общем виде аА + bB = dD + eE
определяется по уравнению
Второе следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
Энтальпия сгорания вещества В - это энтальпия реакции окисления кислородом 1 моль соединения до образования высших оксидов. Например энтальпия реакции сгорания метанола есть изменение энтальпии следующей реакции: СН3ОН + 3/2О2 = СО2 + 2Н2О
Энтальпия химической реакции в общем виде определяется по уравнению:
4) Состояние любой системы может быть охарактеризовано значениями непосредственно измеряемых параметров (р, Т и др.). Это характеристика макросостояния системы. Состояние системы может быть описано также характеристиками каждой частицы системы (атома, молекулы): координаты, частота колебания, частота вращения и т.д. Это характеристика микросостояния системы. Системы состоят из очень большого числа частиц, поэтому одному макросостоянию будет отвечать огромное число различных микросостояний. Это число называется термодинамической вероятностью состояния и обозначается (W).
Термодинамическая вероятность связана с другим свойством вещества – энтропией (S) – формулой Больцмана
,где R - универсальная газовая постоянная, а NA – постоянная Авогадро. Измеряется энтропия в Дж/(моль.К).
Физический смысл: энтропия является мерой неупорядоченности состояния системы. Энтропия системы увеличивается во всех процессах, когда возрастает неупорядоченность (нагревание, растворение, испарение, реакции разложения и т.п.) и уменьшается в процессах, идущих с увеличением упорядоченности (охлаждение, кристаллизация, сжатие и т.п.).
Энтропия является функцией состояния, но в отличие от большинства других термодинамических функций возможно экспериментальное определение абсолютного значения энтропии вещества. Эта возможность основана на постулате М.Планка, согласно которому «при абсолютном нуле энтропия идеального кристалла равна нулю» (третий закон термодинамики).
Температурная зависимость энтропии вещества представлена качественно на рис. 2.1
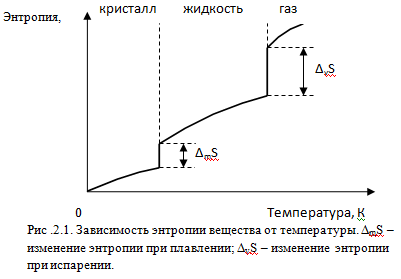
На рис.2.1 видно, что при нуле Кельвина энтропия вещества равна нулю. При повышении температуры энтропия плавно увеличивается, а в точках фазовых переходов имеет место скачкообразное увеличение энтропии, определяемое соотношением
,где Δ ф..п.S, Δф.п.Н и Тф.п. изменение энтропии, энтальпии и температура фазового перехода, соответственно.
Энтропию вещества B в стандартном состоянии обозначают . Для многих веществ абсолютные значения стандартных энтропий определены и приводятся в справочных изданиях.
Энтропия, также как внутренняя энергия и энтальпия, является функцией состояния, поэтому изменение энтропии системы в процессе не зависит от его пути и определяется только начальным и конечным состоянием системы. Изменение энтропии в ходе химической реакции может быть найдено, как разность суммы энтропий продуктов реакции и суммы энтропий исходных веществ
Понятие энтропии используется в одной из формулировок второго закона термодинамики: в изолированных системах могут самопроизвольно протекать только процессы, идущие с увеличением энтропии (ΔS>0). Под изолированными системами понимаются системы, не обменивающиеся с окружающей средой ни веществом, ни энергией. Системы, в которых протекают химические процессы, к изолированным системам не относятся, т.к. они обмениваются с окружающей средой энергией (тепловой эффект реакции).
5) Энергия Гиббса (изобарно-изотермический потенциал). Во многих случаях самопроизвольные процессы (процессы, происходящие без подвода энергии от внешнего источника) в природе протекают при наличии разности потенциалов, например, разность электрических потенциалов, обусловливает перенос заряда, а разность гравитационных потенциалов – падение тела. Эти процессы заканчиваются при достижении минимума потенциала. Движущей силой химических процессов, протекающих при постоянных давлении и температуре является изобарно-изотермический потенциал, называемый в настоящее время энергией Гиббса и обозначаемый G. Изменение энергии Гиббса в химическом процессе определяется соотношением.
ΔG = ΔH –TΔS,
где ΔG – изменение энергии Гиббса химического процесса; ΔH – изменение энтальпии химического процесса; ΔS – изменение энтропии химического процесса; Т – температура в Кельвинах.
Уравнение может быть представлено в следующем виде: ΔH = ΔG + TΔS. (2.17)
Смысл уравнения в том, что часть теплового эффекта реакции расходуется на совершение работы (ΔG), а часть рассеивается в окружающую среду (TΔS).
Энергия Гиббса является критерием принципиальной возможности самопроизвольного протекания реакции. Если в ходе реакции энергия Гиббса уменьшается, то процесс может протекать в данных условиях самопроизвольно ΔG < 0. Процесс в данных условиях неосуществим, если ΔG > 0. Реакция является обратимой, т.е. может протекать и в прямом и в обратном направлении, если ΔG = 0 (термодинамическое условие химического равновесия).
Эти соотношения применимы также к фазовым равновесиям, т.е. случаям, когда в равновесии находятся две фазы (агрегатных состояния) одного и того же вещества, например, лед и жидкая вода.
Энтальпийный и энтропийный факторы. Процессы могут протекать самопроизвольно (ΔG<0), если они сопровождаются уменьшением энтальпии (ΔH<0) и увеличением энтропии системы (ΔS>0). Если же энтальпия системы увеличивается (ΔH>0), а энтропия уменьшается (ΔS<0), то такой процесс протекать не может (ΔG>0). При иных знаках ΔS и ΔН принципиальная возможность протекания процесса определяется соотношением энтальпийного (ΔH) и энтропийного (ТΔS) факторов.
Если ΔН>0 и ΔS>0, т.е. энтальпийная составляющая противодействует, а энтропийная благоприятствует протеканию процесса, то реакция может протекать самопроизвольно за счет энтропийной составляющей, при условии, что |ΔH|<|TΔS|.
Если, энтальпийная составляющая благоприятствует, а энтропийная противодействует протеканию процесса, то реакция может протекать самопроизвольно за счет энтальпийной составляющей, при условии, что |ΔH|>|TΔS|.
Влияние температуры на направление реакции. Изменение знака энергии Гиббса произойдет при
Очевидно, что смена знака энергии Гиббса с изменением температуры возможна только в двух случаях: 1) ΔН>0 и ΔS>0 и 2) ΔН<0 и ΔS<0.
Стандартная энергия Гиббса образования - это изменение энергии Гиббса реакции образования 1 моль соединения из простых веществ, устойчивых при стандартных условиях. Энергия Гиббса образования простых веществ принимается равной нулю. Стандартные энергии Гиббса образования веществ можно найти в соответствующих справочниках.
Энергия Гиббса химической реакции. Энергия Гиббса является функцией состояния, т.е. ее изменение в процессе не зависит от пути его протекания, а определяется исходным и конечным состоянием системы. Следовательно, энергию Гиббса химической реакции можно рассчитать по формуле:
Если условия отличаются от стандартных, то для нахождения ΔrG может быть использовано уравнение изотермы Вант-Гоффа, которое для реакции между газами записывается как
а между растворенными веществами -
,где относительные парциальные давления соответствующих веществ; сА, сВ, сD, cE - концентрации соответствующих растворенных веществ, а, b, c, d – соответствующие стехиометрические коэффициенты.
Если реагирующие вещества находятся в стандартном состоянии, то уравнения превращаются в
