
- •29. Барометрическая формула. Распределение Больцмана и его смысл.
- •30. Число столкновений и средняя длина свободного пробега молекул. Эффективный диаметр молекул.
- •31. Явление переноса: диффузия, вязкость, теплопроводность.
- •32. Макроскопические процессы (упорядоченные и хаотические). Термодинамические процессы (обратимые и необратимые).
- •33. Энтропия, ее свойства. Расчет изменения энтропии у идеального газа.
- •34. Второе начало термодинамики (формулировки) и его смысл.
- •Физический смысл второго начала термодинамики:
- •35. Тепловая машина: принцип действия, энергетическая схема работы, кпд.
- •36. Цикл Карно. Кпд идеальной тепловой машины, работающей по циклу Карно; сопоставление с кпд реальной тепловой машины.
- •37. Фазы и фазовые переходы. Диаграмма состояний. Тройная точка. Критическая точка. Условия равновесия фаз. Уравнение Клайперона-Клаузиуса. Метастабильные состояния.
- •38. Закон Кулона. Электрический заряд и напряженность электрического поля.
- •Идеи Фарадея
- •39. Принцип суперпозиции. Электрический диполь.
- •40. Поток вектора напряженности электрического поля. Примеры применения теоремы Остроградского-Гаусса.
- •41. Работа электростатического поля. Потенциал. Связь потенциала с напряженностью поля. Циркуляция электростатического поля.
- •42. Равновесие зарядов на проводнике. Поверхностные заряды. Примеры поля вблизи проводника. Проводник во внешнем электрическом поле.
- •43. Электроемкость уединенного проводника. Типы конденсаторов, их электроемкость и другие характеристики.
- •44. Энергия конденсаторов. Плотность энергии электрического поля.
- •45. Постоянный электрический ток. Условия существования тока. Проводники и изоляторы. Закон Ома для однородного участка цепи. Сторонние силы. Эдс.
- •46. Последовательное и параллельное соединение проводников. Последовательное соединение проводников
- •П араллельное соединение проводников
- •47. Закон Джоуля-Ленца (интегральная и дифференциальная формы записи).
- •48. Закон Ома для полной цепи. Закон Ома для неоднородного участка цепи.
- •49. Правило Кирхгофа (рассмотреть на примере).
- •50. Индукция магнитного поля. Закон Био-Савара-Лапласа. Принцип суперпозиции магнитных полей.
- •51. Применение закона Био-Савара-Лапласа в случае бесконечно прямого проводника с током.
- •52. Сила Лоренца. Движение заряженных частиц в электрическом и магнитных полях. Сила Ампера.
- •Сила Лоренца.
32. Макроскопические процессы (упорядоченные и хаотические). Термодинамические процессы (обратимые и необратимые).
Порядок и беспорядок в природе рассматривает макроскопические процессы: упорядоченные и хаотические.
Упорядоченные процессы – процессы, приводящие к строго структурированному взаимно-обусловленному размещению объектов. Пример: биологические процессы по своей сути упорядоченные процессы.
Хаотические процессы – процессы, приводящие к беспорядоченному размещению объектов. Их особенности:
в описании используются статистические представления
имеют направленность к наиболее вероятному состоянию
возврат в предшествующее состояние для больших систем практически не реализуемо
Термодинамические процессы – всякое изменение, происходящее в термодинамической системе и связанное с изменением хотя бы одного из ее параметров состояния. Различают обратимые и необратимые процессы.
Обратимые процессы – процесс термодинамической системы, допускающий возврат в исходное состояние с воспроизведением всех промежуточных состояний, в которых была система рассмотрена в процессе. Необходимым и достаточным условием обратимости термодинамического процесса является его равновесность. Особенности обратимого процесса:
Эти процессы присущи консервативным системам
Эти процессы являются квазистатическими, то есть процессы, в ходе которых система все время остается в состоянии равновесия
Необратимым термодинамическим процессом называется термодинамический процесс, не допускающий возможности возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Все реальные процессы протекают с конечной скоростью. Они сопровождаются трением, диффузией и теплообменом при конечной разности между температурами системы и внешней среды. Следовательно, все они неравновесны и необратимы.
33. Энтропия, ее свойства. Расчет изменения энтропии у идеального газа.
Для описания степени беспорядка в системе используется понятие энтропия. Энтропия – функция состояния системы, которая выражает степень беспорядков в ней. dS=dQ/T, (S)=Дж/к
Свойства энтропий:
1) энтропия – величина аддитивная, т.е. энтропия системы равна сумме энтропий отдельных элементов.
2) если в изолированной системе происходит обратимые процессы, то её энтропия остаётся неизменной.
3) если в изолированной системе происходит необратимые процессы, то её энтропия возрастает.
4) энтропия изолированной системы не может уменьшаться.
Расчет изменения энтропии у идеального газа
Если температура и давление изменяются обратимо и совершается только работа расширения, то для 1 моля идеального газа можно написать:
![]()
Откуда
![]() или
или
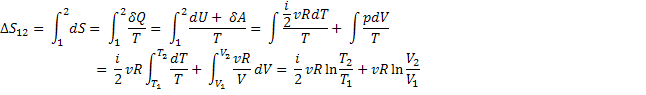
Это уравнение применимо к любому уравнению идеального газа.
