
- •1.Термодинамика и ее метод исследования.
- •2.Параметры термодинамической системы. Температура.
- •3.Параметры термодинамической системы. Давление.
- •4.Параметры термодинамической системы. Удельный объем.
- •6.Внутренняя энергия системы.
- •7.Энтальпия.
- •8.Понятие термодинамического процесса и термодинамическое равновесие.
- •9.Работа. Свойства p-V диаграмм.
- •10.Теплота.Свойства t-s диаграмм.
- •11.Первый закон термодинамики для замкнутого пространства.
- •12.Второй закон термодинамики. Обратимые и необратимые процессы.
- •13.Идеальный газ. Уравнение Клапейрона-Менделеева.
- •14. Газовая постоянная. Универсальная газовая постоянная.
- •15.Реальные газы. Уравнение состояния реальных газов.
- •16.Смеси идеальных газов и их свойства. Определение состава смеси.
- •17.Закон Дальтoна. Парциальное давление.
- •18.Газовая постоянная и средняя молярная масса смеси.
- •19.Понятия и определения теплоемкости.
- •20.Теплоемкость смеси идеальных газов.
- •21.Изотермический процесс.
- •22.Изобарный процесс.
- •23.Изохорный процесс.
- •24.Адиабатный процесс.
- •25.Политpoпные процессы.
- •27. Уравнение неразрывности потока
- •28. Связь между параметрами и функциями состояния в адиабатном потоке
- •29. Сопло и диффузор. Комбинированное сопло Лаваля.
- •31.Понятие о тепловых машинах. Холодильные машины и тепловые двигатели
- •32. Цикл Карно и его кпд
- •33 Циклы двс с подводом теплоты при постоянном объеме
- •34 Циклы двс с подводом теплоты при постоянном давлении
- •35.Цикл двс со смешанным подводом теплоты
- •36 Сравнительный анализ циклов поршневых двс.
- •37. Тепловой поток. Температурное поле. Градиент температуры.
- •38. Основные процессы теплопереноса. Теплопроводность.
- •39. Основные процессы теплопереноса. Конвекция.
- •40. Основные процессы теплопереноса. Тепловое излучение.
- •41. Дифференциальные уравнения процесса теплообмена.
- •48. Теплопроводность при граничных условиях III рода. Многослойная плоская стенка
- •49 . Теплопроводность при граничных условиях III рода. Цилиндрическая стенка.
- •51.Критерии гидродинамического подобия, критерии Фруда, Эйлера, Рейнольдса.
- •53. Вынужденная конвекция. Число Рейнольдса. Режимы течения.
- •54. Свободная конвекция. Число Грасгофа.
- •55 . Критерий подобия поля температур и скоростей. Число Прандтля.
- •56 Определяющие и определяемый критерии.
- •58. Теплообмен при вынужденном движении жидкости вдоль плоской стенки
- •59.Теплообмен при вынужденном движении жидкости вдоль
- •60 Теплообмен при поперечном обтекании пучка труб
16.Смеси идеальных газов и их свойства. Определение состава смеси.
Смесь
идеальных газов представляет собой
механическую смесь отдельных газов, не
вступающих между собой в химические
реакции. Полагаем, что отдельные газы
и смесь в целом подчиняются уравнению
состояния Клапейрона — Менделеева.
Содержание компонентов смеси обычно
задается массовыми или объемными долями
(чаще всего в процентах). Массовой
долей
 называется
отношение массы i-го
газа, входящего в смесь, к массе смеси:
называется
отношение массы i-го
газа, входящего в смесь, к массе смеси:
 .
Масса
смеси из п
компонентов
.
Масса
смеси из п
компонентов
 ,
а сумма их массовых долей
,
а сумма их массовых долей
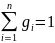 .
.
Объемная
доля — отношение приведенного объема
i-го
газа к общему объему смеси:
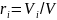
Под
приведенным объемом понимается такой
объем, который занимал бы газ при
температуре и давлении смеси и при
отсутствии других газов.

Смесь
идеальных газов подчиняется законам
поведения идеальных газов (законам
Авогадро, Клапейрона, Бойля— Мариотта
и т. д.). Учитывая это обстоятельство,
определим соотношение между массовыми
и объемными долями. Формула перехода
от массовых долей к объемным и наоборот
имеет следующий вид:

определении газовой постоянной R и средней молярной массы смеси идеальных газов .
В
смеси идеальных газов каждый i-й
газ ведет себя так, как и при отсутствии
других газов, т. е. равномерно заполняет
весь объем V.
Запишем
уравнение Клапейрона для i-го
газа:
 где
где —
парциальное давление.
—
парциальное давление.
17.Закон Дальтoна. Парциальное давление.
Под парциальным давлением понимается такое давление, которое оказал бы газ, входящий в состав смеси, если бы он находился один в том же объеме V и при той же температуре Т, что и в смеси. Закон Дальтона: каждый отдельный газ ведет себя в газовой смеси так, как будто бы он один при температуре смеси занимает весь объем.
По
закону Дальтона давление смеси газов,
в которой нет химических реакций между
компонентами, равно сумме парциальных
давлений отдельных газов:
 .
.
Просуммируем
левую и правую части уравнения
 :
:
 ИЛИ
ИЛИ
 Уравнение Клапейрона для смеси имеет
вид pv=mRT.
Уравнение Клапейрона для смеси имеет
вид pv=mRT.
Приравнивая
правые части уравнений,
найдем
газовую постоянную смеси
 Газовая
постоянная смеси газов равна сумме
произведений массовых долей отдельных
газов, на их газовую постоянную.
Универсальная газовая постоянная
Газовая
постоянная смеси газов равна сумме
произведений массовых долей отдельных
газов, на их газовую постоянную.
Универсальная газовая постоянная
 ,
откуда средняя молярная масса газовой
смеси
,
откуда средняя молярная масса газовой
смеси
 (можно
расписать R)
где
(можно
расписать R)
где
 — молярная масса i-го
компонента.
— молярная масса i-го
компонента.
Используя
формулы перехода
получим: и
и
 .
.
Средняя молярная масса является условной величиной, под которой понимается молярная масса некоторого однородного газа такой же массы, что и у изучаемой смеси, и тождественного по своим физическим свойствам данной смеси.
18.Газовая постоянная и средняя молярная масса смеси.
Газовая постоянная (R) – одна из основных физических постоянных, входит в уравнение состояния 1 моля идеального газа: pV = RT, где р – давление, V – объем моля газа, Т – абсолютная температура. Газовая постоянная численно равна работе расширения 1 моля идеального газа под постоянным давлением при нагревании на 1 K.
R = pV/T = 1.01•105•22.4•10-3/273[Па•м3/моль]/K =8.31(44) Dж/(моль•K)
Уравнение для нахождения удельной газовой постоянной смеси:
R = еgiRi= 8314,2(g1/ M1+ g2/ M2+… + gn/ Mn)
Зная молярную массу смеси, можно найти газовую постоянную смеси:
R = 8,314 / M.
Зная объемный состав смеси, получим следующие формулы:
gi= (R / Ri),
еgi = Rе(ri / Ri) = 1.
Формула для вычисления удельной газовой постоянной примет вид:
R= 1 / е(ri/Ri) = 1 / (r1/ R1 + R2+… + rn / Rn).
Средняя молярная масса смеси газов является достаточно условной величиной:
M = 8314,2 / R,
M= 8314,2 / (g1R1+ g2R2 +. + gnRn).
Если произвести замену удельных газовых постоянных R1, R2,…, Rn их значениями из уравнения Клайперона, найдем среднюю молярную массу смеси газов, если смесь определяется массовыми долями:
M= 1 / (r1/ M1+ r2/ M2+. + rn/ Mn).
В случае, когда смесь определяется объемными долями, получаем следующее выражение:
R= 1 / еriRi = 8314,2 / еriMi.
Зная, что R = 8314,2 / M, получим:
M= еriMi = r1M1 + r2M2 +. + rnMn.
Таким образом, средняя молярная масса смеси газов определяется суммой произведений объемных долей на молярные массы отдельных газов, из которых состоит смесь.
