
- •Типовые патологические процессы.
- •Стадия сенсибилизации аллергических реакций типа I
- •Патобиохимическая стадия аллергических реакций типа I
- •Стадия клинических проявлений аллергических реакций типа I
- •Проявления вторичной альтерации
- •Медиаторы воспаления. Виды медиаторов воспаления.
- •Клеточные медиаторы воспаления
- •Физико-химические изменения в очаге воспаления. Ацидоз.
- •Ацидоз в очаге воспаления
- •Механизмы развития метаболического ацидоза
- •Последствия ацидоза
- •Системный воспалительный ответ
- •17. Лихорадка!
- •19 Понятие об опухоли. Биологические особенности опухолевого роста
- •21. Стадии опухолевого роста.
- •22. Взоимоотношение между опухолью и организма.
- •23. Голодание.
- •Причины гипогликемии Патология печени
- •Нарушения пищеварения
- •Патология почек
- •Эндокринопатии
- •Углеводное голодание
- •Длительная значительная гиперфункция организма при физической работе
- •Гипергликемия ( нарушение из крови глю в клетки)
- •Глюкозурия и полиурия (при концентрации 10 ммоль нарушается способность почек к реабсорции глюкозы – глюкоза в моче, с ней потеря воды
- •33 Нарушение водного обмена.
Гипергликемия ( нарушение из крови глю в клетки)
Глюкозурия и полиурия (при концентрации 10 ммоль нарушается способность почек к реабсорции глюкозы – глюкоза в моче, с ней потеря воды
Кетонемия и кетоацидоз ( конкурентные инсулину – адреналин и глюкокортикойды стимулируют метаболизм липидов и жирных кислот, преобладает эффект глюкагона , стимулируется кетогенез в печени, бета окисление жирных кислот образуется ацетил коа, из него - кетоновые тела.
Щелочной резерв крови может уменьшиться до 25 об.% СО2 рН крови снизиться до 7,2-7,0. Происходит снижение буферных оснований. Повышенное поступление неэтерифицированных жирных кислот в печень вследствие липолиза приводит к повышенному образованию триглицеридов. Наблюдается усиленный синтез холестерина. Снижается синтез белка, в том числе и антител, что поиводит к уменьшению сопротивляемости инфекциям. Неполноценный синтез белка является причиной развитая диспротеинемии (уменьшение фракции альбуминов и увеличение осглобулинов). Значительная потеря жидкости вследствие полиурин приводит к обезвоживанию организма. Усиливается выделение из организма калия, хлоридов, азота, фосфора, кальция.
Отрицательный озотистый баланс – синтез мочевины
Гиперосмотическая гидротация тканей.

№29 нарушение липидного обмена. гиперлипопротеидемии, виды, механизмы
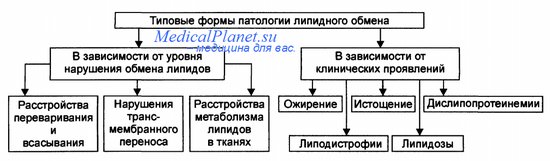
Типовые формы патологии обмена липидов
Типовые формы патологии липидного обмена представлены на рисунке.
• В зависимости от этапов метаболизма липидов выделяют расстройства: - Переваривания и всасывания липидов в ЖКТ (например, в результате дефицита липаз поджелудочной железы, нарушения желчеобразования и желчевыделения, расстройств полостного и «мембранного» пищеварения). - Трансмембранного переноса липидов из кишечника в кровь и утилизации их клетками (например, при энтеритах, нарушении кровообращения в стенке тонкой кишки). - Метаболизма липидов в тканях (например, при дефекте или недостаточности липаз, фосфолипаз, ЛПЛазы).
• В зависимости от клинических проявлений различают ожирение, истощение, дислипопротеинемии, липодистрофии и липидозы.
Нарушение процесса переваривания и всасывания жиров наблюдается: 1. при недостатке панкреатической липазы, 2. при дефиците желчных кислот (воспаление желчного пузыря, закупорка желчного протока, заболевания печени). Нарушается эмульгирование жира, активация панкреатической липазы и образование наружной оболочки смешанных мицелл, в составе которых высшие жирные кислоты и моноглицериды переносятся с места гидролиза жиров к всасывающей поверхности кишечного эпителия; 3. при усиленной перистальтике тонкого кишечника и поражениях эпителия тонких кишок инфекционными и токсическими агентами 4. при избытке в пище ионов кальция и магния, когда образуются нерастворимые в воде соли желчных кислот - мыла; 5. при авитаминозах A и B, недостатке холина, а также при нарушении процесса фосфорилирования (тормозится всасывание жира). Гиперлипопротеидемия (ГЛП) — состояние организма, для которого характерно увеличение в плазме крови количества ЛП за счёт преимущественного повышения либо X, либо ТГ, либо X и ТГ совместно. Эти нарушения признаны самыми распространёнными у европейцев, их встречают в разных популяциях с частотой от 10% до 25%. Они возникают в результате как избыточного поступления ЛП с пищей, так и нарушения их образования либо транспорта, либо утилизации, либо выделения, либо различного их сочетания. В частности, для ГЛП характерно увеличение содержания следующих веществ:
- общего X — выше 5,2 мМ/л (200 мг/дл), вплоть до 7,5 мМ/л; - ТГ — выше 1,6 мМ/л (140 мг/дл) и даже 2,8 мМ/л (250 мг/дл) - ЛПНП — выше 4,3 г/л; - холестерина ЛПНП — выше 4,2 мМ/л (160 мг/дл); - холестеринового коэффициента атерогенности [равного разности общего X и X (ЛПВП), поделенного на общий X], обычно превышающего 3,5-6; - снижение содержания ЛПВП (у мужчин — ниже 1,3 г/л, у женщин — ниже 2,5 г/л.).
Гиперлипопротеидемия, сопровождающиеся различной степенью повышения отдельных ЛП, в том числе ХМ, согласно ВОЗ, считают не самостоятельными заболеваниями, а важнейшими симптомокомплексами, лежащими в основе различных как наследственных, так и приобретённых заболеваний (атеросклероза, жировой инфильтрации печени, общего ожирения, тромботических состояний, кислородного голодания тканей и др.). Гиперлипопротеидемия может быть алиментарной, транспортной и ретенционной.
- Алиментарная гиперлипопротеидемия может развиваться как у больных, так и у здоровых людей после приёма жирной, обычно обильной пищи. Проявляется повышением в крови содержания ХМ, ТГ, апопротеинов, ФЛ, X и ЭХ. Однако у здоровых лиц она бывает временной (начинается через 2-3 ч, достигает максимума через 4-6 ч и исчезает к 9-му часу). У больных же людей ГЛП более значительна и продолжительна, что может быть обусловлено нарушением функций печени, селезёнки, макрофагальной системы и недостаточностью липопротеинлипазы. Это, в частности, отмечают при I и V типах ГЛП по Д. Фредриксону, сахарном диабете, атеросклерозе и т.д.
- Транспортная гиперлипопротеидемия проявляется повышением в крови преимущественно содержания ТГ, глицерола, НЭЖК. Она обычно развивается при голодании, стрессе, повышении функций симпатической нервной системы, симпатоадреналовой системы, увеличением синтеза и активности СТГ, АКТГ, глюкокортикоидов, глюкагона, ТТГ, тиреоидных гормонов. Это сопровождается усилением мобилизации липидов из жировых депо и переноса их в печень, где повышается синтез ТГ и ЛПОНП. На фоне возбуждения а-адренорецепторов тормозится образование и действие инсулина, что способствует снижению утилизации глюкозы тканями, а также торможению липогенеза и дополнительной активизации липолиза в жировой ткани.
- Ретенционная гиперлипопротеидемия развивается при задержке поступления различных липидов, в основном ТГ, из крови в ткани. Она проявляется повышением содержания в крови различных видов ЛП (ЛПОНП, ЛПНП), особенно ТГ, а также НЭЖК и свободного X. Встречают при сахарном диабете, атеросклерозе, голодании, болезнях почек и печени, потере белков при кровотечениях, ожогах и др. Развитию ретенционной ГЛП способствуют диспротеинемия, гипоальбумине-мия, снижение содержания ЛПВП, торможение липопротеиновой липазы — ЛПЛ (в результате дефицита липокаина, гепарина, инсулина и избытка натрия хлорида, СТГ, глюкагона, токсического действия жёлчных кислот как при застойной, так и при паренхиматозной желтухе), угнетения активности мононуклеарной системы, тучных клеток и эндотелиоцитов.
Следует отметить, что ведущий патогенетический фактор развития ретенционной гиперлипопротеидемии — снижение активности ЛПЛ плазмы крови. Важные клинические признаки ГЛП и гиперхиломикронемии — дистрофия печени, гепато- и спленомегалия, а также ксантомы (скопления макрофагов, перегруженных липидами и имеющих жёлто-оранжевую окраску). Ксантомы могут находиться в различных частях тела (веках, роговице, ахилловом сухожилии, сухожилии четырёхглавой мышцы бедра, коже коленей, локтей и т.д.).
№30 ожирение. Ожирение - наклонность организма к чрезмерному увеличению массы тела под влиянием определенных условий. При этом масса тела увеличивается вследствие ненормальной аккумуляции жира в депо.
Величину избытка массы тела определяют на основании индекса Кетле, который вычисляют путем деления массы тела, выраженной в килограммах, на квадрат роста в метрах. Допустимый индекс для мужчин — 20,0 — 25,0, для женщин — 19,0 — 23.8. Более высокий индекс свидетельствует об избыточной массе тела, степень которой выражается в процентах:
I степень — 15 — 29%;
II степень — 30 — 49%;
III степень — 50— 100 %;
IV степень — более 100 %.
По этиологии различают три вида ожирения — алиментарное, гормональное ицеребральное. Существенную роль играет наследственность в патогенезе ожирения. Ожирение развивается в результате трех основных патогенетических факторов:
1) повышенного поступления пиши (углеводы, жиры) при несоответствующем этому поступлению энергетическом расходовании жира;
2) недостаточного использования (мобилизации) жира депо как источника энергии;
3) избыточного образования жира из углеводов.
Избыточное потребление пищи может быть следствием повышенного аппетита (булимии) из-за перевозбуждения пишевого центра (вентролатеральные ядра заднего гипоталамуса) и/или торможения «центра сытости» (вентромедиальные ядра гипоталамуса). При этом развивается гипоталамическое ожирение. Рефлекторное возбуждение пищевого центра возможно при частом возбуждении вкусовых окончаний полости рта (например, пряностями), при частом пробовании пищи (у поваров и кондитеров). При понижении чувствительности нервных окончаний в стенке желудка торможение пищевого центра происходит только при чрезмерном растяжении желудка. У лиц. занимающихся тяжелым физическим трудом, повышается возбудимость пищевого центра, т.е. снижается потребление глюкозы «глюкорецепторами» гипоталамуса («центры сытости» обладают специфической реактивностью к глюкозе). При переходе этих людей к образу жизни, не требующему большой физической нагрузки, сохраняются прежний уровень возбудимости пищевого центра и прежний аппетит, что ведет к перееданию. У пожилых людей склонность к ожирению также до известной степени объясняется несоответствием между сохранившимся уровнем прежней возбудимости пищевого центра и меньшей в этом возрасте тратой энергии (снижен основной обмен, уменьшена мышечная активность). Гипоталамическое и диэнцефальное ожирение может развиться у больных с травмой головного мозга, после перенесенного менингита или энцефалита, при внутричерепной гипертензии и опухолях в головном мозге.
при недостаточности щитовидной железы и гипофиза. У гипофизэктомированных крыс при недостаточном питании снижается использование жира из депо, а при избыточном питании усиливается его депонирование. Адренокортикотропный гормон (АКТГ) непосредственно активизирует липолиз и выход неэтерифицированных жирных кислот. В то же время АКТГ стимулирует секрецию глюкокортикоидов. При этом увеличиваются запасы гликогена в печени и тормозится мобилизация жиров из депо Повышенная секреция глюкокортикоидов тормозит действие СТГ, его жиромобилизирующий и стимулирующий окисление жира эффекты, в результате возрастает отложение жир: при болезни и синдроме Иценко-Кушинга. Бета-липотропин (из аденогипофиза), ТТГ и тироксин стимулируют липолиз и окисление неэтерифицированных жирных кислот. Их недостаточность также приводит к ожирению;
при увеличении концентрации глюкозы в крови уменьшается выход жир. из депо и увеличивается поглощение неэтерифицированных жирных кислот и хиломикронов жировой тканью. Повышенная секреция глюкокортикоидов вызывает гипергликемию за счет усиления гликонеогенеза. При это развивается ожирение;
при избыточной продукции инсулин на фоне гипогликемии (при инсулиноме), гипертрофии β-клеток островков Лангерганса поджелудочной железы (гипоталамическое ожирение происходит избыточное образование жира из углеводов. Инсулин тормозит выход жиров из депо, снижает уровень глюкозы в крови, что повышает аппетит и активность пищевого цен ра; стимулирует поглощение глюкозы жировой тканью, способствует синтезу жирных кислот и триглицеридов из продуктов углеводного обмена и захвату жира путем пиноцитоза жировой тканью независимо от уровня глюкозы в среде. При понижении активности половых желез на фоне повышенной реактивности центров гипоталамуса возрастает секреция инсулина и развивается ожирение. Повышенная концентрация глюкокортикоидов в крови вызывает гиперплазию островкового аппарата поджелудочной железы и увеличивает продукцию инсулина. Ожирение у женщин в период лактации и после ее прекращения объясняется активированием пролактином перехода углеводов в жиры в жировой ткани.
Ожирение приводит к неблагоприятным последствиям и патологиям: понижению чувствительности к инсулину увеличенных адипоцитов и мускулатуры, т.е. инсулинорезнстентности;
гиперинсулинизму; гиперлипемии за счет триглицеридов и холестерина, чаще к пре-β-липопротеинемии;
увеличению содержания неэтерифицированных жирных кислот в крови, повышенному потреблению их мускулатурой;
нарушению толерантности к глюкозе;
более сильной реакции гипертрофированных адипоцитов на норадреналин и другие липолитические вещества;
увеличению экскреции глюкокортикоидов с мочой; гиперфагии.
У больных с ожирением развиваются сердечно-сосудистые заболевания и болезни почек, частой причиной которых являются атеросклеротические изменения сосудов. Ожирение предрасполагает к образованию желчных камней, так как желчь у тучных людей содержит недостаточное количество детергентов, растворяющих холестерин. Такие больные плохо переносят наркоз и оперативные вмешательства. Как послеоперационное осложнение часто возникает тромбоэмболия. При ожирении развивается жировая инфильтрация печени, что способствует циррозу. Обнаружена связь между ожирением и раком груди и эндометрия у женщин: их жировая ткань приобретает способность усиленно ароматизировать андростендион в эстрон, что стимулирует ткани, чувствительные к эстрогенам. Ожирение может сопровождаться тяжелыми нарушениями дыхания, поскольку массивные подкожные жировые отложения ограничивают движения грудной клетки, а скопления жира в брюшной полости мешают опусканию диафрагмы, что способствует развитию легочной недостаточности. Одним из грозных осложнений ожирения является сахарный диабет
Первичное ожирение возникает в результате повышенного аппетита (вплоть до булимии), способствующего избыточному поступлению пищи (особенно липидно-углеводной) в организм из-за нарушений прямых и обратных связей между нейро-эндокринной системой, главным образом гипоталамусом, и жировой тканью (адипоцитами), а также между энтериновой системой двенадцатиперстной кишки, надпочечниками, поджелудочной железой и жировой тканью.
Доказано, что к повышению аппетита и пищевой мотивации приводит более длительное и выраженное возбуждение центра голода (венгро-латерального гипоталамуса), сопровождающееся повышением синтеза нейропептида Y в ответ на недостаток энтериновых пептидов (холецистокинина, бомбезина, соматостатина, ВИЛ), гипоталамических пептидов: кортиколиберина, глюкагоноподобного пептида, нейромедиатора ацетилхолина, лептина адипоцитов (при развитии абсолютной лептиновой недостаточности).
Центр голода активизируется также при чрезмерном сообразовании и действии эндорфинов, энкефалинов, соматолиберинов, инсулина и лептина (но при его неспособности тормозить синтез гипоталамусом нейропептида Y, т.е. в случаях развития относительной лептиновой недостаточности). Ведущая клиническая форма первичного ожирения — алиментарно-конституционное ожирение (андроидное, ганоидное и др.).
Первичное ожирение рассматривают как аддитивно-полигенную болезнь с пороговым эффектом по диете. Наследственность играет очень важную роль в его развитии. Так, если родители не страдают ожирением, то первичное андроидное ожирение у ребёнка может возникнуть лишь в 14% случаев.
Если страдает ожирением один из родителей, то у ребёнка андроидное ожирение может возникнуть в 56% случаев, а если ожирением страдают оба родителя, то у их детей ожирение может возникнуть уже в 78% случаев.
Вторичное ожирение — тот или иной синдром, возникающий вследствие патологических процессов в различных звеньях нейроэндокринной системы, не обусловленных первичным дефектом образования или действия лептина. Различают центральные и периферические формы вторичного ожирения.
- К центральным формам относят болезнь Иценко-Кушинга, базофильную аденому гипофиза, адипозо-генитальную дистрофию, юношеский диспитуитаризм и др. - К периферическим формам относят синдром Иценко-Кушинга, гипогонадизм, инсулиннезависимый сахарный диабет, гиперин-сулинизм и др.
Вторичное ожирение возникает в результате либо усиленного запасания жира в жировой ткани, либо ослабления расходования (мобилизации) ТГ в жировой ткани, либо избыточного образования жира из углеводов. Следует отметить, что образование жира из углеводов выражено больше именно в жировой ткани в связи с тем, что в этой ткани, в сравнении с другими, сильнее всего выражен пентозный цикл обмена углеводов. Так, соотношение пентозного и гликолитического циклов в жировой ткани составляет 1:1, в печени — 1:2, в скелетных мышцах обмена по пентозному циклу совсем не происходит.
Большое значение в развитии ожирения имеет активизация процессов липогенеза и/или торможение процессов липолиза в адипоцитах. Это происходит при усилении образования и действия инсулина, введении в организм аг-адреномиметиков, снижении синтеза и биологической активности СТГ, ГТГ, АКТГ, ТТГ, глюкокортикоидов, тиреоидных и половых гормонов, катехоламинов, ослаблении активности симпатоадреналовой системы и активизации парасимпатической системы.
Локальные формы накопления жиров возникают при липоматозе, характеризующемся образованием различного количества липом (доброкачественных опухолей, состоящих из гипертрофированных адипоцитов), имеющих разные размеры. В основе их развития лежит либо наследственный, либо приобретённый дефект регуляторного участка фермента фосфофруктокиназы, способствующего переходу углеводов в ТГ (жиры).
№31 атеросклероз.
Морфогенез атеросклероза
Морфогенез атеросклероза
Долипидная стадия( В это же время начинается морфологическая и функциональная реорганизация эндотелиального монослоя. В развитии этого процесса важную роль играют так называемые активированные тромбоциты, которые стимулируют освобождение из эндотелия фактора роста. Последний стимулирует пролиферацию гладкомышечных клеток артериальной стенки, что приводит к ее утолщению и создает условия для формирования в дальнейшем атеросклеротических бляшек. Важную роль в начальной стадии атеросклероза также играют активированные лейкоциты, которые обладают повышенной адгезией к эндотелию, что приводит к его повреждению и способствует проникновению липидов в сосудистую стенку.) В плазме крови в долипидную стадию возрастает количество глобулинов, вследствие снижения фибринолитической активности плазмы увеличивается количество фибриногена; повышается активность сывороточной гиалуронидазы, что ведет к деполимеризации гиалуроновой кислоты, содержащейся в стенке сосудов, и повышению сосудисто-тканевой проницаемости
Липоидоз(На этой стадии атеросклероза, как уже указывалось выше, на интиме сосудов появляются желтые пятна. Липолитическая активность сосудистой стенки резко снижена, в интиме откладывается большое количество липидов (результат моноцитарно-макрофагального механизма), она «загружается» липидами и белками. На эти продукты, а также на распадающиеся кислые мукополисахариды развивается реакция со стороны сосудистой стенки в виде разрастания соединительной ткани. Изменения со стороны крови такие же, как на первой стадии, но более выраженные.)
Липосклероз(В сосудистой стенке вокруг отложений белков и липидов происходит бурное разрастание соединительной ткани. В интиме отмечается большое количество «нагруженных» жиром макрофагов (так называемые ксантомные клетки), которые частью уходят в лимфу, а частью распадаются, увеличивая тем самым количество детрита в сосудистой стенке, где образуется плотная бляшка, выбухающая в просвет артерии.)
Атероматоз(В липосклеротической бляшке параллельно идут два процесса: усиление склероза, то есть разрастание соединительной ткани, и усиление распада белковых и липидных масс, то есть образование детрита. Атеросклеротическая бляшка в этот период на разрезе представляет собой плотную соединительно тканную капсулу, внутри которой расположены массы детрита и кристаллы холестерина.
Атерокальциноз а этой стадии истончается интима, покрывающая соединительно-тканную капсулу, бляшка адсорбирует на себе соли кальция и может петрифицироваться.
Атероматная язва Оболочка бляшки становится очень тонкой, бляшка изъязвляется, и атероматозные массы попадают в просвет сосуда.
Атеросклероз — прогрессирующие изменения преимущественно во внутренней оболочке артерий эластического и мышечно-эластического типа, заключающиеся в избыточном накоплении ЛП и других компонентов крови, в реактивном образовании фиброзной ткани и происходящих в ней комплексных изменений.
• В результате атеросклеретического поражения сужается просвет артерий, нарушается кровоснабжение органов и тканей, развиваются осложнения в виде кальциноза и аневризм стенок сосудов, тромбоза, эмболии и др. Наиболее поражаемые атеросклерозом регионы сосудистого русла: брюшной отдел аорты, коронарные артерии, сонные артерии, артерии мозга, почечные артерии, артерии брыжейки и нижних конечностей. • Первые признаки начинающегося атерогенеза обнаруживаются уже у детей 9-10 лет. К 25 годам они выявляются (в виде липидных полосок) на 30-50% поверхности аорты. В 10—15-летнем возрасте липидные полоски формируются в коронарных артериях, а у большинства 30—40-летних людей они выявляются в сосудах мозга. В процессе прогрессирования атеросклероза развиваются фиброзные бляшки, происходят их кальцификация, изъязвление и другие изменения.
Атеросклероз является разновидностью артериосклероза, а именно атероматозной его формой.
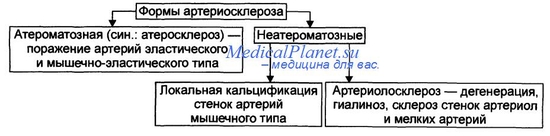
Формы атеросклероза.
Атеросклеротические изменения происходят преимущественно во внутренней оболочке артерий. Этот процесс протекает в три стадии: жировой полоски, фиброзной бляшки и комплексных нарушений.
Жировая полоска
Жировая полоска — раннее морфологическое проявление атеросклероза. С момента рождения человека в сосудах можно обнаружить пятна желтоватой окраски размером 1—2 мм. Эти пятна, являющиеся отложениями липидов, с течением времени увеличиваются и сливаются друг с другом. ГМК и макрофаги появляются во внутренней оболочке артерий, макрофаги накапливают ли-пиды и превращаются в пенистые клетки. Так возникает жировая полоска, состоящая из ГМК и содержащих липиды макрофагов. Но отложение липидов в виде жировых полосок в стенке артерий не означает обязательного перехода процесса в следующую стадию (формирование фиброзной бляшки).
Фиброзная бляшка
Фиброзная бляшка располагается во внутренней оболочке артерий и растёт эксцентрично, со временем уменьшая просвет сосуда. Фиброзная бляшка имеет плотную капсулу, состоящую из клеток эндотелия, ГМК, Т-лимфоцитов, пенистых клеток (макрофагов), фиброзной ткани, и мягкое ядро, содержащее эфиры и кристаллы холестерина. Холестерин образуется не за счёт локального синтеза, а поступает из крови.
.
Комплексные нарушения
Комплексные нарушения заключаются в уменьшении толщины капсулы фиброзной бляшки менее 65 мкм и нарушении её целостности — появлении трещин, изъязвлений, разрывов. Этому способствуют следующие факторы: • Увеличение зоны атероматоза более чем на 30-40% от общего объёма фиброзной бляшки (за счёт накопления холестерина). • Инфильтрация поверхности фиброзной бляшки макрофагами (более 15% её поверхности), приводящая к асептическому воспалению. • Воздействие металлопротеаз, продуцируемых макрофагами и вызывающих деструкцию коллагена, эластина и гликопротеинов. • Высокое содержание окисленных ЛПНП, вызывающих продукцию медиаторов воспаления и стимуляцию адгезии моноцитов.
Нарушение целостности поверхности фиброзной бляшки приводит к адгезии к ней тромбоцитов, их агрегации, тромбозу и развитию клинической картины, соответствующей расположению фиброзной бляшки (инфаркт миокарда, ише-мический инсульт и т.д.), в связи с частичным или полным прекращением кровотока в поражённых сосудах.
