
- •Типовые патологические процессы.
- •Стадия сенсибилизации аллергических реакций типа I
- •Патобиохимическая стадия аллергических реакций типа I
- •Стадия клинических проявлений аллергических реакций типа I
- •Проявления вторичной альтерации
- •Медиаторы воспаления. Виды медиаторов воспаления.
- •Клеточные медиаторы воспаления
- •Физико-химические изменения в очаге воспаления. Ацидоз.
- •Ацидоз в очаге воспаления
- •Механизмы развития метаболического ацидоза
- •Последствия ацидоза
- •Системный воспалительный ответ
- •17. Лихорадка!
- •19 Понятие об опухоли. Биологические особенности опухолевого роста
- •21. Стадии опухолевого роста.
- •22. Взоимоотношение между опухолью и организма.
- •23. Голодание.
- •Причины гипогликемии Патология печени
- •Нарушения пищеварения
- •Патология почек
- •Эндокринопатии
- •Углеводное голодание
- •Длительная значительная гиперфункция организма при физической работе
- •Гипергликемия ( нарушение из крови глю в клетки)
- •Глюкозурия и полиурия (при концентрации 10 ммоль нарушается способность почек к реабсорции глюкозы – глюкоза в моче, с ней потеря воды
- •33 Нарушение водного обмена.
Клеточные медиаторы воспаления
К клеточным медиаторам воспаления относят биогенные амины, нейромедиаторы, нейропептиды, цитокины, множество секретируемых лейкоцитами агентов — лейкокины, а также оксид азота, производные ВЖК и липи-дов (липидные медиаторы), нуклеотиды и нуклеозиды.
1 гр. БАВ – Ацетил-холин и т.д
2 гр. Белки и полипептиды – цитокины, интерликины , интерфероны ,. КСФ, , нейромедиаторы, , лактоферим.
3. производные арахидоновой к-ты. – факторы активации тромбоцитов, Цок 2 – простогландины- тромбоксыны.
4. группа биологических окислителей ; гидроксилрадикал,
5. производные глюгозамингликана.
Биологический эффект локальный – расширение микрососудов , повышается проницаемость, разрушение бозальных мембран сосудов( гистамин, амины ), активируется тромбообразование , разрожение нервных окончаний
Физико-химические изменения в очаге воспаления. Ацидоз.
Основные физико-химические изменения в очаге воспаления перечислены на рисунке.
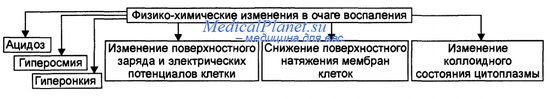
Физико-химические изменения в очаге воспаления.
Ацидоз в очаге воспаления
Воспалительная реакция характеризуется увеличением [Н+] и, соответственно, снижением рН в клетках и межклеточной жидкости — развитиемацидоза.
Причина метаболического ацидоза — накопление в очаге воспаления избытка недоокисленных соединений.
Механизмы развития метаболического ацидоза
• Образование большого количества «кислых» продуктов изменённого метаболизма вследствие:
- активации гликолиза, что сопровождается накоплением избытка молочной и пировиноградной кислот; - усиления протеолиза и липолиза с накоплением аминокислот, ВЖК и КТ.
• Нарушение оттока из очага воспаления продуктов как нормального, так и нарушенного обмена веществ. Последнее особенно выражено в связи с замедлением оттока венозной крови и развитием стаза в очаге воспаления. • Истощение щелочных буферных систем (бикарбонатной, фосфатной, белковой и др.) клеток и межклеточной жидкости, которые на начальном этапе воспаления нейтрализуют избыток кислых соединений.
.
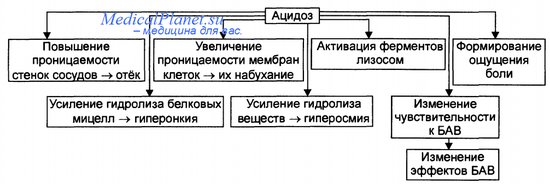
Эффекты ацидоза в очаге воспаления
Последствия ацидоза
Последствия метаболического ацидоза в очаге воспаления приведены на рисунке.
• Повышение проницаемости клеточных мембран, в том числе плазмо-леммы и лизосом, приводит к выходу гидролаз в цитозоль и межклеточное вещество. • Активация лизосомальных ферментов сопровождается усилением деструкции клеточных и неклеточных структур в очаге воспаления. • Повышение проницаемости стенок сосудов за счёт усиления неферментного и ферментного гидролиза компонентов межклеточного матрикса, включая базальные мембраны. • Формирование ощущения боли в очаге воспаления в связи с раздражением и повреждением чувствительных нервных окончаний в условиях избытка Н+. • Усиление гидролиза солей и органических соединений ведёт к повышению осмотического и онкотического давления, изменяет коллоидное состояние цитозоля. • Изменения чувствительности рецепторных структур клеток (в том числе стенок микрососудов) к регуляторным факторам (гормонам, нейромеди-аторам, другим БАВ) сопровождаются нарушениями регуляции тонуса сосудистой стенки. Так, на стадии альтерации в очаге воспаления, как правило, снижается чувствительность рецепторов к адреномиметикам (в частности, к норадреналину) и повышается к холиномиметическим агентам.
Причины гиперосмии в очаге воспаления
• Повышенное ферментативное и неферментное разрушение макромолекул (гликогена, гликозаминогликанов, протеогликанов и др.). • Усиленный в условиях ацидоза гидролиз солей и соединений, содержащих неорганические вещества. • Поступление осмотически активных соединений из повреждённых и разрушенных клеток.
Последствия гиперосмии в очаге воспаления
• Гипергидратация очага воспаления. • Повышение проницаемости сосудистых стенок. • Стимуляция эмиграции лейкоцитов. • Изменение тонуса стенок сосудов и кровообращения в очаге воспаления. • Формирование чувства боли.
Гиперонкия в очаге воспаления
Увеличение онкотического давления в воспалённой ткани — закономерный феномен.
Причины гиперонкии в очаге воспаления
• Увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментного гидролиза пептидов. • Повышение гидрофильности белковых мицелл и других коллоидов в результате изменения их конформации при взаимодействии с ионами. • Выход белков (в основном альбуминов) из крови в очаг воспаления в связи с повышением проницаемости стенок микрососудов.
Последствия гиперонкии в очаге воспаления
Основное: развитие отёка в очаге воспаления.
Заряд и электрические потенциалы
Альтерация тканей при воспалении ведёт к нарушениям электрофизиологаческих процессов в клетках: изменению (как правило, снижению) поверхностного их заряда, а также к расстройствам электрогенеза в возбудимых клетках.
Причины нарушения электрофизиологаческих процессов в клетках
• Повреждение клеточных мембран. • Нарушение энергообеспечения трансмембранного переноса ионов. • Нарушения ионного баланса во внеклеточной жидкости. Последствия • Изменение порога возбудимости клеток. • Колебание чувствительности клеток к действию БАБ (цитокинов, гормонов, нейромедиаторов и др.). • Потенцирование миграции фагоцитов за счёт электрокинеза. • Стимуляция кооперации клеток в связи со снижением величины отрицательного поверхностного их заряда, нейтрализацией его или даже перезарядкой (у повреждённых и погибших клеток внешняя поверхность цитолеммы заряжена положительно в связи с избытком на ней К+, Н+ и других катионов).
№15 эксудация , пролиферация.
Процесс экссудации начинается вскоре после действия повреждающего фактора на ткань и продолжается до начала репаративных реакций в очаге воспаления.
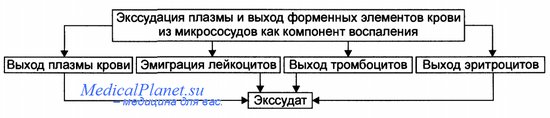
Формирование экссудата в очаге воспаления.
Эксудат: • жидкость, • выходящая из микрососудов, • содержащая большое количество белка • и, как правило, форменные элементы крови. • Накапливается в тканях и/или полостях тела при воспалении.
Причины экссудации
Основная причина экссудации — увеличение проницаемости стенок микрососудов вследствие множества процессов, повреждающих их стенку и перечисленных на рисунке.
Среди процессов, повреждающих стенку сосуда в очаге воспаления, доминируют нижеперечисленные.
• Усиление неферментного гидролиза компонентов базальной мембраны микрососудов в условиях ацидоза.
• Повреждение клеток эндотелия и базальной мембраны стенок микрососудов: - факторами лейкоцитов (гидролитические ферменты лизосом, активные формы кислорода, пероксинитрит азота); - внеклеточными агентами очага воспаления (гидроперекиси липидов, токсины микробов, токсичные метаболиты повреждённых и/или погибших клеток, мембраноатакующий комплекс системы комплемента).
• Перерастяжение и в связи с этим истончение стенки сосудов (особенно венул) вследствие их полнокровия. • Сокращение актиновых нитей и их разрушение, а также разрушение других элементов цитоскелета эндотелиоцитов с их округлением и появлением между ними промежутков, в норме отсутствующих. •Активация механизма трансэндотелиального переноса жидкости («трансцитоза») из просвета микрососуда в интерстиций, что осуществляется путём пиноцитоза с последующим экзоцитозом пиноцитозных пузырьков.
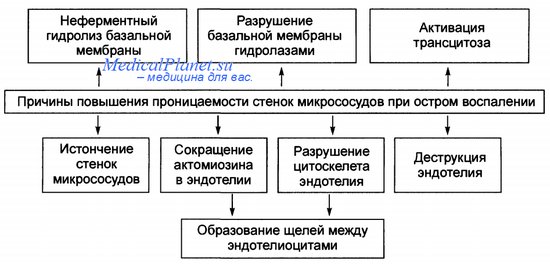
Причины повышения проницаемости стенок микрососудов при остром воспалении.
Факторы потенциации эксудации
Существует группа факторов, потенцирующих образование экссудата. • Увеличение перфузионного давления (усиливает фильтрацию жидкости через сосудистую стенку). • Возрастание площади экссудации (в результате растяжения стенок микрососудов). • Повышение проницаемости базальной мембраны сосудов (под влиянием медиаторов воспаления). • Увеличение осмотического и онкотического давления в очаге воспаления. • Усиление трансцитоза. • Снижение эффективности резорбции жидкости в посткапиллярном отделе сосудов микроциркуляторного русла.
Виды экссудата
В зависимости от наличия в экссудате клеток и их типа, а также от химического состава экссудата различают фибринозный, серозный, геморрагический, гнойный, гнилостный и смешанные виды экссудатов.
Фибринозный экссудат содержит большое количество фибриногена и фибрина.
Серозный экссудат состоит из полупрозрачной жидкости, богатой белком (до 2—3%), и немногочисленных клеток, в том числе форменных элементов крови.
Геморрагический экссудат содержит большое количество белка и эритроцитов, а также другие форменные элементы крови.
Гнойный экссудат — мутная густая жидкость, содержащая до 6—8% белка и большое количество различных форм лейкоцитов, микроорганизмов, погибших клеток повреждённой ткани.
Гнилостный экссудат. Любой вид экссудата может приобрести гнилостный (ихорозный) характер при внедрении в очаг воспаления гнилостной микрофлоры (анаэробы).
Смешанные формы экссудата могут быть самыми разнообразными (например, серозно-фибринозный, гнойно-фибринозный, гнойно-геморрагический и др.).
Состав и диагностическое значение экссудата
Клеточный и химический состав экссудата имеет определённое диагностическое значение и зависит от причины воспаления, ткани, в который развивается воспаление, реактивности организма и ряда других факторов. Примеры:
• при воспалении инфекционно-аллергической природы в экссудате обнаруживается большое количество лимфо- и моноцитов, а также высокий уровень глобулинов; • при воспалении, вызванном паразитами, в экссудате доминируют эозинофилы и содержится много глобулинов; • при остром воспалении, причиной которого являются микробы, в экссудате обнаруживается большое количество нейтрофилов и альбуминов.
Пролиферация
Пролиферация — компонент воспалительного процесса и завершающая его стадия — характеризуется увеличением числа стромальных и, как правило, паренхиматозных клеток, а также образованием межклеточного вещества в очаге воспаления. Эти процессы направлены на регенерацию альтерированных и/или замещение разрушенных тканевых элементов. Существенное значение на этой стадии воспаления имеют различные БАВ, в особенности стимулирующие пролиферацию клеток (митогены).
Пролиферативные процессы при остром воспалении начинаются вскоре после воздействия флогогенного фактора на ткань и более выражены по периферии зоны воспаления. Одним из условий оптимального течения пролиферации является затухание процессов альтерации и экссудации.
Активация пролиферативных процессов коррелирует с образованием БАВ, обладающих антивоспалительным эффектом (своеобразных противовоспалительных медиаторов). К числу наиболее действенных среди них относятся:
• ингибиторы гидролаз, в частности протеаз (например, антитрипсина), р-микроглобулина, плазмина или факторов комплемента; • антиоксиданты (например, церулоплазмин, гаптоглобин, пероксидазы, СОД); • полиамины (например, путресцин, спермин, кадаверин); • глюкокортикоиды; • гепарин (подавляющий адгезию и агрегацию лейкоцитов, активность кининов, биогенных аминов, факторов комплемента).
Исходы пролиферации
При благоприятном течении воспаления в очаге воспаления наблюдается, как правило, полная регенерация ткани — восполнение её погибших и восстановление обратимо повреждённых структурных элементов.
При значительном разрушении участка ткани или органа на месте дефекта паренхиматозных клеток образуется вначале грануляционная ткань, а по мере её созревания — рубец, т.е. наблюдается неполная регенерация.
№16 восполение как целостный процесс.
Сущность Воспаление, как выработанный в эволюции процесс, имеет защитно-приспособительное значение. Реакции, составляющие воспаление, в конечном итоге направлены на фиксацию на месте и уничтожение патогенного фактора, изоляцию участка повреждения от окружающей ткани и его восстановление. Реакции, составляющие воспаление, находятся в сложном динамическом взаимодействии. В начале преобладают процессы повреждения ( альтерации), в конце воспалительный процесс завершается пролиферацией и восстановлением поврежденных тканей. Однако эта фазность относительная, так как пролиферация начинается уже в самом начале воспаления (Рис11). Воспаление может приобретать отрицательное значение при аллергии (аллергическое воспаление). Воспаление, как и другие защитные реакции, не всегда целесообразно. Так, например, ряд механизмов воспаления, направленных на ликвидацию инфекции, при применении современных лекарственных препаратов потеряли свое значение и могут оказывать отрицательный эффект. В некоторых случаях оно приобретает хроническое течение и становится источником инфекции.
