
- •Типовые патологические процессы.
- •Стадия сенсибилизации аллергических реакций типа I
- •Патобиохимическая стадия аллергических реакций типа I
- •Стадия клинических проявлений аллергических реакций типа I
- •Проявления вторичной альтерации
- •Медиаторы воспаления. Виды медиаторов воспаления.
- •Клеточные медиаторы воспаления
- •Физико-химические изменения в очаге воспаления. Ацидоз.
- •Ацидоз в очаге воспаления
- •Механизмы развития метаболического ацидоза
- •Последствия ацидоза
- •Системный воспалительный ответ
- •17. Лихорадка!
- •19 Понятие об опухоли. Биологические особенности опухолевого роста
- •21. Стадии опухолевого роста.
- •22. Взоимоотношение между опухолью и организма.
- •23. Голодание.
- •Причины гипогликемии Патология печени
- •Нарушения пищеварения
- •Патология почек
- •Эндокринопатии
- •Углеводное голодание
- •Длительная значительная гиперфункция организма при физической работе
- •Гипергликемия ( нарушение из крови глю в клетки)
- •Глюкозурия и полиурия (при концентрации 10 ммоль нарушается способность почек к реабсорции глюкозы – глюкоза в моче, с ней потеря воды
- •33 Нарушение водного обмена.
Типовые патологические процессы.
№1 Аллергическая реакция 1 типа!!! Этиология и механизмы повреждения!
Аллергические реакции типа I
При развитии реакций гиперчувствительности типа I (реакции немедленного типа, атопические, реагиновые, анафилактические) происходит взаимодействие Аг с AT (IgE), приводящее к высвобождению БАВ (главным образом, гистами-на) из тучных клеток и базофилов.
Причиной - агенты (компоненты пыльцы растений, трав, цветов, деревьев, животные и растительные белки, некоторые ЛС, органические и неорганические химические вещества).
Примеры реакций типа I — поллинозы, экзогенная (приобретённая) бронхиальная астма, анафилактический шок. К этому же типу относятся псевдоаллергические реакции (в том числе идиосинкразия).
Патогенез реакций этого типа приведён на рисунке.

Стадия сенсибилизации аллергических реакций типа I
На начальных стадиях сенсибилизации осуществляется взаимодействие Аг (аллергена) с иммунокомпетентными клетками в виде процессинга и презентации Аг, формирования специфичных по отношению к Аг клонов плазматических клеток, синтезирующих IgE и IgG (у человека, по-видимому G4), Эти AT фиксируются на клетках-мишенях первого порядка (преимущественно тучных клетках), имеющих большое число высокоаффинных рецепторов к ним. Именно на этом этапе организм становится сенсибилизированным к данному аллергену.
Патобиохимическая стадия аллергических реакций типа I
При повторном попадании аллергена в организм происходит его взаимодействие с фиксированными на поверхности клеток-мишеней первого порядка (тучных клеток и базофильных лейкоцитов) молекулами IgE, что сопровождается немедленным выбросом содержимого гранул этих клеток в межклеточное пространство (дегрануляция). Дегрануляция тучных клеток и базофилов, как минимум, имеет два важных последствия: во-первых, во внутреннюю среду организма попадает большое количество разнообразных БАВ, оказывающих самые различные эффекты на разные эффекторные клетки (в особенности на сократительные и секреторные); во-вторых, многие БАВ, высвободившиеся при дегрануляции клеток-мишеней первого порядка, активируют клетки-мишени второго порядка (нейт-рофилы, эозинофилы, лимфоциты, тромбоциты, моноциты и макрофаги), их которых в свою очередь секретируются различные БАВ. .
Секреция клетками медиаторов аллергии и реализация их эффектов обусловливает: • повышение проницаемости стенок микрососудов и развитие отёка тканей, • нарушения кровообращения, • сужение просвета бронхиол, спазм кишечника, • гиперсекрецию слизи, • прямое повреждение клеток и неклеточных структур.
Стадия клинических проявлений аллергических реакций типа I
Определённая комбинация указанных выше и других эффектов и создаёт своеобразие клинической картины отдельных форм аллергии. Чаще всего по описанному механизму развиваются поллинозы, аллергические формы бронхиальной астмы, аллергические конъюнктивит, дерматит, гастроэнтероколит, а также анафилактический шок.
Стадия сенсибилизации аллергических реакций второго типа
• Коммитированные Аг В-лимфоциты трансформируются в плазматические клетки, синтезирующие IgG подклассов 1, 2 и 3, а также IgM. Указанные классы AT могут связываться с компонентами комплемента.
• Ig специфически взаимодействуют с изменёнными антигенными детерминантами на поверхности клеток и неклеточных структур организма. При этом реализуются комплемент — и антителозависимые иммунные механизмы ци-тотоксичности и цитолиза: - Комплементзависимого разрушения мембраны антигенно чужеродной клетки. - Антителозависимого клеточного повреждения и лизиса носителя чужеродного Аг.
Как видно, при аллергических реакциях типа II не только нейтрализуются чужеродные Аг, но также повреждаются и лизируются (особенно при участии комплементзависимых реакций) собственные клетки и неклеточные структуры.
Патобиохимическая стадия аллергических реакций второго типа
• Комплементзависимые реакции. Цитотоксичность и цитолиз реализуются путём нарушения целостности цитолеммы клетки-мишени и её опсонизации. - Нарушение целостности мембраны клетки-мишени достигается благодаря активации под действием комплекса «АТ+Аг» системы комплемента. . - Цитолиз осуществляется благодаря опсонизации клеток-мишеней при помощи факторов комплемента, а также IgG и IgM. В данном случае под влиянием комплекса AT и Аг активируются главным образом (хотя и не только) факторы С4b2аЗЬ. Наличие их стимулирует адгезию к клетке-мишени фагоцитов, высвобождение из них и последующую активацию ферментов их лизосом, генерации ими активных форм кислорода, свободных радикалов, других агентов, которые лизируют антигенно чужеродную клетку.

Основные группы медиаторов аллергических реакций типа II и их эффекты
Стадия клинических проявлений аллергических реакций второго типа
Описанные выше цитотоксические и цитолитические реакции лежат в основе формирования ряда клинических синдромов аллергического характера: так называемых «лекарственных» цитопений (эритро-, лейко-, тромбоцитопений); агранулоцитоза; аллергических или инфекционно-аллергических форм нефрита, миокардита, энцефалита, гепатита, тиреоидита, полиневрита и др.
Для реакций гиперчувствительности типа III (иммунокомплексные, преципитиновые) характерно образование иммунных комплексов. Комплексы, образованные Аг и соответствующим AT, активируют систему комплемента, приводя к развитию воспалительной реакции. Клинические примеры: сывороточная болезнь (после введения чужеродных белков или медикаментов), экзогенный аллергический альвеолит, СКВ, а также гломерулонефрит после инфекций.
Патогенез аллергических реакций типа III приведён на рисунке.
Причиной аллергических реакций этого типа являются хорошо растворимые белки, повторно попадающие в организм (например, при инъекциях сыворотки или плазмы крови, вакцинации, укусах некоторых насекомых, вдыхании веществ, содержащих белки, инфицировании микробами, грибами) или образующиеся в самом организме (например, при развитии инфекций, трипаносомиазе, гельминтозах, опухолевом росте, парапротеинемиях и др.).
Стадия сенсибилизации аллергических реакций третьего типа
• В-лимфоциты продуцируют и секретируют IgG и IgM, обладающие выраженной способностью образовывать преципитаты при их контакте с Аг. Эти преципитаты называют иммунными комплексами, а болезни, в патогенезе которых они играют существенную роль, иммунокомплексными. - Если иммунные комплексы образуются в крови или лимфе, а затем фиксируются в различных тканях и органах, то развивается системная (генерализованная) форма аллергии. Примером её может служить сывороточная болезнь. - В тех случаях, когда иммунные комплексы формируются вне сосудов и фиксируются в определённых тканях, развиваются местные формы аллергии(например, мембранозный гломерулонефрит, васкулиты, периартери-иты, альвеолит, феномен Артюса). - Наиболее часто иммунные комплексы фиксируются в стенках микрососудов, на базальной мембране гломерул почек, в подкожной клетчатке, на клетках миокарда, синовиальных оболочках и в суставной жидкости. - Местные аллергические реакции типа III всегда сопровождаются развитием воспаления.
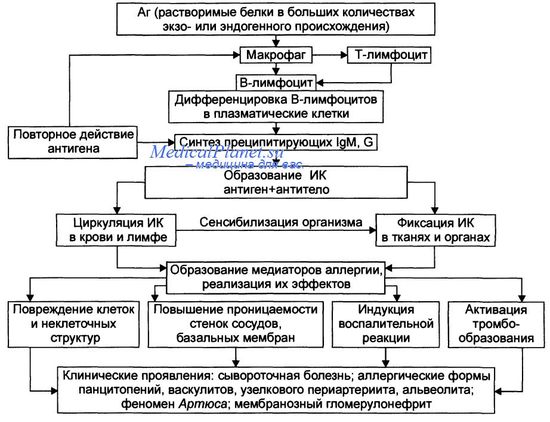
• Высокий уровень преципитирующих IgG и IgM выявляется на 5—7-е сутки после появления Аг в организме. На 10— 14-е сутки, в связи с повреждением тканей под влиянием иммунных комплексов и развитием острого воспаления, появляются клинические признаки заболевания.
Патобиохимическая стадия аллергических реакций третьего типа
В связи с фиксацией в тканях иммунных комплексов, а также активацией реакций по их удалению в тканях и крови появляются медиаторы аллергии, которые (в соответствии с их эффектами) можно объединить в несколько групп.
В реакциях гиперчувствительности типа IV (клеточно-опосредованных, замедленного типа) принимают участие не AT, а Т-клетки, взаимодействующие с соответствующим Аг (сенсибилизированные Т-клетки), которые привлекают в очаг аллергического воспаления макрофаги. Сенсибилизированные Т-клетки после связывания Аг оказывают либо непосредственное цитотоксическое действие на клетки-мишени, либо их цитотоксический эффект опосредуется с помощью лимфокинов. Примеры реакций типа IV — аллергический контактный дерматит, туберкулиновая проба при туберкулёзе и лепре и реакция отторжения трансплантата.
Патогенез реакций гиперчувствительности типа IV приведён на рисунке.
Причины аллергических реакций четвертого типа
• Компоненты микроорганизмов (возбудителей туберкулёза, лепры, бруцеллёза, пневмококков, стрептококков), одно- и многоклеточных паразитов, грибов, гельминтов, вирусов, а также вируссодержащие клетки. • Собственные, но изменённые (например, коллаген) и чужеродные белки (в том числе находящиеся в вакцинах для парентерального введения). • Гаптены: например, ЛС (пенициллин, новокаин), органические мелкомолекулярные соединения (динитрохлорфенол).
Стадия сенсибилизации аллергических реакций четвертого типа
• Происходит антигензависимая дифференцировка Т-лимфоцитов, а именно CD4+ Т2-хелперов (Т-эффекторов реакций гиперчувствительности замедленного типа) и CD8+ цитотоксических Т-лимфоцитов (Т-киллеров). Эти сенсибилизированные Т-клетки циркулируют во внутренней среде организма, выполняя надзорную функцию. Часть лимфоцитов находится в организме в течение многих лет, храня память об Аг. • Повторный контакт иммунокомпетентных клеток с Аг (аллергеном) обусловливает бласттрансформацию, пролиферацию и созревание большого числа различных Т-лимфоцитов, но преимущественно Т-киллеров. Именно они совместно с фагоцитами обнаруживают и подвергают деструкции чужеродный Аг, а также — его носитель.
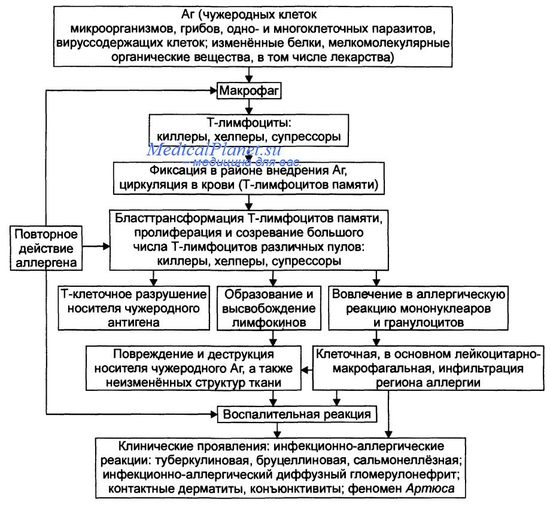
Патобиохимическая стадия аллергических реакций четвертого типа
• Сенсибилизированные Т-киллеры разрушают чужеродную антигенную структуру, непосредственно действуя на неё. • Т-киллеры и мононуклеары образуют и секретируют в зоне аллергической реакции медиаторы аллергии, регулирующие функции лимфоцитов и фагоцитов, а также подавляющие активность и разрушающие клетки-мишени.
В очаге аллергических реакций типа IV происходит ряд существенных изменений. - Повреждение, разрушение и элиминация клеток-мишеней (инфицированных вирусами, бактериями, грибами, простейшими и др.). - Альтерация, деструкция и элиминация неизменённых клеток и неклеточных элементов тканей. Это объясняется тем, что альтерирующие эффекты многих БАВ антигеннезависимы (неспецифичны) и распространяются на нормальные клетки. - Развитие воспалительной реакции. В очаге аллергического воспаления накапливаются преимущественно мононуклеарные клетки: лимфо- и моноциты, а также макрофаги. Часто эти и другие клетки (гранулоциты, тучные) скапливаются вокруг мелких вен и венул, образуя периваскулярные манжетки. - Образование гранулём, состоящих из лимфоцитов, мононуклеарных фагоцитов, формирующихся из них эпителиоидных и гигантских клеток, фибробластов и волокнистых структур. Гранулёмы типичны для аллергических реакций типа IV. Этот тип воспаления обозначается как гранулёматозный (в частности при туберкулиновых, бруцеллиновых и подобных им реакциях). - Расстройства микрогемо- или лимфоциркуляции с развитием капилляротрофической недостаточности, дистрофии и некроза ткани.
Стадия клинических проявлений аллергических реакций четвертого типа
Клинически вышеописанные изменения проявляются по-разному. Наиболее часто реакции манифестируются как инфекционно-аллергические(туберкулиновая, бруцеллиновая, сальмонеллёзная), в виде диффузного гломерулонефрита (инфекционно-аллергического генеза), контактных аллергий — дерматита, конъюнктивита.
№5 аутоимунные болезни .виды механизмы аутоиммунного повреждения
_АУТОИММУННЫЕ БОЛЕЗНИ. Аутоиммунные ( аутоаллергические ) болезни представляют собой группы заболеваний, основным механизмом развития кото- рых являются реакции сенсибилизированных лимфоцитов и аутоан- тител с тканями организма. В роли аутоантигенов могут выступать: 1) естественные, первичные антигены ( неизменная ткань хрусталика глаза,щитовидной железы, яичка, нервной ткани ); 2) приобретенные, вторичные (патологически измененные ткани ) антигены как инфекционной, так и не инфекционной при- роды.
Неинфекционные аутоантигены по происхождению своему мо- гут быть ожоговым, лучевым, холодовым и др., а инфекцион- ные-комплексными и промежуточными. Появление естественных аутоантигенов связывают с наруше- нием физиологической изоляции органов и тканей, по отношению к которым отсутствует иммунологическая толерантность.
Появление инфекционного комплексного аутоантигена ( комп- лексы ткань-микроб, ткань-токсин ) ведет к тому, что возникаю- щие в этих условиях аутоантитела реагируют ни только с микро- бом, но и с тканью, что и определяет возможность развития ауто- агрессивного процесса.
КЛАССИФИКАЦИЯ АУТОИММУННЫХ БОЛЕЗНЕЙ. 1-я группа. _Органоспецифические аутоиммунные болезни (болезнь Хашимото, энцефаломиелит, полиневрит, рассеяный склероз, идиопатическая аддисонова болезнь, асперматогения, симпатическая офтальмия). Их возникновение провоцирует ин- фекция, особенно вирусная, хроническое воспаление и др. Ау- тоиммунизация развивается в связи с повреждением физиологи- ческих барьеров иммунологически обособленных органов, что позволяет иммунной системе реагировать на их антигены выра- боткой аутоантител и сенсибилизированных лимфоцитов. При этом в органах развиваются изменения, характерные преиму- щественно для реакции ГЗТ. 2-я группа. _Органонеспецифические аутоиммунные болезни (системная красная волчанка, ревматоидный артрит, системная склеродермия, дерматомиозит, вторичная гемолитическая анемия и тромбоцитопения). В этих случаях нарушения контроля имму- нологического гемостаза лимфоидной системы связаны с генети- ческими факторами,вирусной и бактериальной инфекцией, иони- зирующим излучением. Аутоиммунизация развивается к антигенам многих органов и тканей, не обладающих органной специфич- ностью. В органах и тканях при этих заболеваниях наблюдаются изменения, характерные для реакций как ГЗТ, так и особенно ГНТ. 3-я группа. Это определенные формы гломерулонефрита, ге- патита, хронического гастрита и энтерита, неспецифический язвенный колит, цирроз печени, ожоговая болезнь, аллергичес- кие анемии, агранулоцитоз, лекарственная болезнь. Изменения антигенных свойств тканей и органов, т.е. образование ауто- антигенов при этих заболеваниях, связано прежде всего с де- натурацией тканевых белков при ожоге, травме, хроническом воспалении, вирусной инфекции. Образование аутоантигена воз- можно при воздействии бактериального антигена,особенно пе- рекрестно реагирующего. В этих случаях с аутоиммунизацией связано не возникновение заболеваний, а прогрессирование ха- рактерных для него органных изменений, которые отражают ре- акции ГЗТ и ГНТ.
№6 имуннодифицитные состояния.
Термином 1ИММУНОДЕФИЦИТЫ 0обозначают нарушения нормального иммунологического статуса, которые обусловлены дефектом одно- го или нескольких механизмов иммунного ответа. С этих позиций можно рассматривать такие известные феномены, как иммунологи- ческий паралич (иммунологическая толерантность) и утрату фи- зиологической толерантности организма (аутоиммунизация).
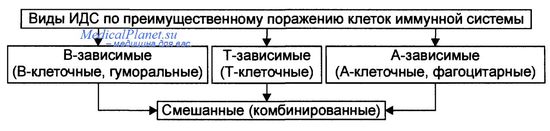
Виды иммунодефицитов.
• Первичные наследуемые и врождённые (генетические) дефекты иммунной системы. • Вторичные — иммунная недостаточность развивается вследствие эндо- и экзогенных воздействий на нормальную иммунную систему (например, около 90% всех вирусных инфекций сопровождается транзиторной иммунодепрес-сией). • Избирательные — вызваны селективным поражением различных популяций иммунокомпетентных клеток. • Неспецифические — дефект(ы) механизмов неспецифической резистентности организма (неспецифического иммунитета), фагоцитов и комплемента. • Комбинированные — сочетанное поражение клеточных и гуморальных механизмов иммунитета (например, В- и Т-лимфоцитов).
В зависимости от преобладания дефекта иммуноцитов того или иного класса, иммунодефициты и иммунодефицитные состояния подразделяют на В-, Т-, А-зависимые (относящиеся к антигенпредставляющим клеткам) и смешанные
Причина иммунодефицитов
Генные и хромосомные дефекты (многочисленные иммунодефициты разных классов). • Вторичные иммунодефициты, или иммунодефицитные состояния
Причины иммунодефицитных состояний многообразны, к ним отнесены: - Иммуносупрессивные препараты (включая фенитоин [дифенин], пени-цилламин, глюкокортикоиды). - Недостаточность питания, полостного и мембранного пищеварения, а также кишечного всасывания. - Наркотики и токсические вещества. - Лучевые воздействия, химиопрепараты. - Рост злокачественных опухолей. - Вирусы (например, ВИЧ).
№7 артериальная гиперемия.
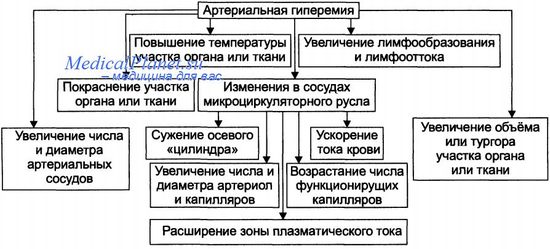
Артериальная гиперемия — увеличение кровенаполнения и количества протекающей по сосудам органов и тканей крови в результате расширения артериол и артерий.
Причины артериальной гиперемии
Причины артериальных гиперемий могут иметь различное происхождение и природу. • По происхождению выделяют артериальные гиперемии, причинами которых являются эндогенные или экзогенные факторы. - Экзогенные. Агенты, вызывающие артериальную гиперемию, действуют на орган или ткань извне. К ним относятся инфекционные (микроорганизмы и/или их эндо- и экзотоксины) и неинфекционные факторы различной природы. - Эндогенные. Факторы, приводящие к артериальной гиперемии, образуются в организме [например, отложение солей и конкрементов в тканях почек, печени, подкожной клетчатке; образование избытка БАВ, вызывающих снижение тонуса ГМК артериол (вазодилатацию), — аденозина, Пг, кининов; накопление органических кислот — молочной, пировиноградной, кетоглутаровой].
• По природе причинного фактора выделяют артериальные гиперемии физического, химического и биологического генеза. - Физические (например, механическое воздействие, очень высокая температура, электрический ток). - Химические (например, органические и неорганические кислоты, щёлочи, спирты, альдегиды). - Биологические (например, физиологически активные вещества, образующиеся в организме: аденозин, ацетилхолин, простациклин, оксид азота).

Механизмы возникновения артериальной гиперемии
Расширение просвета малых артерий и артериол достигается за счёт реализации неирогенного, гуморального и неиромиопаралитического механизмов или их сочетания. • Нейрогенный механизм артериальной гиперемии. Различают нейротоническую и нейропаралитичес-кую разновидности неирогенного механизма развития артериальной гиперемии. - Нейротонический механизм. Заключается в преобладании эффектов парасимпатических нервных влияний (по сравнению с симпатическими) на стенки артериальных сосудов. - Нейропаралитический механизм. Характеризуется снижением или отсутствием («параличом») симпатических нервных влияний на стенки артерий и артериол.
• Гуморальный механизм артериальной гиперемии. Заключается в местном увеличении содержания вазодилататоров — БАВ с сосудорасширяющим эффектом (аденозина, оксида азота, ПгЕ, ГМ2, кининов) и в повышении чувствительности рецепторов стенок артериальных сосудов к вазодилататорам.
• Нейромиопаралитический механизм артериальной гиперемии. + Характеризуется: - истощением запасов катехоламинов в синаптических везикулах варикозных терминалей симпатических нервных волокон в стенке артериол; - снижением тонуса ГМК артериальных сосудов. - Причины
Физиологическая артериальная гиперемия
Физиологическая артериальная гиперемия адекватна воздействию и имеет адаптивное значение. Она может быть функциональной и защитно-приспособительной. • Функциональная. Развивается в органах и тканях в связи с увеличением уровня их функционирования (например, гиперемия в сокращающейся мышце или в усиленно работающем органе). • Защитно-приспособительная. Развивается при реализации защитных реакций и процессов (например, в очаге воспаления либо вокруг чужеродного трансплантата, зоны некроза или кровоизлияния). В этих случаях артериальная гиперемия способствует доставке в ткани кислорода, субстратов метаболизма, Ig, фагоцитов, лимфоцитов, других клеток и агентов, необходимых для реализации местных защитных и восстановительных реакций.
Патологическая артериальная гиперемия
Патологическая артериальная гиперемия не адекватна воздействию, не связана с изменением функции органа или ткани и играет дизадаптивную — повреждающую роль. Патологическая гиперемия сопровождается нарушениями кровоснабжения, микрогемоциркуляции, транскапиллярного обмена, иногда — кровоизлияниями и кровотечениями.
Венозная гиперемия — увеличение кровенаполнения органа или его участка и снижение количества крови, протекающей через их сосуды, вследствие затруднения оттока крови по венам. Затруднение оттока крови возможно при сдавлении тонкостенных вен снаружи воспалительным отеком, опухолью или рубцом, гипертрофированной мышцей, ребром и т.п. Венозный застой в сосудах малого таза возникает при сдавлении вен этого региона при опухолях матки или во время беременности. Вена может закупориваться изнутри тромбом или тромбоэмболом. Развитие венозной гиперемии может быть обусловлено недостаточным развитием эластической ткани венозных стволов и их клапанного аппарата.
Проявления венозной гиперемии
Проявления венозной гиперемии приведены на рисунке. • Увеличение числа и диаметра просвета венозных сосудов в регионе гиперемии. • Цианоз ткани или органа вследствие увеличение в них количества венозной крови и понижения содержания в венозной крови Нb02. Последнее является результатом утилизации кислорода тканью из крови в связи с медленным её током по капиллярам. • Снижение температуры тканей или органов в зоне венозного застоя в результате увеличения объёма в них более холодной (в сравнении с артериальной) венозной крови и уменьшения интенсивности тканевого метаболизма (является результатом снижения притока артериальной крови к тканям в регионе венозной гиперемии). • Отёк ткани или органа происходит вследствие увеличения внутрисосудистого давления в капиллярах, посткапиллярах и венулах. При длительной венозной гиперемии отёк потенцируется за счёт включения его осмотического, онкотического и мембраногенного патогенетических факторов. • Кровоизлияния в ткани и кровотечения (внутренние и наружные) в результате перерастяжения и микроразрывов стенок венозных сосудов (посткапилляров и венул). • Изменения в сосудах микроциркуляторного русла.
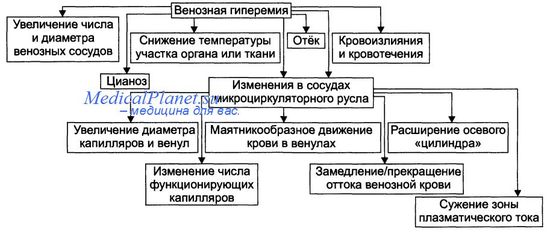
Увеличение диаметра капилляров, посткапилляров и венул в результате растяжения стенок микрососудов избытком венозной крови. - Возрастание числа функционирующих капилляров на начальном этапе венозной гиперемии (в результате оттока венозной крови по ранее нефункционирующим капиллярным сетям) и снижение — на более поздних (в связи с прекращением тока крови в результате образования микротромбов и агрегатов клеток крови в посткапиллярах и венулах). - Замедление (вплоть до прекращения) оттока венозной крови. - Значительное расширение диаметра осевого «цилиндра» и исчезновение полосы плазматического тока в венулах и венах.
№9 ИШЕМИЯ.
Ишемия
Ишемия — несоответствие между притоком к тканям и органам артериальной крови и потребностью в ней. При этом потребность в кровоснабжении всегда выше реального притока крови по артериям.
Механизмы возникновения ишемии
Причины ишемии
Причины ишемии могут иметь различное происхождение и природу.
• По природе причины ишемии делят на физические, химические и биологические. - Физические факторы: сдавление артериальных сосудов (например, опухолью, рубцовой тканью, инородным телом, жгутом), сужение или закрытие просвета изнутри (например, тромбом, эмболом, атеросклеротической бляшкой), действие чрезмерно низкой температуры. - Химические факторы. Многие химические соединения обладают способностью вызывать сокращение ГМК артериальных сосудов и сужение их просвета. Примеры: никотин, ряд ЛС (мезатон, эфедрин, препараты адреналина, АДГ, ангиотензины). - Биологические факторы: БАВ с сосудосуживающими эффектами (например, катехоламины, ангиотензин II, АДГ, эндотелии), БАВ микробного происхождения: их экзо- и эндотоксины, метаболиты с вазоконстрикторным действием.
• По происхождению выделяют ишемии, причина которых имеет эндогенное или экзогенное происхождение (инфекционное и неинфекционное).
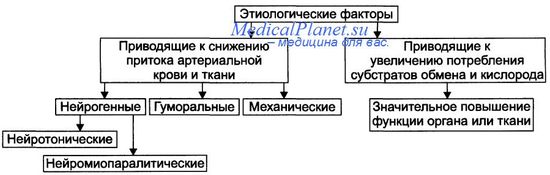
Механизмы возникновения ишемии представлены на рисунке.
Механизмы, обусловливающие преимущественное снижение притока артериальной крови к тканям и органам: неирогенныи, гуморальный и механический.
• Нейрогенный механизм ишемии (нейротонический и нейропаралитический). - Нейротонический. Характеризуется преобладанием эффектов симпатической нервной системы на стенки артериол в сравнении с парасимпатической. Это сопровождается повышенным выбросом норадреналина из адренергических терминалей. Причины: активация симпатических влияний на ткани и органы (например, при различных вариантах стресса, действии на ткани низкой температуры, механической травмы, химических веществ) и повышение адренореактивных свойств стенок артериол (например, при сенсибилизации их к вазрконстрикторным агентам — в условиях повышенного уровня Са2+ или цАМФ в миоцитах). - Нейропаралитический. Характеризуется устранением или снижением («параличом») парасимпатических влияний на стенки артериол. Причина. Торможение или блокада проведения нервных импульсов по парасимпатическим волокнам к артериолам (и в связи с этим — высвобождения ацетилхолина из терминальных нервных волокон в стенках артерий, артериол и прекапилляров). Такая ситуация может наблюдаться при невритах, механических травмах, развитии опухолей, хирургическом удалении ганглиев или пересечении парасимпатических нервов.
• Гуморальный механизм ишемии. Заключается в увеличении содержания в тканях веществ с вазоконстрикторным действием (например, ангиотензина II, АДГ, тромбоксана А2, адреналина, ПгF) и чувствительности рецепторов стенок артериол к агентам с сосудосуживающим действием (например, при увеличении в тканях [Са2+] или [Na+]). • Этиологический фактор механического характера. Характеризуется наличием механического препятствия движению крови по артериальным сосудам. • Причины: сдавление (компрессия) артериального сосуда опухолью, рубцом, отёчной тканью, жгутом и уменьшение (вплоть до полного закрытия — обтурации) просвета артериолы (например, тромбом, агрегатом клеток крови, эмболом). • Эмбол и эмболия.
№10 Стаз .
Стаз — значительное замедление или прекращение тока крови и/или лимфы в сосудах органа или ткани.
Причины стаза
• Ишемия и венозная гиперемия. Они приводят к стазу вследствие существенного замедления кровотока (при ишемии в связи со снижением притока артериальной крови, при венозной гиперемии в результате замедления или прекращения её оттока) и создания условий для образования и/или активации веществ, обусловливающих склеивание форменных элементов крови, формирования из них агрегатов и тромбов. • Проагреганты — факторы, вызывающие агрегацию и агглютинацию форменных элементов крови.
Патогенез стаза
Патогенез стаза представлен на рисунке. На финальном этапе стаза всегда происходит процесс агрегации и/или агглютинации форменных элементов крови, что приводит к сгущению крови и снижению её текучести. Этот процесс активируют проагреганты, катионы и высокомолекулярные белки.
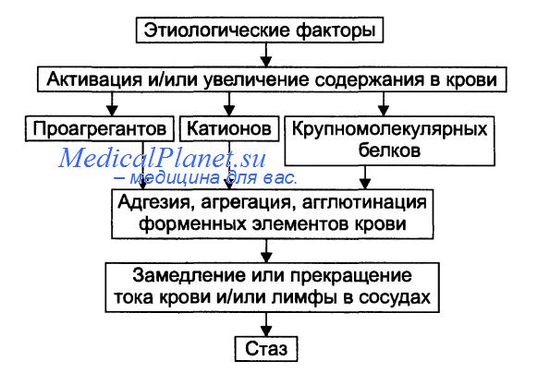
Основные звенья патогенеза стаза
• Проагреганты (тромбоксан А2, аденозиндифосфат, ПгF, ПгЕ, катехоламины, AT к форменным элементам крови) вызывают адгезию, агрегацию, агглютинацию форменных элементов крови с последующим их лизисом и высвобождением из них БАВ (в том числе проагрегантов, потенцирующих реакции агрегации и агглютинации). • Катионы. К+, Са2+, Na+, Mg2+ высвобождаются из клеток крови, повреждённых стенок сосудов и тканей. Адсорбируясь на цитолемме форменных элементов крови, избыток катионов нейтрализует их отрицательный поверхностный заряд или даже меняет его на обратный. И если неповреждённые клетки (благодаря отрицательному заряду) «отталкиваются» друг от друга, то повреждённые клетки («нейтрализованные») образуют агрегаты. Ещё более активно агрегируют «перезаряженные» клетки крови. Имея положительный поверхностный заряд, они сближаются с «нейтрализованными» клетками и особенно с повреждёнными (имеющими отрицательный заряд), формируя агрегаты, адгезирующие на интиме сосудов.
• Высокомолекулярные белки (например, глобулины, фибриноген) снимают поверхностный заряд неповреждённых клеток
Все разновидности стаза подразделяют на первичные и вторичные. • Первичный (истинный) стаз. Формирование стаза первично начинается с активации форменных элементов крови и выделения ими большого количества проагрегантов и/или прокоагулянтов. На следующем этапе форменные элементы агрегируют, агглютинируют и прикрепляются к стенке микрососуда. Это и вызывает замедление или остановку кровотока в сосудах.
• Вторичный стаз (ишемический и застойный). + Ишемический стаз развивается как исход тяжёлой ишемии в связи со снижением притока артериальной крови, замедлением скорости её тока, турбулентным его характером. Это и приводит к агрегации и адгезии клеток крови. + Застойный (венозно-застойный) вариант стаза является результатом замедления оттока венозной крови, сгущения её, изменения физико-химических свойств, повреждения форменных элементов крови (в частности, в связи с гипоксией). В последующем клетки крови адгезируют друг с другом и со стенкой микрососудов.
Проявления стаза
При стазе происходят характерные изменения в сосудах микроциркуляторного русла: • уменьшение внутреннего диаметра микрососудов при ишемическом стазе, • увеличение просвета сосудов микроциркуляторного русла при застойном варианте стаза, • большое количество агрегатов форменных элементов крови в просвете сосудов и на их стенках, • микрокровоизлияния (чаще при застойном стазе).
В то же время проявления ишемии или венозной гиперемии могут перекрывать проявления стаза.
Последствия стаза
При быстром устранении причины стаза ток крови в сосудах микроциркуляторного русла восстанавливается и в тканях не развивается каких-либо существенных изменений. Длительный стаз приводит к развитию дистрофических изменений в тканях, нередко — к гибели участка ткани или органа (инфаркт).
№11 восполение.
Воспаление: • типовой патологический процесс; • возникающий в ответ на действие патогенного фактора; • характеризуется развитием как патологических, так и адаптивных реакций организма; • направлен на локализацию, уничтожение и удаление из организма флогогенного фактора, а также на ликвидацию последствий его действия.
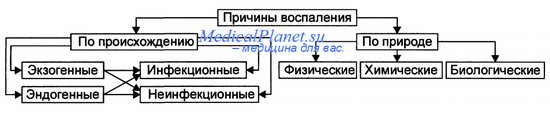
Этиология. Развивается как реакция организма на патогенный раздражитель и на вызванное им повреждение
- экзогенные ( инфекции)
- эндогенные (продукты тканевого распада, злокачественные опухоли, тромбы, инфаркты)
Местные признаки воспаления: покраснение ( артериальная гипертензия) 2) жар( приток крови), 3) опухоль( экссудация, отек), 4) боль( раздражение ноцицепторов БАВ) 5) нарушение функций.
Общие проявления: изменение кол-во лейкоцитов в переферии крови, лихорадка, изменение белкового профиля крови, изменение состава крови, повышенное сое, изменение содержание гармонов, изменение в имуннной системе – аллерг. Реакции.
Альтерация. Первичная альтерация. Вторичная альтерация.
Альтерация — первое и непосредственное следствие повреждающего действия флогогенного фактора и инициальное звено механизма развития воспаления.
В очаге воспаления вьщеляют зоны первичной и вторичной альтерации, их характеристики приведены в таблице и подробнее рассмотрены ниже.
Зона первичной альтерации
Причина формирования первичной альтерации: флогогенный фактор, действующий на ткань.
Локализация первичной альтерации: место прямого контакта причины воспаления с тканью (эта зона — эпицентр очага воспаления).
Основные механизмы первичной альтерации
• Повреждение мембранных структур и внутриклеточных ферментов, а также структур межклеточного вещества. • Расстройства энергетического обеспечения функций и пластических процессов в повреждённой ткани. • Нарушения трансмембранного переноса и градиента ионов, соотношения их между собой, содержания жидкости внутри и за пределами клетки и в зоне альтерации в целом.
Проявления первичной альтерации
• Расстройства функции повреждённых, но ещё жизнеспособных участков ткани вне зоны некроза. • Некроз. • Значительные физико-химические изменения. • Различные формы дистрофии.
Зона вторичной альтерации
Причины вторичной альтерации • Эффекты флогогенного агента (хотя за пределами эпицентра очага воспаления эффективность его патогенного воздействия значительно ниже). • Влияние факторов, вторично формирующихся в зоне первичной альтерации в связи с образованием медиаторов воспаления, развитием метаболических, физико-химических и дистрофических изменений.
Локализация вторичной альтерации
• Частично в месте контакта флогогенного агента с тканью (там, где сила его воздействия была минимальной). • В основном вокруг области первичной альтерации. Обычно площадь этой зоны значительно больше площади первичной.

Механизмы развития вторичной альтерации
• Расстройства местных механизмов нервной регуляции в связи с повреждением тел нейронов, нервных стволов и/или их окончаний, синтеза, накопления и высвобождения из них нейромедиаторов. • Нарушение выброса нейромедиаторов (норадреналина, ацетилхолина и др.) из нервных терминалей симпатической и парасимпатической системы в очаге воспаления и стадийные изменения чувствительности тканей к нейромедиаторам в этом очаге. • Расстройства аксонного транспорта трофических и пластических факторов (углеводов, липидов, белков, адениннуклеотидов, нуклеиновых кислот, БАВ, ионов и других агентов) от тел нейронов к соматическим клеткам. • Стадийные изменения тонуса сосудов микроциркуляторного русла и в связи с этим — расстройства кровообращения • БАВ, поступающие в зону вторичной альтерации из зоны первичной альтерации, а также образующие за пределами очага воспаления.
В совокупности эти изменения обусловливают расстройства обмена веществ, значительные физико-химические сдвиги в зоне вторичной альтерации, развитие различных видов дистрофий и даже некроза.
