- •Кафедра химии
- •7. Термодинамические процессы идеальных газов 39
- •8. Второй закон термодинамики 50
- •15. Циклы тепловых двигателей с газообразным рабочим телом 116
- •16. Циклы газотурбинных установок 134
- •17. Теплосиловые паровые циклы 151
- •18. Циклы холодильных установок 169
- •Введение
- •1. Основные понятия и определения
- •1.1. Основные термодинамические параметры состояния
- •1.2. Термодинамическая система
- •1.3. Термодинамический процесс
- •1.4. Теплота и работа
- •1.5. Термодинамическое равновесие
- •Контрольные вопросы
- •2. Состояние идеального газа
- •2.1. Основные законы идеальных газов
- •2.2. Уравнение состояния идеального газа
- •Контрольные вопросы
- •3. Смесь идеальных газов
- •3.1. Основные свойства газовых смесей
- •4. Реальные газы
- •4.1. Уравнение состояния Ван-дер-Ваальса
- •4.2. Уравнение м. П. Вукаловича и и. И. Новикова
- •Контрольные вопросы
- •5. Первый закон термодинамики
- •5.1. Внутренняя энергия
- •5.2. Работа расширения
- •5.3. Теплота
- •5.4. Аналитическое выражение первого закона термодинамики
- •5.5. Энтальпия
- •Контрольные вопросы
- •6. Теплоемкость газов. Энтропия
- •6.1. Основные определения
- •6.2. Удельная (массовая), объемная и мольная теплоемкости газов
- •6.3. Теплоемкость в изохорном и изобарном процессах
- •6.4. Молекулярно-кинетическая и квантовая теории теплоемкости
- •6.5. Истинная и средняя теплоемкости
- •6.6. Зависимость теплоемкости от температуры
- •6.7. Отношение удельных теплоемкостей ср и сυ. Показатель адиабаты
- •6.8. Определение qp и qυ для идеальных газов
- •6.9. Теплоемкость смеси идеальных газов
- •6.10. Энтропия
- •Контрольные вопросы
- •7. Термодинамические процессы идеальных газов
- •7.1. Основные определения
- •7.2. Изохорный процесс
- •7.3. Изобарный процесс
- •7.4. Изотермический процесс
- •7.5. Адиабатный процесс
- •7.6. Политропные процессы
- •Контрольные вопросы
- •8. Второй закон термодинамики
- •8.1. Основные положения
- •8.2. Круговые термодинамические процессы (циклы)
- •8.3. Термический кпд и холодильный коэффициент циклов
- •8.4. Прямой обратимый цикл Карно
- •8.5. Обратный обратимый цикл Карно
- •8.6. Математическое выражение второго закона термодинамики
- •8.7. Изменение энтропии в обратимых и необратимых процессах
- •Контрольные вопросы
- •9. Характеристические функции и термодинамические потенциалы. Равновесие систем
- •9.1. Характеристические функции состояния
- •9.2. Физический смысл изохорно-изотермического и изобарно-изотермического потенциалов
- •9.3. Термодинамическое учение о равновесии
- •9.4. Общие условия равновесия термодинамической системы
- •Контрольные вопросы
- •10. Водяной пар
- •10.1. Основные понятия и определения
- •10.2. Р, υ-диаграмма водяного пара
- •10.3. T, s-диаграмма водяного пара
- •10.4. I, s-диаграмма водяного пара
- •Контрольные вопросы
- •11. Истечение газов и паров
- •11.1. Первый закон термодинамики в применении к потоку движущегося газа
- •11.2. Работа проталкивания
- •11.3. Располагаемая работа
- •11.4. Адиабатный процесс истечения
- •11.5. Истечение из суживающегося сопла
- •11.6. Истечение идеального газа из комбинированного сопла Лаваля
- •Контрольные вопросы
- •12. Дросселирование газов и паров
- •12.1. Дросселирование газа
- •12.2. Изменение удельной энтропии и температуры при дросселировании
- •12.3. Дросселирование водяного пара
- •Контрольные вопросы
- •13. Влажный воздух
- •13.1. Параметры состояния влажного воздуха
- •13.2. Диаграмма состояния влажного атмосферного воздуха
- •Контрольные вопросы
- •14. Компрессоры
- •14.1. Классификация компрессорных машин
- •14.2. Поршневой компрессор. Индикаторная диаграмма идеального поршневого компрессора
- •14.3. Индикаторная диаграмма реального поршневого компрессора
- •14.4. Определение количества теплоты, отведенной от газа при различных процессах сжатия
- •14.5. Мощность привода и кпд компрессора
- •14.6. Многоступенчатое сжатие газа
- •Охлаждающей воды; 4, 15, 26 – вход рабочего тела – газа; 7, 18, 29 – выход сжатого газа;
- •Контрольные вопросы
- •15. Циклы тепловых двигателей с газообразным рабочим телом
- •15.1. Циклы поршневых двигателей внутреннего сгорания (двс)
- •15.2. Циклы двс с подводом теплоты при постоянном объеме
- •В изохорном процессе от степени сжатия и показателя адиабаты
- •15.3. Цикл двс с подводом теплоты при постоянном давлении (цикл Дизеля)
- •15.4. Цикл двс со смешанным подводом теплоты (цикл Тринклера)
- •15.5. Сравнение циклов поршневых двигателей внутреннего сгорания
- •15.6. Цикл двигателя Стирлинга
- •Двигателя Стирлинга при повороте коленчатого вала:
- •Объемов; 6, 7 – действительное изменение объемов
- •Контрольные вопросы
- •16. Циклы газотурбинных установок
- •16.1. Цикл гту с подводом теплоты при постоянном давлении
- •От степени повышения давления в турбокомпрессоре
- •16.2. Цикл гту с подводом теплоты при постоянном объеме
- •16.3. Методы повышения термического кпд гту
- •16.4. Цикл гту с регенерацией теплоты
- •С регенерацией и с изобарным подводом теплоты
- •С изохорным подводом теплоты и регенерацией
- •16.5. Цикл с многоступенчатым сжатием воздуха и промежуточным охлаждением
- •Сжатием в компрессоре и с регенерацией: 1 – топливный насос; 2 – камера сгорания;
- •Сжимаемого воздуха, промежуточным подогревом рабочего тела, с подводом теплоты при постоянном давлении
- •Контрольные вопросы
- •17. Теплосиловые паровые циклы
- •17.1. Цикл Карно
- •17.2. Цикл Ренкина
- •17.3. Влияние основных параметров на кпд цикла Ренкина
- •17.3.1. Влияние начального давления пара
- •17.3.2. Влияние начальной температуры пара
- •При различных значениях t1
- •17.3.3. Влияние конечного давления в конденсаторе
- •17.4. Цикл с вторичным перегревом пара
- •17.5. Регенеративный цикл паротурбинной установки
- •17.6. Теплофикационные циклы
- •Контрольные вопросы
- •18. Циклы холодильных установок
- •18.1. Основные понятия о работе холодильных установок
- •18.2. Цикл воздушной холодильной установки
- •18.3. Цикл парокомпрессионной холодильной установки
- •18.4. Цикл пароэжекторной холодильной установки
- •18.5. Цикл абсорбционной холодильной установки
- •18.6. Тепловой насос
- •Контрольные вопросы
- •Заключение
- •Библиографический список
- •Составители
7.6. Политропные процессы
Политропным называется всякий процесс идеального газа, в котором удельная теплоемкость является постоянной величиной. Кривая процесса – политропа. Частные случаи политропного процесса – изохорный, изобарный, изотермический, адиабатный, протекающие при постоянной удельной теплоемкости. Удельная теплоемкость политропного процесса сП принимает значения от +∞ до –∞. Удельное количество теплоты политропного процесса:
![]() и
и
![]() .
.
Вывод уравнения политропного процесса
на основании первого закона термодинамики
![]() и
и
![]()
Из этих уравнений
найдем
![]() Обозначив
выражение
Обозначив
выражение
 ,
получим
,
получим
 .
Интегрируя полученное выражение в
пределах начало–конец процесса, находим
.
Интегрируя полученное выражение в
пределах начало–конец процесса, находим
![]() или
или
![]() – уравнение
политропного процесса.
– уравнение
политропного процесса.
Показатель политропы n принимает для каждого процесса определенное числовое значение:
изохорный процесс: n = ±∞;
изобарный процесс: n = 0;
изотермический процесс: n = 1;
адиабатный процесс: n = k.
Поскольку уравнение политропы отличается от уравнения адиабаты только значениями показателя n, то и все уравнения, связывающие основные параметры, аналогичны:
 ;
;

Удельная
теплоемкость
политропного процесса определяется из
формулы
![]() .
Откуда
.
Откуда
![]() .
.
Данное уравнение позволяет определить удельную теплоемкость для каждого значения n. Подставив в него значения n для частных случаев, получим:
изохорный процесс: n = ±∞, сП = сυ;
изобарный процесс: n = 0, сП = k сυ;
изотермический процесс: n = 1, сП = ±∞;
адиабатный процесс: n = k, сП = 0.
Уравнение удельной работы изменения объема, совершаемой телом при политропном процессе, имеет аналогичный вид с уравнением при адиабатном процессе:
![]() .
.
Изменение удельной внутренней энергии газа и удельное количество теплоты в политропном процессе определяется по формулам:
![]()
![]()
Располагаемая внешняя работа в политропном процессе по аналогии с адиабатным процессом равна:

Изменение удельной энтальпии в политропном процессе:
![]()
Значение n может быть определено по координатам двух любых точек графика:
 ;
;  ;
;  .
.
Изменение удельной
энтропии газа
в политропном процессе определяется
по формуле:
![]()
Или для конечного
изменения состояния
 .
.
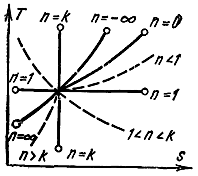
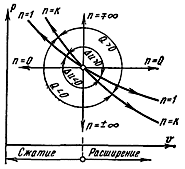
Политропный процесс на T, s-диаграмме изображается некоторой кривой, расположение которой зависит от показателя n (рис. 17). На рис. 18 показано расположение политропных процессов на p, υ-диаграмме, выходящих из одной и той же точки, в зависимости от значения показателя n.
Рис. 17. T, s-диаграмма политропного процесса |
Рис. 18. р, υ-диаграмма политропного процесса |
Изменение удельной внутренней энергии в политропных процессах следующее.
В изотермическом процессе при n = 1 удельная внутренняя энергия газа не изменяется (u2 = u1).
В изобарном процессе при n = 0 удельная внутренняя энергия увеличивается.
В изохорном процессе при n = –∞ удельная внутренняя энергия возрастает.
Отсюда можно сделать вывод, что все политропные процессы, т. е. процессы расширения, расположенные над изотермой, при n < 1, а процессы сжатия при n > 1 протекают с увеличением удельной внутренней энергии газа.
Политропные процессы, т. е. процессы расширения, расположенные под изотермой при n > 1, и процессы сжатия при n < 1 протекают с уменьшением удельной внутренней энергии газа.
Изменения знака количества теплоты политропного процесса следующие.
В адиабатном процессе теплота не подводится и не отводится.
Изохорный процесс расширения: n = –∞ – теплота подводится.
Изобарный процесс расширения: n = 0 – теплота подводится.
Изотермический процесс расширения: n = 1 – теплота подводится.
Следовательно, все политропные процессы, т. е. процессы расширения, расположенные адиабатой в пределах k > n > –∞, а процессы сжатия при ∞ > n > k протекают с подводом количества теплоты к рабочему телу.
Политропные процессы расширения при ∞ > n > k, а процессы сжатия при –∞ < n < k протекают с отводом количества теплоты.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную удельную теплоемкость, так как знак q и du в этих процессах различный. Практически это означает, что при подводе теплоты в этих процессах температура уменьшается, а при отводе – увеличивается.