
- •Лекция № 18. Водород
- •Соединения водорода
- •Литература: [1] с. 330 - 338, [2] с. 411 - 415, [3] с. 262 - 270 Лекция № 19. Элементы VII-a-подгрупы (галогены)
- •Cоединения галогенов
- •Лекция № 20. Элементы via-подгруппы
- •20.1. Кислород и его соединения
- •20.2. Сера и ее соединения
- •Соединения серы
- •20.3. Селен, теллур и их соединения
- •Литература: [1] с. 359 - 383, [2] с. 425 - 435, [3] с. 297 - 328 Лекция № 21. Элементы va-подгруппы
- •21.1. Азот и его соединения
- •Соединения азота
- •21.2. Фосфор и его соединения
- •Соединения фосфора
- •21.3. Элементы подгруппы мышьяка
- •Литература: [1] с. 383 - 417, [2] с. 435 - 453, [3] с. 328 - 371 Лекция № 22. Элементы iva-подгруппы
- •22.1. Углерод и его соединения
- •Соединения углерода
- •22.2. Кремний и его соединения
- •Соединения кремния
- •22.3. Германий, олово, свинец
- •Литература: [1] с. 417 - 435, 491 - 513, [2] с. 453 - 472, [3] с. 371 - 409 Лекция № 23. Элементы iiia-подгруппы
- •23.1. Бор и его соединения
- •Соединения бора
- •23.2. Алюминий и его соединения
- •Соединения алюминия
- •23.3. Подгруппа галлия
- •Литература: [1] с. 608 - 619, [2] с. 472 - 481, [3] с. 412 - 446 Лекция № 24. Элементы iia-подгруппы
- •24.1. Бериллий и его соединения
- •24.2. Магний и его соединения
- •22.3. Щелочноземельные металлы
- •Литература: [1] с. 587 - 599, [2] с. 481 - 486, [3] с. 447 - 460 Лекция № 25. Элементы ia-подгруппы (щелочные металлы)
- •Литература: [1] с. 543 - 551, [2] с. 486 - 489, [3] с. 461 - 470 Лекция № 26. Общая характеристика d-элементов. Элементы iiiв - vb подгрупп (подгруппы скандия,титана и ванадия)
- •26.1. Общая характеристика d-элементов
- •26.2. Элементы iiiв подгруппы (подгруппы скандия)
- •26.3. Элементы ivв подгруппы (подгруппы титана)
- •26.4. Элементы vв подгруппы (подгруппы ванадия)
- •Литература: [1] с. 619 - 633, [2] с. 489 - 523, [3] с. 478 - 481, 499 - 520 Лекция № 27. Элементы viв и viiв-подгрупп (подгруппы хрома и марганца)
- •27.1 Элементы viв-подгруппы (подгруппа хрома)
- •27.2. Элементы viiв-подгруппы (подгруппа марганца)
- •Литература: [1] с. 633 - 645, [2] с. 523 - 539, [3] с. 521 - 548 Лекция № 28. Элементы viiib-подгруппы
- •28.1. Элементы подгруппы железа
- •Соединения железа
- •28.2. Элементы подгруппы кобальта
- •28.3. Элементы подгруппы никеля
- •Литература: [1] с. 650 - 679, [2] с. 540 - 550, [3] с. 548 - 584 Лекция № 29. Элементы ib- и iib-подгрупп (подгруппы меди и цинка)
- •29.1 Элементы ib-подгруппы (подгруппы меди)
- •29.2 Элементы iib-подгруппы (подгруппы цинка)
- •Литература: [1] с. 551 - 563, 599 - 608, [2] с. 550 - 554, [3] с. 585 - 602 Лекция 30. Основы геохимии.
- •30.1. Теория строения атомных ядер. Радиоактивность.
- •30.2. Распространенность химических элементов
- •30.3. Миграция химических элементов. Факторы миграции
- •Список рекомендуемой литературы
21.1. Азот и его соединения
Азот - распространенный элемент земной коры (0,03 мол.%), представлен в природе двумя изотопами - 14N (99,6%) и 15N. Основная масса азота входит в состав атмосферы (78% по объему). Кроме этого азот образует несколько минералов, основными из которых являются: чилийская селитра - NaNO3 и индийская селитра - KNO3. Азот входит в состав живых организмов в основном в виде аминокислот, полипептидов, белков и азотистых оснований.
Образует простое вещество, состоящее из двухатомных молекул N2. Азот - бесцветный газ, без вкуса и запаха, не поддерживающий жизнедеятельность. Очень плохо растворим в воде, но под давлением растворимость азота в воде и биологических жидкостях сильно увеличивается. Растворенный под давлением азот оказывает наркотическое действие и вызывает глубоководное опьянение у водолазов. Быстрое выделение азота из крови при уменьшении давления вызывает кессонную болезнь. При охлаждении до -196 С (77 К) азот сжижается, образуя бесцветную подвижную жидкость, кристаллизующуюся при - 210 С. В кристаллическом состоянии существует в двух полиморфных модификациях.
В промышленности азот получают фракционной перегонкой жидкого воздуха. Лабораторный метод получения азота основан на термическом разложении нитрита аммония:
t
NH4NO2 N2 + 2H2O
Химические свойства. По электроотрицательности азот уступает только фтору и кислороду, однако чрезвычайная устойчивость молекулы N2 обуславливает высокую химическую инертность азота. При комнатной температуре с азотом реагирует только литий:
6Li + N2 = 2Li3N
нитрид лития
При сильном нагревании азот реагирует с другими щелочными и щелочноземельными металлами, бором и алюминием.
t
N2 + 2Al = AlN
При повышенных температурах азот реагирует с водородом и кислородом:
t, p 3000-4000 C
N2 + 3H2 2NH3; N2 + O2 2NO
Соединения азота
Соединения азота в степени окисления -3 представлены аммиаком и нитридами металлов.
Аммиак - NH3 - бесцветный газ с характерным резким запахом. Молекула аммиака имеет пирамидальное строение и содержит неподеленную пару электронов на атоме азота:

При температуре -33,4 С аммиак конденсируется, образуя жидкость с очень высокой теплотой испарения, что позволяет использовать его в качестве хладагента в промышленных холодильных установках. Жидкий аммиак хороший растворитель, в нем растворяются щелочные и щелочноземельные металлы, образуя окрашенные токопроводящие растворы. В присутствии катализатора (FeCl3) растворенный металл реагирует с аммиаком c выделением водорода и образованием амида, например:
2Na + 2NH3 = 2NaNH2 + H2
амид натрия
В атмосфере кислорода аммиак горит с образованием азота, на платиновом катализаторе аммиак окисляется до оксида азота(II):
t
4NH3 + 3O2 = 2N2 + 6H2O
t
4NH3 + 5O2 = 4NO + 6H2O
Pt
Аммиак очень хорошо растворим в воде, в которой проявляет свойства слабого основания:
NH3 + H2O NH3H2O NH4+ + OH-
 =
1,85·10-5
=
1,85·10-5
Как основание аммиак реагирует с кислотами, образуя соли катиона аммония, например:
NH3 + HCl = NH4Cl
Соли аммония хорошо растворимы в воде и слабо гидролизованы. В кристаллическом состоянии термически нестойки. Состав продуктов термолиза зависит от свойств кислоты, образующей соль:
t
NH4Cl NH3 + HCl
t
(NH4)2SO4 NH3 + (NH4)HSO4
t
(NH4)2Cr2O7 N2 + Cr2O3 + 4H2O
При действии на водные растворы солей аммония щелочей при нагревании выделяется аммиак, что позволяет использовать данную реакцию как качественную на соли аммония и как лабораторный метод получения аммиака.
t
NH4Cl + NaOH = NaCl + NH3 + H2О
В промышленности аммиак получают прямым синтезом.
p, t
N2 + 3H2 2NH3
Kat
Поскольку реакция сильно обратима, синтез ведут при повышенном давлении (до 100 мПа). Для ускорения момента наступления равновесия процесс проводят в присутствии катализатора (губчатое железо, промотированное добавками) и при температуре около 500 С.
Нитриды щелочных и щелочноземельных металлов представляют собой ионные соединения, легко разлагающиеся водой с образованием аммиака.
Li3N + 3H2O = 3LiOH + NH3
Нитриды d-металлов - кристаллические соединения переменного состава (бертолиды), очень тугоплавкие и химически устойчивые.
Гидразин - N2H4 - наиболее важное неорганическое соединение азота в степени окисления -2.

Гидразин представляет собой бесцветную жидкость, с температурой кипения 114 С, дымящуюся на воздухе. Пары гидразина чрезвычайно ядовиты и образуют с воздухом взрывообразные смеси. Получают гидразин, окисляя аммиак гипохлоритом натрия:
2NH3 + NaClO = N2H4 + NaCl + H2O
Гидразин смешивается с водой в любых соотношениях и в растворе ведет себя как слабое двухкислотное основание, образуя два ряда солей.
N2H4 + H2O N2H5+ + OH-, Kb = 9,310-7;
N2H5+ + H2O N2H62+ + OH-, Kb = 8,510-15;
N2H4 + HCl N2H5Cl; N2H5Cl + HCl N2H6Cl2
хлорид гидрозония дихлорид дигидрозония
Гидразин сильнейший восстановитель:
4KMnO4 + 5N2H4 + 6H2SO4 = 5N2 + 4MnSO4 + 2K2SO4 + 16H2O
Гидразин и его производные широко применяются в качестве ракетного топлива.
Гидроксиламин - NH2OH - основное неорганическое соединение азота в степени окисления -1.

Гидроксиламин - бесцветное кристаллическое вещество (т.пл. 33 С), хорошо растворимое в воде, в которой проявляет свойства слабого основания.
NH2OH + H2O [NH3OH]+ + OH-, Kb = 210-8
Получают гидроксиламин восстановлением азотной кислоты водородом в момент выделения при электролизе:
HNO3 + 6[H] = NH2OH + 2H2O
Атом азота в молекуле NH2OН проявляет промежуточную степень окисления (между -3 и +5) поэтому гидроксиламин может выступать как в роли восстановителя, так и в роли окислителя:
2N-1H2OH + I2 + 2KOH = N02 + 2KI + 4H2O
восстановитель
2N-1H2OH + 4FeSO4 + 3H2SO4 = 2Fe2(SO4)3 + (N-3H4)2SO4 + 2H2O
окислитель
Положительные степени окисления азот проявляет в оксидах, а также кислородсодержащих кислотах и их солях.
Оксид азота(I) - N2O(закись азота, веселящий газ). Строение его молекулы можно передать резонансом двух валентных схем, которые показывают, что рассматривать это соединение как оксид азота(I) можно только формально, реально это оксонитрид азота(V) - ON+5N-3.

N2O - бесцветный газ со слабым приятным запахом. В малых концентрациях вызывает приступы безудержного веселья, в больших дозах оказывает общее анестезирующее действие. Смесь закиси азота (80%) и кислорода (20%) используется в медицине для наркоза.
В лабораторных условиях оксид азота(I) можно получить разложением нитрата аммония:
t
NH4NO3 N2O + 2H2O
N2O, полученный данным методом, содержит примеси высших оксидов азота, которые чрезвычайно токсичны!
По химическим свойствам оксид азота(I) типичный несолеобразующий оксид, с водой, кислотами и щелочами не реагирует. При нагревании разлагается с образованием кислорода и азота. По этой причине N2O может выступать в роли окислителя, например:
t
N2O + H2 = N2 + H2O
Оксид азота(II) - NO - бесцветный газ, чрезвычайно токсичен. На воздухе быстро окисляется кислородом с образованием не менее токсичного оксида азота(IV). В промышленности NO получают, пропуская воздух через электрическую дугу (3000-4000 С).
t
N2 + O2 = 2NO
Лабораторным методом получения оксида азота(II) является взаимодействие меди с разбавленной азотной кислотой.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Оксид азота(II) - несолеобразующий оксид, сильный восстановитель, легко реагирует с кислородом и галогенами.
2NO + O2 = 2NO2; 2NO + Cl2 = 2NOCl
хлористый нитрозил
В то же время, при взаимодействии с сильными восстановителями NO выполняет функцию окислителя:
t
2NO + 2H2 = N2 + 2H2O
Оксид азота(III) - N2O3 - жидкость интенсивно синего цвета (т.кр. - 100 С). Устойчив только в жидком и твердом состоянии при низких температурах. По-видимому, существует в двух формах:

Получают оксид азота(III) совместной конденсацией паров NO и NO2. В жидкости и в парах диссоциирует.
NO2 + NO N2O3
По свойствам типичный кислотный оксид. Реагирует с водой, образуя азотистую кислоту, с щелочами образует соли - нитриты.
N2O3 + H2O = 2HNO2
N2O3 + 2NaOH = 2NaNO2 + H2O
Азотистая кислота - кислота средней силы (Ka = 110-4). В чистом виде не выделена, в растворах существует в двух таутомерных формах (таутомеры - изомеры, находящиеся в динамическом равновесии.)

нитрито-форма нитро-форма
Соли азотистой кислоты устойчивы. Нитрит-анион проявляет ярко выраженную окислительно-восстановительную двойственность. В зависимости от условий он может выполнять как функцию окислителя, так и функцию восстановителя, например:
2NaNO2 + 2KI + 2H2SO4 = I2 + 2NO + K2SO4 + Na2SO4 + 2H2O
окислитель
KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
восстановитель
Азотистая кислота и нитриты склонны к диспропорционированию:
t
3HN+3O2 = HN+5O3 + 2N+2O + H2O
Оксид азота(IV) - NO2 - бурый газ, с резким неприятным запахом, чрезвычайно токсичен! В промышленности NO2 получают окислением NO. Лабораторным методом получения NO2 является взаимодействие меди с концентрированной азотной кислотой, а также термическое разложение нитрата свинца.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
t
2Pb(NO3)2 = 2PbO + 4NO2 + O2
Молекула NO2 имеет один неспаренный электрон и является стабильным свободным радикалом. Поэтому оксид азота легко димеризуется. Процесс обратим и очень чувствителен к температуре.
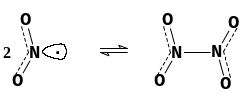
-11 C
2NO2 N2O4
+150 C
парамагнитен, диамагнитен,
бурый бесцветен
Диоксид азота - кислотный оксид, взаимодействует с водой, образуя смесь азотной и азотистой кислоты (смешанный ангидрид).
2NO2 + H2O = HNO2 + HNO3
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Оксид азота(V) - N2O5 - белое кристаллическое вещество. Получается дегидратацией азотной кислоты или окислением оксида азота(IV) озоном:
2HNO3 + P2O5 = N2O5 + 2HPO3
2NO2 + O3 = N2O5 + O2
В кристаллическом состоянии N2O5 имеет солеподобное строение - [NO2]+[NO3]-, в парах (т.возг. 33 С) - молекулярное.

N2O5 - кислотный оксид - ангидрид азотной кислоты:
N2O5 + H2O = 2HNO3
Азотная кислота - HNO3 - бесцветная жидкость с температурой кипения 84,1 С, при нагревании и на свету разлагается.
4HNO3 = 4NO2 + O2 + 2H2O
Примеси диоксида азота придают концентрированной азотной кислоте желто-бурую окраску. С водой азотная кислота смешивается в любых соотношениях и является одной из сильнейших минеральных кислот, в растворе нацело диссоциирует:
Азотная кислота - один из сильнейших окислителей. Глубина ее восстановления зависит от многих факторов: концентрация, температура, восстановитель. Обычно при окислении азотной кислотой образуется смесь продуктов восстановления:
HN+5O3 N+4O2 N+2O N+12O N02 [N-3H4]+
Превалирующим продуктом окисления концентрированной азотной кислотой неметаллов и неактивных металлов является оксид азота(IV):
I2 + 10HNO3(конц) = 2HIO3 + 10NO2 + 4H2O
Pb + 4HNO3(конц) = Pb(NO3)2 + 2NO2 + 2H2O
Концентрированная азотная кислота пассивирует железо и алюминий. Алюминий пассивируется даже разбавленной азотной кислотой. Азотная кислота любой концентрации не действует на золото, платину, тантал, родий и иридий. Золото и платина растворяется в царской водке - смесь концентрированной азотной и соляной кислот в соотношении 1 : 3:
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
Сильное окисляющее действие царской водки обусловлено образование атомарного хлора при распаде хлористого нитрозила - продукта взаимодействия азотной кислоты с хлороводородом.
HNO3 + 3HCl = Cl2 + NOCl + 2H2O
NOCl = NO + Cl
Эффективным растворителем малоактивных металлов является смесь концентрированной азотной и плавиковой кислот.
3Ta + 5HNO3 + 21HF = 3H2[TaF7] + 5NO + 10H2O
Разбавленная азотная кислота при взаимодействии с неметаллами и малоактивными металлами восстанавливается преимущественно до оксида азота(II), например:
3P + 5HNO3(разб) + 2H2O = 3H3PO4 + 5NO
3Pb + 8HNO3(разб) = 3Pb(NO3)2 + 2NO + 4H2O
Активные металлы восстанавливают разбавленную азотную кислоту до N2O, N2 или NH4NO3, например,
4Zn + 10HNO3(разб) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Соли азотной кислоты - нитраты хорошо растворимы в воде, термически неустойчивы. Разложение нитратов активных металлов (исключая литий), стоящих в ряду стандартных электродных потенциалов левее магния, приводит к образованию нитритов.
t
2KNO3 = 2KNO2 + O2
При разложении нитратов лития, магния, а также нитратов металлов, расположенных в ряду стандартных электродных потенциалов правее магния, вплоть до меди, выделяется смесь оксида азота(IV) и кислорода.
t
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Нитраты металлов, расположенных в конце ряда активности, разлагаются до свободного металла:
t
2AgNO3 = 2Ag + 2NO2 + O2
Нитраты натрия, калия и аммония широко используются для производства пороха и взрывчатых веществ, а также в качестве азотных удобрений (селитры). В качестве удобрений используют также сульфат аммония, аммиачную воду и карбамид (мочевину) - полный амид угольной кислоты H2N-C(O)-NH2. Основная масса азотной кислоты идет на производство удобрений и взрывчатых веществ.
Получают азотную кислоту в промышленности контактным или дуговым способом, которые отличаются первой стадией - получением оксида азота(II). Дуговой способ основан на получении NO при пропускании воздуха через электрическую дугу. В контактном способе NO получают окислением аммиака кислородом на платиновом катализаторе. Далее оксид азота(II) окисляется до оксида азота(IV) кислородом воздуха. Растворяя NO2 в воде в присутствии кислорода получают азотную кислоту с концентрацией 60-65%.
4NO2 + O2 + 2H2O = 4HNO3
При необходимости азотную кислоту концентрируют перегонкой с концентрированной серной кислотой. В лаборатории концентрированную азотную кислоту можно получить действием концентрированной серной кислоты на кристаллический нитрат натрия при нагревании.
t
NaNO3 + H2SO4 = HNO3 + NaHSO4
