
- •Міністерство освіти і науки, молоді та спорту україни
- •Розроблено:
- •2. Виконавець:
- •Рідкий стан речовини. Поверхневий натяг, в'язкість.
- •Твердий стан речовини. Кристалічний і аморфний стан.
- •Запитання до семінару.
- •Методичні вказівки.
- •Перший закон термодинаміки.
- •Закон Гесса і наслідки з нього.
- •II закон термодинаміки.
- •Запитання до семінару.
- •Методичні вказівки.
- •Загальна характеристика і властивості розчинів
- •Фізичні властивості розчинів, дифузія, осмос.
- •Закони Рауля для відносного зниження тиску над розчином
- •Закон Рауля для підвищення температури кипіння і зниження температури замерзання
- •Запитання до семінару.
- •Методичні вказівки.
- •Хімічна рівновага. Принцип Ле – Шательє
- •Типи хімічних реакцій
- •Каталіз.
- •Запитання до семінару.
- •Методичні вказівки.
- •Електрорушійні сили. Гальванічний елемент.
- •Для виділення 1 кг речовини, потрібно пропустити через електроліт одну й ту ж кількість електрики, її позначають буквою f і називають числом Фарадея.
- •Запитання до семінару.
- •Методичні вказівки.
- •Поверхневі явища. Сорбційні процеси, їх класифікація, адсорбція на межі різноманітних фаз.
- •Отримання колоїдних систем різними методами.
- •Методи очищення дисперсних систем.
- •Запитання до семінару.
- •Методичні вказівки.
- •Будова міцели золю.
- •Коагуляція гідрофобних золей електролітами. Поріг коагуляції. Практичне застосування коагуляції
- •Запитання до семінару.
- •Методичні вказівки.
- •Грубодисперсні (мікрогетерогенні) системи – емульсії.
- •Запитання до семінару.
- •Перелік літератури
Хімічна рівновага. Принцип Ле – Шательє
Необоротні реакції після завершення реакції не можуть утворювати вихідні речовини Zn + 2HNO3 Zn (NO3)2 + H2. Більшість відомих реакцій є оборотними.
N2 + 3H2 2NH3
На початку швидкість прямої реакції (V1) велика, a V2 = 0, з часом V1 зміщується, a V2 збільшується. Коли V1 = V2 ( при t = const) наступає хімічна рівновага.
V1 = k1 [N2] [H2]3
V2 = k2 [NH3]2
При рівновазі:
V1 = V2
k1 [N2] [H2]3 = k2 [NH3]2
![]()
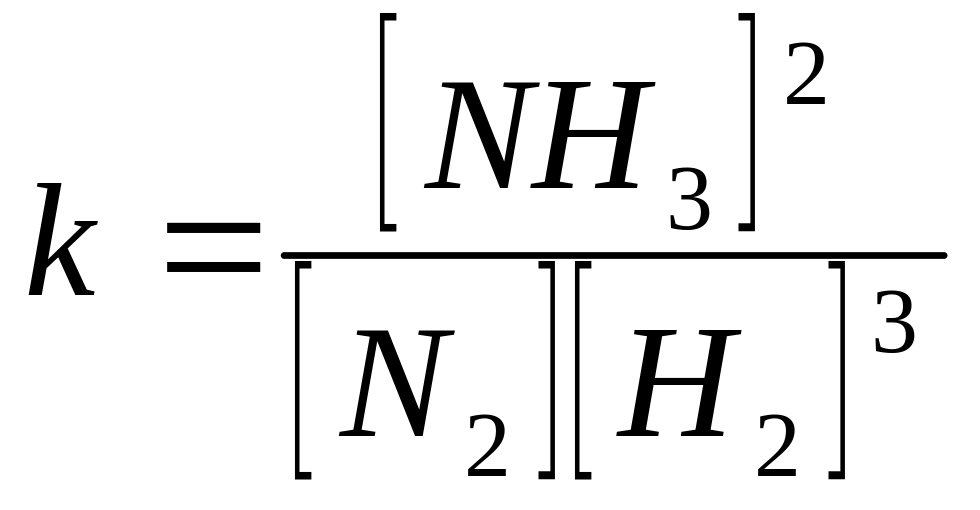 -
константа
хімічної рівноваги
-
константа
хімічної рівноваги
mA + nB = pС + qD
![]() -
математичний вираз закону діючих мас.
-
математичний вираз закону діючих мас.
Направлення зміщення рівноваги в загальному вигляді визначається
принципом Ле - Шатальє. Якщо змінити одну з умов, при яких система знаходиться в рівновазі, то рівновага буде змінюватися у напрямку реакцій, протилежних зовнішніх дій.
Типи хімічних реакцій
Молекулярність та порядок реакції
Молекулярність визначається mіn числом молекул.
Мономолекулярні І2 І +І; N2O5 2NO2 + 1/2O2
Одна молекула А В + С ... V = kC
Біомолекулярні Н2 + І2 = 2НІ ∙ СН3СООН + C2H5OH CH3COO C2H5 + Н2О
2 молекули А + В АВ V = kC1C2
Тримолекулярні 4NO + O2 + 3H2 NO2 + N2O + 3H2O
3 молекули А + В + С = Д + Е + FV = kC1C2C3
Сполучені реакції - чи індуцировані реакції. Деякі хімічні взаємодії не протікають за сумарним рівнянням, а проходять через ряд проміжних процесів.
HBrO3 + 3H2SO3 = 3H2SO4 + HBr
HBrO3 + H2SO3 = H2SO4 + HBrO2
HBrO2 + H2SO3 = H2SO4 + HBrO
HBrO + H2SO3 = H2SO4 + HBr
HBrO4 - актор
H2SO3 - індуктор
в окислювальне - відновних процесах
Ланцюгові реакції: протікають через ряд зв'язаних між собою елементарних процесів. Кожний такий процес викликається активною часткою (збуджена молекула, вільний атом, радикал, позитивний чи негативний - іон.) Довжина ланцюга вимірюється числом ланок.
Швидкість реакції збільшується, може привести до вибуху, горіння:
СІ2 + nV = СІ. + СІ.
СІ. + Н2 = НСІ + Н.
Н. + СІ2 = КСІ + СІ.
СІ. + СІ. = СІ2
Н. + Н. = Н2
Каталітична реакція
Каталізатором називається речовина, яка прискорює реакцію, беручи участь в елементарній стадії, але виходить з такої взаємодії хімічно незмінною.
Радикальні реакції перебігають через проміжне утворення вільних радикалів та атомів. Вільними радикалами є частинки, які характеризуються наявністю неспарених електронів. Вільними радикалами можуть бути вільні атоми (Н, СІ∙), а також молекули NO, NO2.
Фотохімічні реакції – хімічні реакції, зумовлені поглинанням реагуючими речовинами світлової енергії. Фотохімічною реакцією є реакція утворення озону з кисню. Також прикладом фотохімічної реакції є реакція синтезу хлороводню з водню та хлору; синтез рослинами складних органічних речовин в процесі їх життєдіяльності (фотосинтез).
Каталіз.
Зміну швидкості хімічної реакції у присутності додаткових речовин – каталізаторів, називають каталізом.
Каталізатором називається речовина, яка прискорює реакцію, беручи участь в елементарній стадії, але виходить з такої взаємодії хімічно незмінною. Каталізатори частіше за все прискорюють реакцію. У цьому випадку каталіз називають позитивним. Каталізатори, які уповільнюють хід хімічного процесу, називають інгібіторами.
Каталізатор відрізняються вибірковою дією, тому їх називають специфічними, тому що даний каталізатор може впливати тільки певний вид реакції.
Три види каталізу:
При гомогенному каталізі реагуючі речовини і каталізатор знаходяться в одній фазі. Дія каталізатора заклечається в тому, що він з вхідними речовинами утворює нестійкі проміжні сполуки. Наприклад:
А + В = АВ
в присутності каталізатора К можна представити як процес, який протікає по наступним стадіям:
1. А + К = АК (проміжна сполука);
2. АК + В = АВ + К.
Приклад утворення складного ефіру: С2Н5ОН + СН3СООН = СН3СООС2Н5 + Н2О йде роки. Якщо використовувати розчинену НСІ чи H2SO4 + t, то реакція відбувається в 2 - 3 години.
При гетерогенному каталізі реакції протікають на поверхні каталізатора площа поверхневого шару каталізатора та його будова визначає активність каталізатора. Для збільшення площі поверхневого шару каталізатора звичайно придають пористу структуру або його наносять тонким шаром на другу хімічно нейтральну речовину (пензу, азбест). Каталізатори другого типу називають нанесеними, а нейтральну речовину - носієм. Каталітичною активністю володіє не вся площа, а тільки її активні центри. Наявність активних центрів на поверхні каталізатора підтверджується високою чутливістю каталізатора. Весь каталітичний процес розбивають на 5 послідовно протікаючи стадій:
дифузія молекул реагуючих речовин до поверхні каталізатора;
адсорбція молекул реагуючих речовин на поверхні каталізатора;
хімічна реакція;
десорбція молекул продуктів реакції;
дифузія молекул продуктів реакції з поверхні каталізатора в рідку або газову фазу.
Всі ці стадії можуть відбуватися з різними швидкостями, тому швидкість всього каталітичного процесу визначається його найбільш повільною стадією. Наприклад: контактний спосіб отримання H2SO4 (SO2 окислюють О2 за участю V2 O5 в суміші з H2SO4 ).
Ферментативний каталіз - під дією ферментів. Наприклад: обмін речовин в організмі.
Для каталізаторів характерна специфічність дії: кожний каталізатор здатний впливати не на будь-яку реакцію, а лише на певну, або на групу реакцій, схожих за механізмом.
