
Тест
контроля знаний по дисциплине «Физическая химия»
для специальности 150101
1. Система не может обмениваться с окружающей средой веществом, но может обмениваться с ней энергией и работой.
1) Открытая 3) Изолированная
2) Закрытая 4) Дисперсная
2. Поверхностное натяжение жидкости с повышением температуры:
1) Увеличивается 3) Уменьшается
2) Не изменяется 4) Равномерно распределяется по всему объёму
3. Изобарно изотермический потенциал (энергию Гиббса) вычисляют:
1) ∆G = ∆H - T∆S
2) ∆G = ∆H + T∆S
3) ∆F = ∆U - T∆S
4)∆G=АH-ТS;
4. Какое соотношение представляет собой
константу равновесия Кр для
химического равновесия, описываемого
уравнением реакции 2NO(г)
+ O2(г)
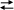 2NO2(г)?
2NO2(г)?
1)
![]() 3)
3)
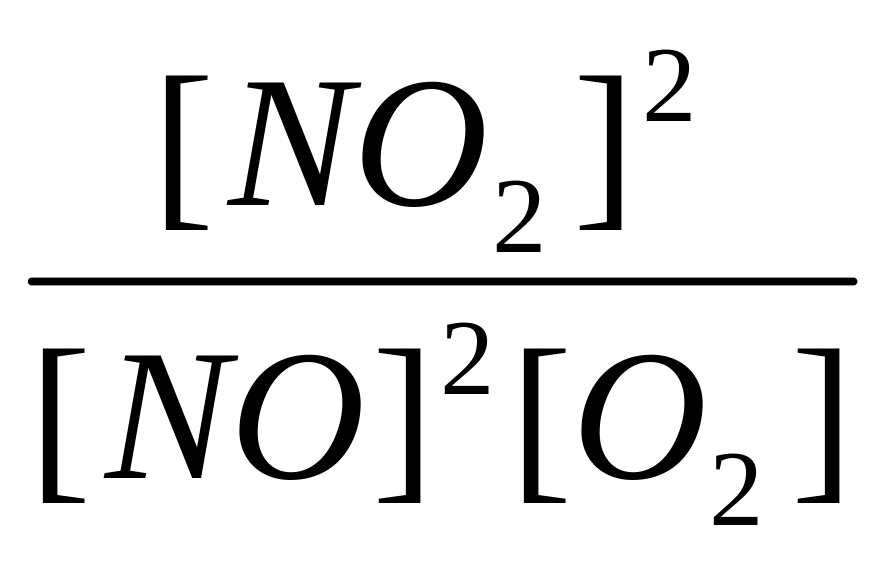
2)
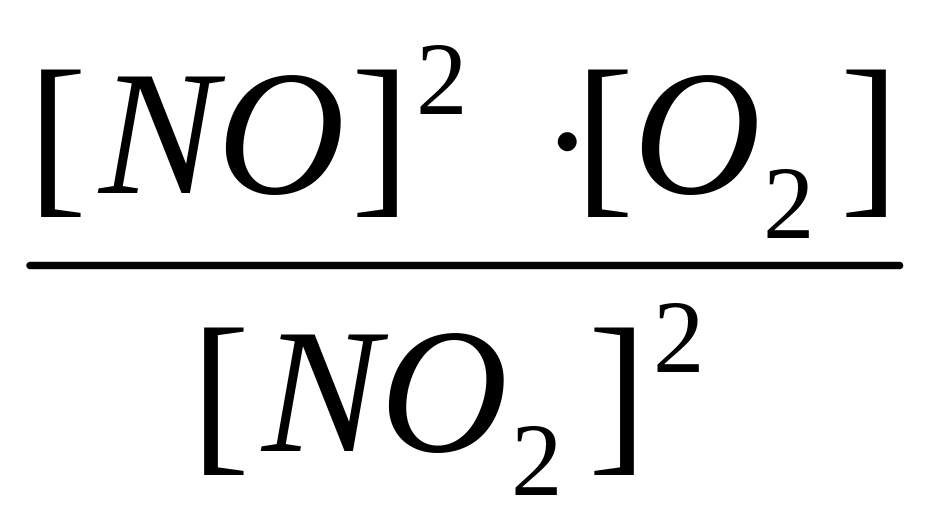 4)
4)
![]()
5. Равновесие реакции Fe3O4 + 4CO 3Fe + 4CO2 – 43,7 кДж смещается влево при:
1) Понижении температуры 3) Уменьшении давления
2) Повышении температуры 4) Увеличения давления
6. Уравнение правила фаз для гетерогенной системы:
1) С = К – Ф 3) Ф + С = К - 2
2) Ф – С = К + 2 4) С = К – Ф+ 2
7. Суспензиями называются такие дисперсные системы, в которых:
1) Газообразные частицы распределены в жидкости
2) Газообразные частицы распределены в газе
3) Жидкость раздроблена в другой не растворяющей её жидкости
4) Твёрдые частицы распределены в жидкости
8. Математическое выражение первого закона термодинамики:
1) Q = ∆U + A 3) A = Q + ∆U
2) ∆U = Q + A 4)∆H=TAS
9. Вязкость жидкости уменьшается:
1) При понижении температуры
2) При повышении температуры
3) При постоянной температуре
4) При замерзании
10. Внутренняя энергия не включает в себя:
1) Кинетическую энергию молекул
2) Энергию движения атомов в молекулах
3) Энергию электронов в атомах
4) Кинетическую энергию движения самого тела
11. При повышении давления равновесие системы, описываемое уравнением
N2(г) + 3H2(г) 2NH3(г) сдвигается таким образом, что:
1) Образуется больше NH3(г)
2) Образуется больше N2(г)
3) Образуется больше N2(г) и Н2(г)
4) Никаких изменений в количествах реагентов и продуктов реакции не наблюдается
12. Как запишется выражение для скорости реакции 2А + Б → В, если считать, что она идёт в одну стадию:
1) V = K[Б] 3) V = K[А][Б]
2) V = K[А]2 4) V = K[А]2[Б]
13. Условие возможности самопроизвольного протекания физического или химического процесса при постоянном давлении:
1) ∆G > 0 3) ∆G = 0
2) ∆G < 0 4) ∆G = 1
14. Линия ликвидуса отвечает температурам:
1) Начала кристаллизации
2) Плавления 3) Кипения 4) Конца кристаллизации
15. Кристаллические решётки, построенные из положительно заряженных ионов, в промежутках между которыми находятся валентные электроны относятся к:
1) Атомным 3) Ионным
2) Молекулярным 4) Металлическим
16. Теплоёмкость – способность веществ:
1) Поглощать теплоту при нагревании
2) Выделять теплоту при нагревании
3) Поглощать теплоту при охлаждении
4) Выделять теплоту при охлаждении
17. Линия солидуса – отвечает температурам:
1) Кипения
2) Полного отвердевания
3) Плавления
4) Начала кристаллизации
18. Эмульсиями называются дисперсные системы, в которых:
1) Газообразные частицы распределены в жидкости
2) Газообразные частицы распределены в газе
3) Жидкость раздроблена в другой не растворяющей её жидкости
4) Твёрдые частицы распределены в жидкости
19. Под нормальными условиями (н.у.) подразумевают следующие значения давления и температуры:
1) р=101,З атм;Т=298К; 2) р=760 мм рт.ст.;Т=100 °С; 3) р=1,013Па; Т=0°С; 4) р=101,ЗкПа; Т=0°С;
20.Укажите выражение для расчёта энтальпии в условиях равновесия: 1) ∆G=АH-ТS; 2) ∆H=TAS; 3) ∆F=∆U-TS; 4) ∆H=∆U+PV; 21. Какое значение свободной энергии Гиббса предполагает наступление равновесия в закрытой системе? 1) ∆G > 0 3) ∆G = 0
2) ∆G < 0 4) ∆G = 1
22. ВЗАИМНЫЕ ПЕРЕХОДЫ ТЕПЛОТЫ И РАБОТЫ ИЗУЧАЕТ
1) электрохимия
2) химическая кинетика
3) фотохимия
4) термодинамика
23. РЕАКЦИИ, ПРОТЕКАЮЩИЕ ЧЕРЕЗ РЯД ПОСЛЕДОВАТЕЛЬНЫХ СТАДИЙ, НАЗЫВАЮТ
1) параллельными
2) последовательными
3) сопряженными
4) цепными
24. КУДА СМЕСТИТСЯ РАВНОВЕСИЕ В СИСТЕМЕ 3Fe(Т) + 4H2O(Г) 4H2(Г) + Fe2O3(Т), ΔH = 25,1 кДж/МОЛЬ ПРИ УВЕЛИЧЕНИИ КОНЦЕНТРАЦИИ ВОДОРОДА
1) вправо
2) влево
3) не изменится
4) реакция не будет протекать
25. Растворы-это
1) однокомпонентные гомогенные системы
2) многокомпонентные гомогенные системы
3) новые химические вещества
4) системы, при образовании которых совершается работа
26. РАСТВОР КИПИТ ПРИ ТЕМПЕРАТУРЕ
1) большей температуры кипения растворителя
2) равной температуре кипения растворителя
3) ниже температуры кипения чистого растворителя
4) температуре равной нулю
27. ФАЗА – ЭТО
1) гомогенная часть гетерогенной системы
2) совокупность частей системы в одинаковом агрегатном состоянии
3) части системы с одинаковым химическим составом
4) совокупность гомогенных частей системы с одинаковым химическим составом и физическими свойствами
28. В ПРОВОДНИКАХ ПЕРВОГО РОДА НОСИТЕЛЯМИ ЭЛЕКТРИЧЕСТВА ЯВЛЯЮТСЯ
1) ионы
2) молекулы
3) электроны
4) радикалы
29. ПРИМЕРОМ ПРОВОДНИКА ВТОРОГО РОДА ЯВЛЯЕТСЯ
1) расплав хлорида натрия
2) медь
3) алюминий
4) вольфрам
30. МЕРОЙ БЕСПОРЯДКА ТЕРМОДИНАМИЧЕСКОЙ СИСТЕМЫ ЯВЛЯЕТСЯ
1) энтропия
2) энтальпия
3) внутренняя энергия
4) температура
31. СКОРОСТИ И МЕХАНИЗМЫ ПРОТЕКАНИЯ РЕАКЦИЙ ИЗУЧАЕТ
1) электрохимия
2) химическая кинетика
3) Фотохимия
4) термодинамика
32. ЭЛЕКТРИЧЕСКАЯ ЛАМПОЧКА ЯВЛЯЕТСЯ
1) открытой термодинамической системой
2) закрытой термодинамической системой
3) изолированной термодинамической системой
4) не является термодинамической системой
33. КАКАЯ ИЗ ТЕРМОДИНАМИЧЕСКИХ ВЕЛИЧИН ПРИ СТАНДАРТНЫХ УСЛОВИЯХ НЕ РАВНА НУЛЮ
1) энтропия
2) Энтальпия
3) энергия Гиббса
4) энергия Гельмгольца
34.ПОВЕРХНОСТНО - АКТИВНЫЕ ВЕЩЕСТВА
1) понижают поверхностное натяжение
2) не изменяют поверхностное натяжение
3) вызывают коллоидную защиту
4) увеличивают поверхностное натяжение
35.В ПРОВОДНИКАХ ВТОРОГО РОДА НОСИТЕЛЯМИ ЭЛЕКТРИЧЕСТВА ЯВЛЯЮТСЯ
1) ионы 2) молекулы
3) электроны 4) радикалы
36.МНОГОКОМПОНЕНТНАЯ СИСТЕМА – ЭТО СИСТЕМ ОБРАЗОВАННАЯ
1) одним компонентом
2) двумя компонентами
3) большим числом компонентов
4) больше чем одним компонентом
37. ЕДИНИЦЕЙ ТЕМПЕРАТУРЫ ЯВЛЯЕТСЯ
1) Джоуль
2) Кельвин
3) Ватт
4) Килограмм
38. СОРБЕНТОМ НАЗЫВАЕТСЯ
1) поглощаемое вещество
2) твердые тела или жидкости, способные поглощать вещества из окружающей среды
3) процесс диффузии вещества в объеме
4) поступление питательных веществ через мембрану
39. АЭРОЗОЛИ – ДИСПЕРСНЫЕ СИСТЕМЫ ТИПА
1) жидкость в газе
2) твердое в жидком
3) жидкость в жидкости 4) газ в твердом
40. РАСТВОР ЗАМЕРЗАЕТ ПРИ
1) температуре замерзания растворителя
2) температуре замерзания вещества
3) температуре ниже температуры замерзания растворителя
4) температуре выше температуры замерзания растворителя
41. Автор теории электролитической диссоциации;
1) Кольрауш
2) Оствальд
3) Сванте Аррениус
4) Менделеев
42.СКОРОСТЬ ГОМОГЕННОЙ ХИМИЧЕСКОЙ РЕАКЦИИ НЕ ЗАВИСИТ ОТ
1) температуры
2) концентрации реагирующих веществ
3) наличия катализатора
4) формы реактора
43. РЕАКЦИИ, В ХОДЕ КОТОРЫХ ОДНИ И ТЕ ЖЕ ВЕЩЕСТВА ОДНОВРЕМЕННО РЕАГИРУЮТ С ОБРАЗОВАНИЕМ РАЗНЫХ ПРОДУКТОВ, НАЗЫВАЮТ
1) параллельными
