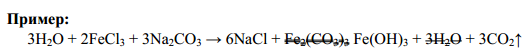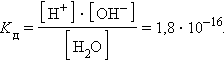- •Некоторые методы определения атомных масс химических элементов
- •1. Метод Авогадро
- •2. Метод Канниццаро
- •3. Метод Менделеева
- •4. Метод Дюлонга и Пти
- •Факторы, влияющие на скорость химической реакции
- •Способы выражения константы равновесия
- •Стандартная константа равновесия
- •Константа равновесия реакций в гетерогенных системах
- •Смещение химического равновесия
- •Влияние температуры
- •Влияние давления
- •Влияние концентрации
- •Классификация растворов
- •Концентрация растворов
- •Закон Вант-Гоффа
- •Коллигативные свойства растворов электролитов
- •Растворы сильных электролитов
- •Мнимая степень диссоциации
- •Водородный показатель pH
- •Степень гидролиза
- •Виды окислительно-восстановительных реакций
- •Классификация комплексных соединений. Основные способы их получения
- •Так же встречается классификация по
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •Изомерия координационных соединений
- •Пространственная (геометрическая) изомерия
- •Оптическая изомерия
- •Номенклатура
- •Химическая связь в комплексных соединениях.
Мнимая степень диссоциации
Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать для них изотонический коэффициент, равный количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако в действительности этот коэффициент всегда меньше определённого по формуле. Это объясняет теория сильных электролитов, разработанная в 1923 году П. Дебаем и Э. Хюккелем: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные притягиваются, а одноимённо заряженные — отталкиваются; силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами илиионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле, ведь свобода их перемещения ограничена. Наиболее очевиден пример, касающийся электропроводности растворов λ, которая возрастает с разбавлением раствора. Через отношение реальной электропроводности к таковой при бесконечном разбавлении определяют мнимую степень диссоциации сильных электролитов, также обозначаемую через α:
![]() ,
,
где nimg — мнимое, а ndisslv. — реальное количество частиц в растворе.
19
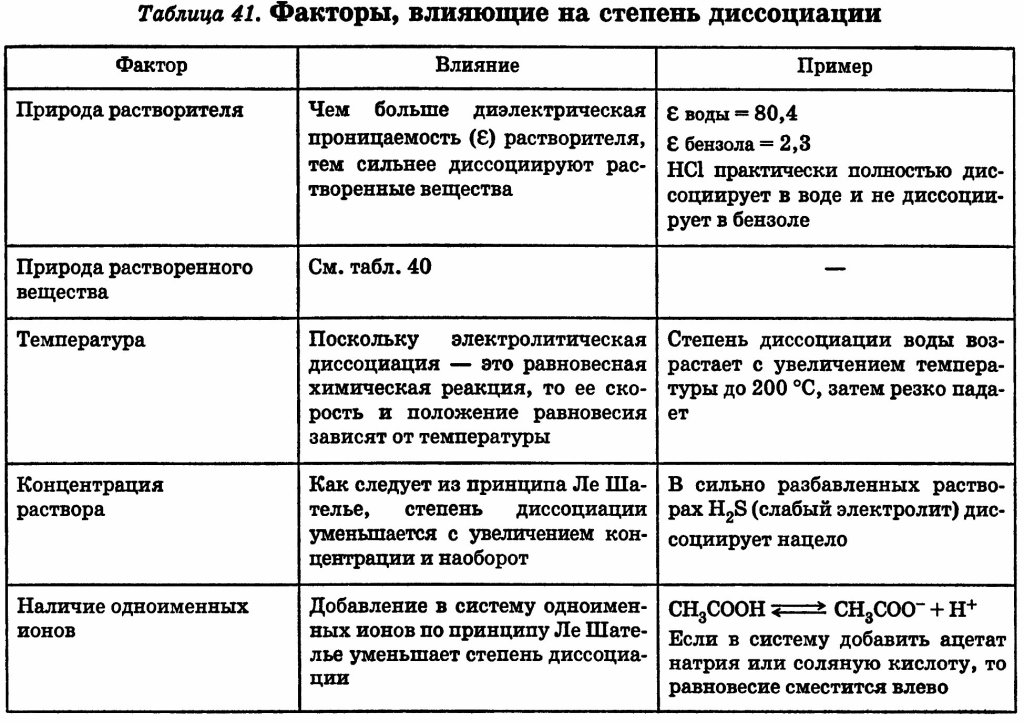
Диссоциация молекул воды. Ионное произведение воды (Кb) Водородный (рН) и гидроксильный (рОН) показатели среды. Индикаторы. Определение рН среды в растворах слабых и сильных электролитов. Буферные растворы. Равновесие в буферных растворах. рН буферного раствора
Важное значение имеет диссоциация воды, поскольку, являясь слабым электролитом и обычным растворителем, она участвует в кислотно-основном равновесии растворенных в ней электролитов.
Вода диссоциирует на ионы:
|
|
|
ее константа при 298 K равна
|
|
|
При столь малой константе диссоциации концентрация воды остается практически неизменной и равной
|
|
|
Отсюда произведение постоянных величин Kд∙[H2O] = [H+]∙[OH–] = const.
Численная величина произведения ионов, на которые диссоциирует вода, называемое ионным произведением водыKв, равна
|
|
|
Таким образом, в пределах 15–25 °C ионное произведение воды Kв = 10–14.
Равенство [H+] и [OH–] соответствует нейтральной среде [H+] = [OH–] = 1 ∙ 10–7, при [H+] > 1 ∙ 10–7 – кислой, при [H+] < 1 ∙ 10–7 – щелочной.
Водородный показатель pH
Для определения кислотно-основных свойств раствора пользуются водородным показателем pH. По определению, это отрицательный десятичный логарифм концентрации водородных ионов: pH = –lg [H+].
Очевидно, –lg [H+][OH–] = –lg 1 ∙ 10–14 дает pH + pOH = 14.
Тогда pH < 7 указывает на кислую среду, pH > 7 соответствует щелочной среде, pH = 7 – нейтральной среде.
Поскольку pH + pOH = 14, можно видеть, что pH может меняться от небольших отрицательных значений до величин, немного превышающих 14 (pH NaOH c C = 2 равен 14,3).
Индика́тор (лат. indicator – указатель) — соединение, позволяющее визуализировать изменение концентрации какого-либо вещества или компонента, например, в растворе при титровании, или быстро определить pH и др. параметры. Существуют также химические индикаторы для самых различных специальных целей, например, для определения дозы облучения. Индикаторы позволяют быстро и достаточно точно контролировать состав жидких или газообразных сред, следить за изменением их состава, или за протеканием химической реакции.
Широко используются кислотно-основные индикаторы, разбавленные растворы которых обладают способностью заметно изменять цвет, в зависимости от кислотности раствора. Причина изменения цвета - изменения в строении молекул индикатора в кислой и щелочной среде, что приводит к изменению спектра поглощения раствора.
Для определения состава газовых сред используют индикаторные бумажки и индикаторные трубки.
Виды индикаторов
Кислотно-основные индикаторы
Редокс-индикаторы, Ох- и Red-формы которых имеют различный цвет
Металлоиндикаторы
Адсорбционные индикаторы
Расчет рН растворов сильных и слабых электролитов
(кислот и оснований)
Сильные электролиты – все кислоты и основания, константы ионизации которых больше 10–2.
В водных растворах концентрации ионов Н+ и ОН– взаимосвязаны выражением ионного произведения воды
Кв = Кд[H2O] = 1,810–1655,49 = 10–14
[H+] [OH–] = 10–14
В чистой воде или нейтральном растворе
[H+] = [OH–] = 10–7 моль/л
В кислой среде
[H+] > 10–7, [OH–] < 10–7
В щелочной среде
[H+] < 10–7, [OH–] > 10–7
Для расчета концентрации ионов Н+ или ОН– используют значение отрицательного логарифма, который называется водородным или гидроксильным показателем соответственно
рН = –lg[H+] pOH = –lg[OH–]
Так как [H+] [OH–] = 10–14, то для водных растворов выполняется соотношение
рН + рОН = 14
В растворах сильных электролитов (~1) молярная концентрация ионов Н+ и ОН– практически равна молярной концентрации кислоты или основания и определяется как
[H+] = Ск–ты ~ Cк–ты, [ОН–] = Сосн ~ Cосн
Для количественной характеристики реакции среды раствора сильного электролита используется водородный показатель
рН = –lga(H+),
где а(Н+) – активность ионов водорода, определяется как
а(Н+) = (Н+)∙[Н+],
где [Н+] – равновесная молярная концентрация ионов Н+, (Н+) – коэффициент активности ионов водорода, определяемый по правилу ионной силы (определяется из таблиц).
Для расчета рН щелочей используют соотношение
рН = 14 – рОН,
где рОН = –lga(OH-).
Буферные растворы (англ buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободнойсильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях. Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор,боратный буферный раствор, формиатный буферный раствор и др.).
Равновесия в буферных системах
Растворы, способные сохранять практически постоянное значение рН при разбавлении, при добавлении небольшого количества сильных кислот или щелочей, называют буферными растворами, или буферными смесями.
К таким растворам относят смеси сопряженных кислот и оснований. Например:
CH3COOH кислота |
+ |
CH3COONa сопряженное основание |
NH4OH основание |
+ |
NH4Cl сопряженная кислота |
Буферными свойствами обладают смеси, состоящие:
из слабой кислоты и ее соли (ацетатный, формиатный, бензоатный буферные растворы);
из слабого основания и его соли (аммонийный буферный раствор);
из кислых солей с различной замещенностью водорода металлом (фосфатный буфер). В фосфатном буферном растворе NaH2PO4 играет роль слабой кислоты, Na2HPO4 – сопряженного основания (соль слабой кислоты);
из слабой многоосновной кислоты и кислой соли этой кислоты (сопряженное основание), например: H3PO4 +KH2PO4;
из кислой соли (кислоты) и средней соли (сопряженного основания), например: NaHCO3 + Na2CO3, и т. д.
Варьируя концентрацию кислоты и сопряженного с ней основания, удается получить буферные растворы с заданным значением рН.
При проведении аналитических операций иногда возникает необходимость поддерживать в исследуемом растворе определенное значение рН среды. С этой целью используют различные буферные системы, способные поддерживать постоянное значение рН.
Сущность буферного действия заключается в том, что одно из соединений, входящих в состав буферной системы, сможет связывать ионы водорода, а другое – гидроксид-ионы в малодиссоциируемые соединения. Если к ацетатному буферному раствору (CH3COOH+CH3COONa) прибавить небольшое количество NaOH, то последний нейтрализуется избытком CH3COOH, образуя H2O. Вместо израсходованных Н + - ионов уксусная кислота, диссоциируя, дает новые. В результате рН раствора изменяется незначительно.
Когда к ацетатному буферному раствору добавляется небольшое количество сильной кислоты, анионы CH3COO-, соединяясь с ионами Н+ сильной кислоты, образуют молекулы слабо диссоциирующей CH3COOH. Таким образом, сильная кислота заменяется слабой уксусной, и концентрация Н+ изменяется мало.
Рассмотрим вывод расчетной формулы рН буферной смеси на примере смеси, состоящей из слабой кислоты и сопряженного основания (соли слабой кислоты), используя З.Д.М. и учитывая влияние сопряженного основания.
Диссоциация соли:
MeAn Me+ + An-
C соли |
C соли |
C соли |
Диссоциация слабой кислоты в присутствии соли слабой кислоты:
HAn H+ + An-
Общая равновесная концентрация An- будет складываться из концентрации An- за счет диссоциации кислоты, которую обозначим , и концентрации An- за счет диссоциации соли Ссоли.
Примем x <<
Ссоли и x << Скисл , тогда
выражение для константы диссоциации
слабой кислоты примет следующий вид:
![]() ,
,
![]()
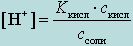 ;
; ![]()
Для буферной системы, состоящей из слабого основания и сопряженной кислоты (соли слабого основания), используя те же рассуждения, можно получить следующее выражение для расчета рН:
![]() Значение pH буферного
раствора можно рассчитать по формуле:
Значение pH буферного
раствора можно рассчитать по формуле: ![]() ,
где
,
где ![]() это
отрицательный десятичный логарифм от
константы диссоциации кислоты
это
отрицательный десятичный логарифм от
константы диссоциации кислоты ![]() .По
сути
.По
сути ![]() .
Количественной величиной, характеризующей
способность буферных растворов
поддерживать постоянное значение рН
при добавлении к ним сильных кислот и
щелочей является, буферная емкость (β).
.
Количественной величиной, характеризующей
способность буферных растворов
поддерживать постоянное значение рН
при добавлении к ним сильных кислот и
щелочей является, буферная емкость (β).
Количество молей сильной кислоты или щелочи, прибавление которых к одному литру буферного раствора изменяет его рН на единицу, называется буферной емкостью (β):
![]()
Максимальная буферная емкость обычно наблюдается у тех растворов, которые содержат равные концентрации слабой кислоты и ее соли, слабого основания и его соли. Буферная емкость тем больше, чем выше концентрация компонентов буферной смеси.
20
Гидролиз солей. Гидролиз по катиону,аниону, катиону и аниону . Смешанный
гидролиз двух солей. Гидролиз, как равновесный процесс. Константа и степень гидролиза. Смещение равновесия при гидролизе. Примеры
Гидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, жиры и др. имеет существенные различия.
Гидролиз солей
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
При растворении в воде солей, как правило, происходит изменение рН, если соль подвергается гидролизу. Гидролиз соли – это процесс взаимодействие ионов соли с ионами воды, в результате которого происходит связывание ионов воды (Н+ и ОН-) в малодиссоциирующие соединения.
Гидролизу подвергаются соли, образованные слабым основанием и сильной кислотой (NH4Cl; CuSO4; Fe(NO3)2 и др.), сильным основанием и слабой кислотой (Na2CO3; K2S; Ca(NO2)2 и др.), слабым основанием и слабой кислотой ((NH4)2CO3; (CH3COO)2Cu и др.) т.е. те, которые при взаимодействии с водой образуют слабый электролит или ионы плохо диссоциирующие в дальнейшем.
Соли образованные сильным основанием и сильной кислотой гидролизу не подвергаются (KCl; Ca(NO3)2; Na2SO4).
Различают обратимый и необратимый гидролиз солей:





Важно помнить!!
Если реагируют две соли: одна из них образована слабым основанием и сильной кислотой,
а другая сильным основанием и слабой кислотой, то необходимо учесть, что в результате
реакции соль, образованная слабым основанием и слабой кислотой, может не получиться из-за
гидролиза.