
- •Некоторые методы определения атомных масс химических элементов
- •1. Метод Авогадро
- •2. Метод Канниццаро
- •3. Метод Менделеева
- •4. Метод Дюлонга и Пти
- •Факторы, влияющие на скорость химической реакции
- •Способы выражения константы равновесия
- •Стандартная константа равновесия
- •Константа равновесия реакций в гетерогенных системах
- •Смещение химического равновесия
- •Влияние температуры
- •Влияние давления
- •Влияние концентрации
- •Классификация растворов
- •Концентрация растворов
- •Закон Вант-Гоффа
- •Коллигативные свойства растворов электролитов
- •Растворы сильных электролитов
- •Мнимая степень диссоциации
- •Водородный показатель pH
- •Степень гидролиза
- •Виды окислительно-восстановительных реакций
- •Классификация комплексных соединений. Основные способы их получения
- •Так же встречается классификация по
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •Изомерия координационных соединений
- •Пространственная (геометрическая) изомерия
- •Оптическая изомерия
- •Номенклатура
- •Химическая связь в комплексных соединениях.
Концентрация растворов
Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные.
К безразмерным концентрациям (долям) относятся следующие концентрации:
Массовая доля растворенного вещества W (B) выражается в долях единицы или в процентах:
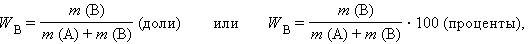
где m (B) и m (A) – масса растворенного вещества B и масса растворителя A.
Объемная доля растворенного вещества σ (B) выражается в долях единицы или объемных процентах:

где Vi – объем компонента раствора, V (B) – объем растворенного вещества B. Объемные проценты называют градусами*).
*) Иногда объемная концентрация выражается в тысячных долях (промилле, ‰) или в миллионных долях (млн–1), ppm.
Мольная доля растворенного вещества χ (B) выражается соотношением
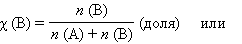
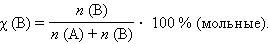
Сумма мольных долей k компонентов раствора χi равна единице
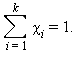
К размерным концентрациям относятся следующие концентрации:
Моляльность растворенного вещества Cm (B) определяется количеством вещества n (B) в 1 кг (1000 г) растворителя, размерность моль/кг.
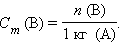
Молярная концентрация вещества B в растворе C (B) – содержание количества растворенного вещества B в единице объема раствора, моль/м3, или чаще моль/литр:
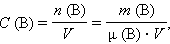
где μ (B) – молярная масса B, V – объем раствора.
Молярная концентрация эквивалентов вещества B CЭ (B) (нормальность – устаревш.) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр–1:
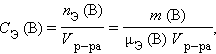
где nЭ (B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента.
Титр раствора вещества B (TB) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора:
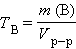 г∙мл–1 или
г∙мл–1 или
-
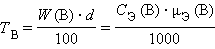 г∙мл–1.
г∙мл–1.
Массовые концентрации (массовая доля, процентная, моляльная) не зависят от температуры; объемные концентрации относятся к определенной температуре.
Все вещества в той или иной степени способны растворяться и характеризуются растворимостью. Некоторые вещества неограниченно растворимы друг в друге (вода–ацетон, бензол–толуол, жидкие натрий–калий). Большинство соединений ограниченно растворимы (вода–бензол, вода–бутиловый спирт, вода–поваренная соль), а многие малорастворимы или практически нерастворимы (вода–BaSO4, вода–бензин).
Растворимостью вещества при данных условиях называют его концентрацию в насыщенном растворе. В таком растворе достигается равновесие между растворяемым веществом и раствором. В отсутствие равновесия раствор остается стабильным, если концентрация растворенного вещества меньше его растворимости (ненасыщенный раствор), или нестабильным, если в растворе содержится вещества больше его растворимости (пересыщенный раствор). Произведение растворимости малорастворимого соединения MenAnm связано с его растворимостью простым соотношением, которое получается из следующих соображений. Если в насыщенном растворе соединения Men Anm растворимость составляет S моль/л, то концентрация ионов в насыщенном растворе будет равна
[Me] = nS и [An] =mS
так как
MenAnm![]() nMe
+ mAn
nMe
+ mAn
nS mS
Подставляя эти значения в выражение произведения растворимости, получим
KS(Men Anm)= [Me]n[An]m = [nS]n [ms]m = nn·mmSn+m (8.5)
Из уравнения (8.5) следует
![]() (8.6)
(8.6)
Соотношение (7.5) и (7.6) позволяет рассчитывать KS по растворимости и, наоборот, рассчитывать растворимость, если известно KS.
Образование и растворение осадков
Равновесие, устанавливающееся между осадком малорастворимого вещества и его насыщенным раствором описывается уравнением:
АаВв(т) ![]() АаВв(р)
АаВв(р)
![]() .
.
В
рассматриваемых ниже случаях речь идет,
в основном, о малорастворимых гидроксидах
и солях. Эти соединения представляют
собой сильные электролиты – та их часть,
которая перешла в раствор, практически
полностью диссоциирована, а если в
растворе содержатся недиссоциированные
молекулы ![]() ,
то их концентрация ничтожна и, кроме
того, в насыщенном растворе является
величиной постоянной, поэтому
рассматриваемое равновесие можно
написать в виде
,
то их концентрация ничтожна и, кроме
того, в насыщенном растворе является
величиной постоянной, поэтому
рассматриваемое равновесие можно
написать в виде
АаВв(т) (43)
Константа равновесия этого процесса называется произведением растворимости малорастворимого соединения
![]() (44)
(44)
и
при постоянной температуре является
величиной постоянной.Условие образования
осадков непосредственно вытекает из
выражения (44): если в растворе произведение
реальных концентраций ионов ![]() и
и ![]() ,
рассчитанное по формуле (44), больше, чем
произведение растворимости
,
рассчитанное по формуле (44), больше, чем
произведение растворимости ![]() при
данной температуре, то осадок выпадает.
Если же произведение меньше численного
значения произведения растворимости,
то осаждения не происходит. Равновесие
(43) определяет полноту осаждения
малорастворимого соединения: чтобы
максимально полно вывести его из раствора
в осадок, следует увеличивать концентрацию
катиона
и
(или)
аниона
,
добавляя в насыщенный раствор одноименные
ионы
и
(или)
в
виде их растворимых соединений – это
так называемый «эффект одноименного
иона».Если возникает необходимость
растворить осадок
,
то следует уменьшать в его насыщенном
растворе концентрации соответствующих
ионов за счет вовлечения их в различные
комплексы, либо путем изменения
кислотности среды, либо, наконец, сочетая
исходное равновесие (43) с
окислительно-восстановительными
взаимодействиями. Во всех перечисленных
случаях в процесс «осаждение растворение»
включаются донорно-акцепторные
равновесия, которые могут существенно
изменить растворимость соединения
.
при
данной температуре, то осадок выпадает.
Если же произведение меньше численного
значения произведения растворимости,
то осаждения не происходит. Равновесие
(43) определяет полноту осаждения
малорастворимого соединения: чтобы
максимально полно вывести его из раствора
в осадок, следует увеличивать концентрацию
катиона
и
(или)
аниона
,
добавляя в насыщенный раствор одноименные
ионы
и
(или)
в
виде их растворимых соединений – это
так называемый «эффект одноименного
иона».Если возникает необходимость
растворить осадок
,
то следует уменьшать в его насыщенном
растворе концентрации соответствующих
ионов за счет вовлечения их в различные
комплексы, либо путем изменения
кислотности среды, либо, наконец, сочетая
исходное равновесие (43) с
окислительно-восстановительными
взаимодействиями. Во всех перечисленных
случаях в процесс «осаждение растворение»
включаются донорно-акцепторные
равновесия, которые могут существенно
изменить растворимость соединения
.
15
Общие (коллигативные) свойства разбавленных растворив неэлектролитов (давление насыщенного пара растворителя над раствором, температура замерзания раствора, температура кипения раствора, осмотическое давление раствора) Законы Рауля и Вант-Гоффа. Использование законов Рауля и Вант-Гоффа для определения молекулярной массы растворенного вещества
Коллигативные свойства растворов — это те свойства, которые при данных условиях оказываются равными и независимыми от химической природы растворённого вещества; свойства растворов, которые зависят лишь от количества кинетических единиц и от их теплового движения.
рассмотрим изменения термодинамических свойств растворов относительно свойств растворителя:
понижение давления пара,
повышение температуры кипения,
понижение температуры замерзания,
осмотическое давление.
Примечание: идеальным называют раствор, образование которого не сопровождается химическим взаимодействием, изменением объёма и тепловым эффектом.
все формулы приведенные ниже даны для растворов неэлектролитов. При рассмотрении растворов электролитов необходимо умножать правую часть формулы на изотонический коэффициент (i). Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы:
![]() ,
,
где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, аTmp — температура плавления (замерзания).
Уравнения, описывающие коллигативные свойства, выведены из . условия, что частицы в растворе не взаимодействуют между собой, то есть ведут себя аналогично идеальным газам. Строго говоря, свойствами идеального раствора не обладает ни один реальный раствор. Но большинство реальных растворов при малых значениях концентраций растворенного вещества практически ведут себя как идеальные, и уравнения, описывающие коллигативные свойства, достаточно точны для большинства разбавленных растворов.
Зависимость коллигативных свойств растворов от природы растворителя выражается в криоскопической и эбуллиоскопической константах, индивидуальных для каждого растворителя.
Понижение давления пара растворителя
Пар над жидкостью в состоянии равновесия называется насыщенным паром. Давление насыщенного пара — характерная величина для данного вещества и зависит от температуры. Если в жидкости растворены нелетучие вещества, то давление ее пара понижается.
Свойства разбавленных растворов определяются только природой растворителя и числом частиц растворенного вещества, поскольку вследствие малых концентраций силами взаимодействия между молекулами компонентов раствора можно пренебречь.
Давление насыщенного пара растворителя над раствором (Р) всегда меньше, чем над чистым растворителем (Ро). Это связано с тем, что поверхность раствора частично занята сольватированными молекулами растворенного вещества, благодаря чему уменьшается поверхностная концентрация молекул самого растворителя, а, следовательно, и скорость его испарения.
Понижение
давления пара раствора — разность между
давлением пара растворителя (р0)
и давлением пара раствора
![]()
Понижение
давления пара раствора прямо пропорционально
мольной доле растворенного вещества в
растворе или пропорционально отношению
числа молей растворенного вещества к
общему числу молей, содержащихся в
растворе:
![]() где
n— число молей растворенного
вещества; п0 — число
молей растворителя. ΔР, отнесенная
к P0, называется
относительным понижением давления пара
растворителя
где
n— число молей растворенного
вещества; п0 — число
молей растворителя. ΔР, отнесенная
к P0, называется
относительным понижением давления пара
растворителя
![]()
Первый закон Рауля
Относительное
понижение давления насыщенного пара
растворителя над раствором равно мольной
доле растворенного вещества
![]() .Изменение
температур кипения и замерзания растворов
.Изменение
температур кипения и замерзания растворов
Понижение давления пара над растворами приводит к тому, что они кипят и замерзают при температурах, отличающихся от соответствующих температур для чистых растворителей. Известно, что жидкость закипает, когда давление ее насыщенного пара становится равным внешнему давлению, а кристаллизация жидкости начинается в тот момент, когда давление ее насыщенных паров становится равным давлению над твердой фазой, в которую она переходит. Поэтому растворы кипят при более высоких температурах (tК р-ля), а замерзают при более низких температурах (tЗ р-ля), чем чистые растворители (tЗ р-ля).Второй закон Рауля
Повышение температуры кипения раствора (tК) и понижение температуры замерзания раствора (tЗ) по сравнению с чистым растворителем пропорциональны моляльной концентрации растворенного вещества.
ΔtК = tК р-ра = tК р-ля = Е ∙ См; ΔtЗ = tК р-ра = tЗ р-ля = Е ∙ См.
Коэффициент пропорциональности Е называется эбулиоскопической постоянной растворителя. Она равна ΔtК для одномоляльного раствора любого неэлектролита в данном растворителе, то есть зависит от природы растворителя и не зависит от природы растворенного вещества.
Коэффициент пропорциональности К называется криоскопической постоянной растворителя. Она равна ΔtЗ для одномоляльного раствора любого неэлектролита в данном растворителе, то есть связана с природой растворителя и не зависит от природы растворенного вещества.
Законы Рауля можно использовать для определения молекулярных масс (Мр-го) растворенных веществ:
ΔtК
= Е ∙ См = Е ∙![]() отсюда
отсюда
Мр-го
=
![]() и аналогично по понижению температуры
замерзания
и аналогично по понижению температуры
замерзания
М
=
![]()
Осмос
Осмосом называют диффузию растворителя через полупроницаемую перегородку, разделяющую раствор и чистый растворитель или два раствора различной концентрации.
Осмотическое давление (Росм.) – это давление , которое нужно приложить к раствору, чтобы привести его в равновесие с чистым растворителем, отделенным о него полупроницаемой перегородкой.
Теоретическое выражение для осмотического давления получил Вант-Гофф, рассматривавший поведение частиц вещества в растворе аналогично поведению молекул газа, занимающего одинаковый с раствором объем.
