
- •Некоторые методы определения атомных масс химических элементов
- •1. Метод Авогадро
- •2. Метод Канниццаро
- •3. Метод Менделеева
- •4. Метод Дюлонга и Пти
- •Факторы, влияющие на скорость химической реакции
- •Способы выражения константы равновесия
- •Стандартная константа равновесия
- •Константа равновесия реакций в гетерогенных системах
- •Смещение химического равновесия
- •Влияние температуры
- •Влияние давления
- •Влияние концентрации
- •Классификация растворов
- •Концентрация растворов
- •Закон Вант-Гоффа
- •Коллигативные свойства растворов электролитов
- •Растворы сильных электролитов
- •Мнимая степень диссоциации
- •Водородный показатель pH
- •Степень гидролиза
- •Виды окислительно-восстановительных реакций
- •Классификация комплексных соединений. Основные способы их получения
- •Так же встречается классификация по
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •Изомерия координационных соединений
- •Пространственная (геометрическая) изомерия
- •Оптическая изомерия
- •Номенклатура
- •Химическая связь в комплексных соединениях.
Факторы, влияющие на скорость химической реакции
Увеличивают скорость |
Уменьшают скорость |
Наличие химически активных реагентов |
Наличие химически неактивных реагентов |
Повышение концентрации реагентов |
Понижение концентрации реагентов |
Увеличение поверхности твердых и жидких реагентов |
Уменьшение поверхности твердых и жидких реагентов |
Повышение температуры |
Понижение температуры |
Присутствие катализатора |
Присутствие ингибитора |
Закон действующих масс в химической кинетике
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Это положение сформулировано в 1867 году норвежскими учёными К. Гульдбергом иП. Вааге. Для элементарной химической реакции:
![]()
закон действующих масс может быть записан в виде кинетического уравнения вида:
![]()
где ![]() — скорость
химической реакции,
— скорость
химической реакции, ![]() — константа
скорости реакции
— константа
скорости реакции
Для сложных реакций в общем виде это соотношение не выполняется. Тем не менее, многие сложные реакции условно можно рассматривать как ряд последовательных элементарных стадий с неустойчивыми промежуточными продуктами, формально эквивалентный переходу из начального состояния в конечное в «один шаг». Такие реакции называют формально простыми. Для формально простых реакций кинетическое уравнение может быть получено в виде:
![]()
(для
трех исходных веществ, аналогично
приведённому выше уравнению).
Здесь ![]() ,
, ![]() ,
, ![]() — порядок
реакции по веществам
— порядок
реакции по веществам ![]() ,
, ![]() ,
, ![]() соответственно,
а сумма
соответственно,
а сумма ![]() —
общий (или суммарный) порядок
реакции.
,
,
могут
быть не равны стехиометрическим
коэффициентам и не обязательно
целочисленные.
—
общий (или суммарный) порядок
реакции.
,
,
могут
быть не равны стехиометрическим
коэффициентам и не обязательно
целочисленные. ![]() при
определённых условиях может быть равно
и нулю.
при
определённых условиях может быть равно
и нулю.
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.
Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
11
Скорость химической реакции. Зависимость скорости химической реисции от температуры. Правило Вант-Гоффа. уравнение Аррениуса. Энергия активации (E) и ее физический смысл
Количественной характеристикой того, насколько быстро протекает данная реакция, является скорость химической реакции, т. е. скорость расходования реагентов или скорость появления продуктов. При этом безразлично, о каком из участвующих в реакции веществе идет речь, поскольку все они связаны между собой через уравнение реакции. По изменению количества одного из веществ можно судить о соответствующих изменениях количеств всех остальных.
Скоростью химической реакции ( ) называют изменение количества вещества реагента или продукта ( ) за единицу времени ( ) в единице объема (V):
= /(V• ).
Скорость реакции в данном случае обычно выражается в моль/(л•с).
Приведенное выражение относится к гомогенным химическим реакциям, протекающим в однородной среде, например между газами или в растворе:
2SO2 + O2 = 2SO3,
BаСl2 + Н2SO4 = ВаSО4 + 2НСl.
Гетерогенные химические реакции идут на поверхности соприкосновения твердого вещества и газа, твердого вещества и жидкости и т.п. К гетерогенным реакциям относятся, например, реакции металлов с кислотами:
Fе + 2НСl = FeСl2 + Н2.
В этом случае скоростью реакции называют изменение количества вещества реагента или продукта ( ) за единицу времени ( ) на единице поверхности (S):
= /(S• ).
Скорость гетерогенной реакции выражается в моль/(м2•с).
Чтобы управлять химическими реакциями, важно не только уметь определять их скорости, но и выяснить, какие условия оказывают на них влияние. Раздел химии, изучающий скорость химических реакций и влияние на нее различных факторов, называется химической кинетикой.
В первом приближении влияние температуры на скорость реакций определяется правилом Вант-Гоффа (сформулировано Я. Х. Вант-Гоффом на основании экспериментального изучения множества реакций):
В интервале температур от 0оС до 100оС при повышении температуры на каждые 10 градусов скорость химической реакции возрастает в 2-4 раза:
|
где γ – температурный коэффициент, принимающий значения от 2 до 4.
Правило Вант-Гоффа
Правило Вант-Гоффа - не более чем правило, оно не имеет силу закона.
Во-первых, Вант-Гофф мог изучать химические реакции в ограниченных условиях, которые обеспечивала лабораторная техника того времени. Как выяснилось позже, температурный коэффициент в значительном температурном интервале непостоянен.
Кроме того, из-за несовершенства технических средств невозможно было изучать как очень быстрые реакции (протекающие за миллисекунды), так и очень медленные (для которых требуются тысячи лет). Реакции с участием больших молекул сложной формы (например, белков) также не подчиняются правилу Вант-Гоффа.
Объяснение зависимости скорости реакции от температуры было дано С.Аррениусом. К реакции приводит не каждое столкновение молекул реагентов, а только наиболее сильные столкновения. Лишь молекулы, обладающие избытком кинетической энергии, способны к химической реакции.
С.Аррениус рассчитал долю активных (т.е. приводящих к реакции) соударений реагирующих частиц a, зависящую от температуры: - a = exp(-E/RT). и вывел уравнение Аррениуса для константы скорости реакции:
k = koe-E/RT
где ko и E зависят от природы реагентов. Е - это энергия, которую надо придать молекулам, чтобы они вступили во взаимодействие, называемая энергией активации.
Энергия активации
Столкновение химических частиц приводит к химическому взаимодействию лишь в том случае, если сталкивающиеся частицы обладают энергией, превышающей некоторую определенную величину. Рассмотрим взаимодействие газообразных веществ, состоящих из молекул А2 и В2:
А2 + В2 = 2АВ.
В ходе химической реакции происходит перегруппировка атомов, сопровождающаяся разрывом химических связей в исходных веществах и образованием связей в продуктах реакции. При столкновении реагирующих молекул сначала образуется так называемый активированный комплекс, в котором происходит перераспределение электронной плотности, и лишь потом получается конечный продукт реакции:
Энергию, необходимую для перехода веществ в состояние активированного комплекса, называютэнергией активации.
Активность химических веществ проявляется в низкой энергии активации реакций с их участием. Чем ниже энергия активации, тем выше скорость реакции.
Молекула - энергетически выгодное образование (в противном случае никаких молекул не существовало бы). Это значит, что химические вещества на энергетической диаграмме занимают положение в "ямках".
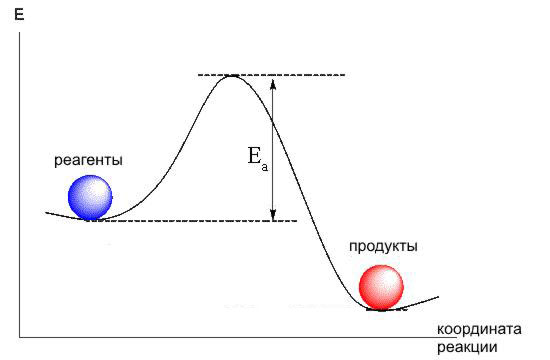
Если мы хотим провести реакцию, т.е. превратить эти вещества в другие, мы должны сообщить реагентам энергию, достаточную для того, чтобы они выбрались из "ямки", перевалили через окружающий его "барьер" (энергию активации).
Для этого, как правило, требуется нагреть реакционную смесь до определенной температуры, чтобы увеличить кинетическую энергию молекул. Если энергетический барьер реакции невысок, для ее начала бывает достаточно удара или трения.
Скорость реакции непосредственно зависит от значения энергии активации: если оно мало, то за определенное время протекания реакции энергетический барьер преодолеет большое число частиц и скорость реакции будет высокой,но если энергия активации велика, то реакция идет медленно.
При взаимодействии ионов энергия активации очень мала и ионные реакции протекают с очень большой скоростью(практически мгновенно).
12
Влияние катализатора на скорость химической реакция. Гомогенный и гетерогенный катализ. Классификация реакций в химической кинетике. Молекулярность и порядок реакции Простые и сложные реакции
Увеличить скорость реакции можно с помощью катализаторов. Применять катализаторы выгоднее,чем повышать температуру, тем более, что ее повышение далеко не всегда возможно.
Катализаторами называются вещества, изменяющие скорость химических реакций.
Одни катализаторы сильно ускоряют реакцию - положительный катализ, или просто катализ, другие - замедляют -отрицательный катализ. Примерами положительного катализа могут служить получение серной кислоты, окисление аммиака в азотную кислоту с помощью платинового катализатора и др.Примерами отрицательного катализа являются замедление взаимодействия раствора сульфита натрия с кислородом воздуха в присутствии этилового спирта или уменьшение скорости разложения пероксида водорода в присутствии небольших количеств серной кислоты (0,0001 мас. частей) и др.Отрицательный катализ часто называют ингибированием, а отрицательные катализаторы, снижающие скорость реакции, -ингибиторами (механизм действия последних отличен от действия катализаторов).
Химические реакции, протекающие при участии катализаторов, называют каталитическими.
Каталитическое воздействие может быть оказано на большинство химических реакций. Число катализаторов очень велико,а их каталитическая активность весьма различна. Она определяется изменением скорости реакции,вызываемым катализатором.
Сам катализатор в реакциях не расходуется и в конечные продукты не входит.
Различают два вида катализа - гомогенный (однородный) и гетерогенный (неоднородный) катализ.
При гомогенном катализе реагирующие вещества и катализатор образуют однофазную систему - газовую или жидкую,между катализатором и реагирующими веществами отсутствует поверхность раздела. Например,каталитическое разложение пероксида водорода в присутствии раствора солей (жидкая фаза). Для гомогенного катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора.
При гетерогенном катализе реагирующие вещества и катализатор образуют систему из разных фаз. В этом случае между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор - твердое вещество,а реагирующие вещества - газы или жидкости. Примерами могут служить окисление аммиака (газообразная фаза)в присутствии платины (твердая фаза) или разложение пероксида водорода (жидкая фаза) в присутствии угля или оксида марганца (IV) (твердая фаза). Все реакции при гетерогенном катализе протекают на поверхности катализатора. Поэтому активность твердого катализатора зависит и от свойств его поверхности (размера, химического состава,строения и состояния).
Действие положительных катализаторов сводится к уменьшению энергии активации реакции, другими словами, -к снижению высоты энергетического барьера.
При этом образуется активированный комплекс с более низким уровнем энергии и скорость реакции сильно возрастает.
Механизм действия катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Так, если медленно протекающую реакцию А + В = АВ вести в присутствии катализатора К,то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение:
А + К = АК
Реакция протекает быстро, так как энергия активации этого процесса мала.Затем промежуточное соединение АК взаимодействует с другим исходным веществом, при этом катализатор высвобождается:
АК + В = АВ + К
Энергия активации этого процесса также мала, а потому реакция протекает с достаточной скоростью.Если теперь оба процесса, протекающие одновременно, суммировать,то получим окончательное уравнение быстро протекающей реакции:
А + В = АВ
Приведем конкретный пример - окисление SО2 в SО3 с участием катализатора NO:
SO2 + ½O2 = SO3
A + B = AB
Эта реакция протекает медленно. Но при введении катализатора образуется промежуточное соединение: NO + ½ O2 = NO2
K + B = KB
и далее
SO2 + NO2 = SO3 + NO
А + КВ = АВ + К
Поверхность катализатора неоднородна. На ней имеются так называемые активные центры,на которых главным образом и протекают каталитические реакции. Реагирующие вещества адсорбируются на этих центрах,в результате чего увеличивается концентрация их на поверхности катализатора. А это отчасти приводит к ускорению реакции.Но главной причиной возрастания скорости реакции является сильное повышение химической активности адсорбированных молекул.Под действием катализатора у адсорбированных молекул ослабляются связи между атомами и они становятся более реакционноспособными.И в этом случае реакция ускоряется благодаря снижению энергии активации(в том числе за счет образования поверхностных промежуточных соединений).
Некоторые вещества снижают или полностью уничтожают активность твердого катализатора.Такие вещества называются каталитическими ядами. В качестве примера можно привести соединения мышьяка, ртути,свинца, цианистые соединения, к которым особенно чувствительны платиновые катализаторы. В производственных условиях реагирующие вещества подвергают очистке от каталитических ядов, а уже отравленные катализаторы регенерируют.
Однако имеются и такие вещества, которые усиливают действие катализаторов данной реакции,хотя сами катализаторами не являются. Эти вещества называются промоторами (промотирование платиновых катализаторов добавками железа, алюминия и др.).
Следует особо отметить, что действие катализаторов избирательно, поэтому, применяя разные катализаторы,можно получить из одного и того же вещества разные продукты
Кинетическая классификация химических реакций
Согласно кинетической классификации, реакции делят на простые и сложные. В простой реакции реагенты непосредственно превращаются в конечные продукты без образования промежуточных, в реакционной системе отсутствуют катализаторы и ингибиторы, а химический процесс состоит из однотипных элементарных актов. Сложная (многостадийная) реакция состоит из элементарных стадий, связанных друг с другом через реагенты или продукты. Суммарные признаки кинетически простой и сложной реакций приведены в табл
Кинетические признаки, лежащие в основе различий простой и сложной реакций
Простая реакция |
Сложная реакция |
Число реагирующих веществ невелико, а количественный состав продуктов реакции сравнительно прост. Количественные соотношения продуктов не зависят от условий протекания реакции (времени, температуры, состава реагирующей исходной смеси, давления) |
Число реагирующих веществ значительно. Состав продуктов реакции определяется временем, температурой, исходным составом реагентов и давлением реакционной смеси |
Скорость реакции монотонно увеличивается с ростом температуры; энергия активации всегда положительна и иногда может зависеть от температуры эксперимента |
Скорость реакции с ростом температуры может увеличиваться, уменьшаться или проходить через экстремум и зависит от материала и размеров реакционного сосуда. Энергия активации, определенная в широком интервале температур, может быть положительной, отрицательной или близкой к нулю |
Скорость реакции монотонно меняется при изменении условий проведения реакции и не зависит от материала и размеров реакционного сосуда |
При варьировании условий проведения реакции возможно скачкообразное изменение скорости реакции на несколько порядков, обусловленное критическими явлениями катализа или ингибирования химической реакции |
Другой тип кинетической классификации химических реакций основан на делении простых реакций по числу частиц, участвующих в превращениях: мономолекулярная реакция — реакция, в элементарном акте которой превращается одна частица (молекула, радикал, ион); бимолекулярная реакция — реакция, в которой претерпевают превращения две частицы (молекула, радикал, ион); тримолекулярная реакция — реакция, протекающая с участием трех частиц при их одновременном столкновении.
Основные типы простых мономолекулярных и бимолекулярных реакций приведены в табл
Типы простых мономолекулярных и бимолекулярных реакций
Простые мономолекулярные реакции |
Простые бимолекулярные реакции |
Реакция изомеризации — превращение одного реагента (частицы) в один продукт: Диссоциация — распад молекулы, связанный с разрывом одной связи: |
Реакция присоединения — взаимодействие двух реагентов друг с другом, из которых, по крайней мере, один является молекулой: Реакции электрофильного и нуклеофильного замещения— реакции замены активной группы в молекуле на другую группу: |
Реакция распада — превращение одной молекулы (частицы) в две или несколько частиц (молекула, радикал, ион): Реакция элиминирования — распад многоатомной молекулы на несколько молекул:
|
Реакция отрыва — взаимодействие молекулы с атомом, радикалом или ионом, приводящее к образованию молекулярного продукта и новой активной частицы: Реакция рекомбинации — взаимодействие двух атомов, радикалов, ионов, приводящее к образованию молекулярного продукта: Реакция диспропорционирования — перераспределение атомов или их группировок между двумя одинаковыми молекулами, радикалами в результате их взаимодействия: |
Тримолекулярные реакции характерны для каталитических и ингибированных процессов, а также процессов, протекающих с выделением значительного количества энергии, когда стабилизация образовавшейся в ходе бимолекулярной химической реакции молекулы достигается путем передачи энергии третьей частице.
Порядок химической реакции
Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.
Реакция нулевого порядка
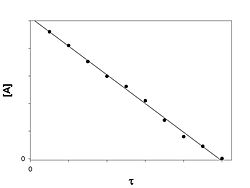
График зависимости концентрации реагента A в реакции A → B от времени для нулевого порядка реакции
Кинетическое уравнение имеет следующий вид:
![]()
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Реакция первого порядка
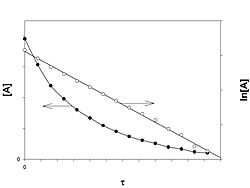
График зависимости концентрации реагента A для первого порядка реакции
Кинетическое уравнение реакции первого порядка:
![]()
Приведение уравнения к линейному виду даёт уравнение:
![]()
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
![]()
Период полупревращения:
![]()
Реакция второго порядка
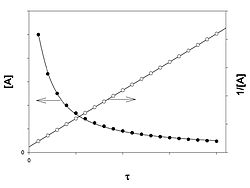
График зависимости концентрации реагента A для второго порядка реакции
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
![]()
или
![]()
В первом случае скорость реакции определяется уравнением
![]()
Линейная форма уравнения:
![]()
Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
![]()
![]()
Во втором случае выражение для константы скорости реакции будет выглядеть так:
![]()
Период полупревращения (для случая равных начальных концентраций!):
![]()
Молекулярность реакции
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
13
Химическое равновесие. Константа равновесия. способы ее выражения. Смещение химического равновесия. Принцип Ле Шателье. Влияние концентрации реагруютих веществ, температуры и давления на состояние химического равновесия
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
А2 + В2 ⇄ 2AB
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальным давлениями,концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
