
- •Некоторые методы определения атомных масс химических элементов
- •1. Метод Авогадро
- •2. Метод Канниццаро
- •3. Метод Менделеева
- •4. Метод Дюлонга и Пти
- •Факторы, влияющие на скорость химической реакции
- •Способы выражения константы равновесия
- •Стандартная константа равновесия
- •Константа равновесия реакций в гетерогенных системах
- •Смещение химического равновесия
- •Влияние температуры
- •Влияние давления
- •Влияние концентрации
- •Классификация растворов
- •Концентрация растворов
- •Закон Вант-Гоффа
- •Коллигативные свойства растворов электролитов
- •Растворы сильных электролитов
- •Мнимая степень диссоциации
- •Водородный показатель pH
- •Степень гидролиза
- •Виды окислительно-восстановительных реакций
- •Классификация комплексных соединений. Основные способы их получения
- •Так же встречается классификация по
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •Изомерия координационных соединений
- •Пространственная (геометрическая) изомерия
- •Оптическая изомерия
- •Номенклатура
- •Химическая связь в комплексных соединениях.
Химическая связь в комплексных соединениях.
Метод валентных связей является весьма наглядным способом описания комплексных соединений. В его основе лежат следующие положения:
Связь между комплексообразователем и лигандами донорно-акцепторная σ-типа. Лиганды предоставляют электронные пары, а ядро комплекса – свободные орбитали.
Орбитали центрального атома, участвующие в образовании связи, подвергаются гибридизации, которая определяет геометрию комплекса. Тип гибридизации определяется числом, природой и электронной структурой лигандов.
Дополнительное упрочение комплекса обусловлено тем, что наряду с σ-связями могут возникать и π-связи. Это происходит, если занятая электронами орбиталь центрального атома перекрывается с вакантной орбиталью лиганда.
Магнитные свойства комплекса объясняются исходя из заселённости орбиталей. При наличии неспаренных электронов комплекс парамагнитен. Спаренность электронов обусловливает диамагнетизм комплексного соединения.
Рассмотрим, как МВС описывает электронную структуру и свойства некоторых комплексов, образованных 3d–элементами: кобальтом, никелем и медью. В таблице собственные электроннные пары комплексообразователей изображены сплошными стрелками, а электронные пары лигандов, ответственные за донорно-акцепторные σ-связи, представлены пунктирными стрелками.
Комплекс |
Заселённость орбиталей комплексообразователя |
Тип гибридизации ядра комплекса |
Структура комплекса |
Co3+
3d
4s
4p
4d |
|
sp3d2 |
Октаэдр. |
|
|
sp3 |
Тетраэдр. |
|
|
sp |
Линейная |
Наряду с моноядерными комплексами, включающими только один центральный атом, существуют полиядерные, в структуре которых одновременно присутствуют два или несколько центральных атомов-комплексообразователей.
Помимо МВС для описания комплексных соединений широко используют Теорию кристаллического поля (ТКП), основанную на электростатической модели, её усовершенствованную модель – Теорию поля лигандов (ТПЛ), в которой электростатическое взаимодействие дополнено идеей перекрывания орбиталей, и, наконец, Метод молекулярных орбиталей (ММО).

![]()
Электростатические модели
Важным этапом в развитии теории химической связи в координационных
соединениях были электростатические представления. Это и понятно, посколь-
ку единственными существенными силами, действующими на молекулярном
уровне, являются электростатические. Взаимное расположение ядер и характер
распределения электронной плотности в системе более детально прогнозирует-
ся в результате квантово-химического анализа молекулы, но в ряде предельных
случаев удается сформулировать более упрощенные правила оценки этих вели-
чин и перейти к электростатическим моделям.
Классические работы Кистяковского, Льюиса, Косселя и других ученых
были направлены на представления о том, что химические процессы сводятся к
взаимодействию электронов. Электростатические воззрения основаны на рас-
смотрении взаимодействия заряженных частиц – ионов, диполей, квадруполей
и др., создающих взаимодействующие между собой электростатические поля,
потенциалы которых определяют прочность связей, а, следовательно, и устой-
чивость соединений.
Модель мультипольных взаимодействий (ММВ).
Электростатическая модель, дополненная представлением об ионах –
«жестких сферах»,
Концепция электронейтральности.
Донорно- акцепторной механизм образования ковалентной связи
Суть донорно-акцепторного механизма заключается в том, что у одного атома (акцептора) есть свободная квантовая ячейка (орбиталь, не занятая электронами), а у другого (донора) - свободная, неподеленная пара электронов. При образовании связи акцептор предоставляет донору свободную орбиталь, а донор акцептору - пару электронов. Таким образом образуется общая электронная пара. Например\ В молекуле K3[Fe(CN6)] акцептором будет ион Fe(3+), а донором - цианид-ион
Среди химических соединений, в том числе комплексных, различают парамагнитные и диамагнитные, по разному взаимодействующие с внешним магнитным полем. Парамагнитные комплексы обладают моментом µ и поэтому при взаимодействии с внешним магнитным полем втягиваются в него. Напротив, диамагнитные комплексы, не имея собственного магнитного момента, выталкиваются из внешнего магнитного поля. Парамагнитные свойства веществ обусловлены наличием в их структуре неспаренных электронов и в случае комплексов объясняются специфическим заполнением электронами энергетических уровней.
Существуют два принципа, определяющих заполнение электронами d-орбиталей, расщепленных на dε и dγ -подуровни.
1. Электроны заполняют орбитали так, чтобы число неспаренных электронов было максимальным (правило Хунда).
2. Сначала заполняются орбитали, имеющие меньшую энергию.
С учетом этих правил при числе d-электронов в комплексообразователе от 1 до 3 или 8, 9, 10 их можно расположить по d-орбиталям только одним способом (в соответствии с правилом Хунда). При числе электронов от 4 до 7 в октаэдрическом комплексе возможно либо занятие орбиталей, уже заполненных одним электроном, либо заполнение свободных dγ -орбиталей более высокой энергии. В первом случае потребуется энергия на преодоление отталкивания между электронами, находящимися на одной и той же орбитали, во втором — для перехода на орбиталь более высокой энергии. Распределение электронов по орбиталям зависит от соотношения между величинами энергий расщепления (Δ) и спаривания электронов (Р). При низких значениях Δ («слабое поле»), величина Δ может быть < Р, тогда электроны займут разные орбитали, а спины их будут параллельны. При этом образуются внешнеорбитальные (высокоспиновые) комплексы, характеризующиеся определённым магнитным моментом µ. Если энергия межэлектронного отталкивания меньше, чем Δ («сильное поле»), то есть Δ > Р, происходит спаривание электронов на dε -орбиталях и образование внутриорбитальных (низкоспиновых) комплексов, магнитный момент которых µ =0.
Внутриорбитальные комплексы диамагнитны, т.к. не содержат неспаренных электронов. Их называют низкоспиновыми. Внешнеорбитальные комплексы парамагнитны, т.к. содержат неспаренные электроны. Их относят к высокоспиновым.
Рассмотрим строение двух комплексов:
[NiCl6]4-
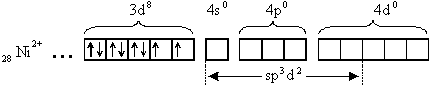
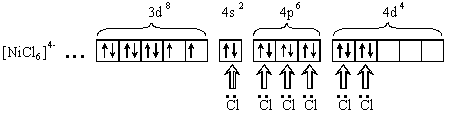
Тип гибридизации sp d - внешнеорбитальный. Комплекс парамагнитен, высокоспиновый, имеет октаэдрическую форму.
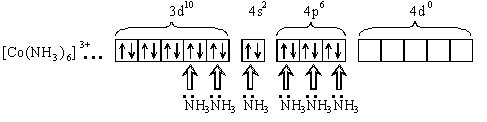
[Co(NH3)6]3+
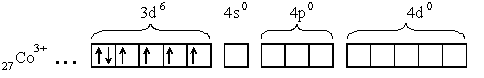
Под действием лигандов происходит спаривание d- электронов и молекулы аммиака поступают на освободившиеся d- орбитали и на свободные s- и p- орбитали иона кобальта:
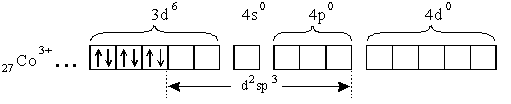
Тип гибридизации d2sp3 - внутриорбитальный. Комплекс диамагнитен, низкоспиновый, имеет октаэдрическую форму.




 [NiCl4]2-
[NiCl4]2-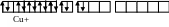 [Cu(NH3)2]+
[Cu(NH3)2]+