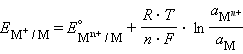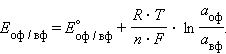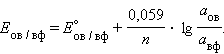- •Некоторые методы определения атомных масс химических элементов
- •1. Метод Авогадро
- •2. Метод Канниццаро
- •3. Метод Менделеева
- •4. Метод Дюлонга и Пти
- •Факторы, влияющие на скорость химической реакции
- •Способы выражения константы равновесия
- •Стандартная константа равновесия
- •Константа равновесия реакций в гетерогенных системах
- •Смещение химического равновесия
- •Влияние температуры
- •Влияние давления
- •Влияние концентрации
- •Классификация растворов
- •Концентрация растворов
- •Закон Вант-Гоффа
- •Коллигативные свойства растворов электролитов
- •Растворы сильных электролитов
- •Мнимая степень диссоциации
- •Водородный показатель pH
- •Степень гидролиза
- •Виды окислительно-восстановительных реакций
- •Классификация комплексных соединений. Основные способы их получения
- •Так же встречается классификация по
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •Изомерия координационных соединений
- •Пространственная (геометрическая) изомерия
- •Оптическая изомерия
- •Номенклатура
- •Химическая связь в комплексных соединениях.
Виды окислительно-восстановительных реакций
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
Методы составления уравнений окилительно-восстановительных реакций
Правильно составленное уравнение реакции является выражением
закона сохранения массы вещества. Поэтому число одних и тех же атомов
в исходных веществах и продуктах реакции должно быть одинаково так же
как и суммы зарядов исходных веществ и продуктов реакций.
Для определения коэффициентов в уравнение окилительно-
восстановительного процесса применяют два метода:
- метод электронного баланса
- ионно-электронный метод или метод полуреакций.
Метод электронного баланса
Метод электронного баланса основан на определении общего ко-
личества электронов, перемещающихся от восстановителя к окислителю.
Он позволяет на формальной основе устанавливать стехиометрические
отношения в процессе окиления-восстановления в любых гомогенных и
гетерогенных системах. Например, для расстановки коэффициентов в
уравнении
![]()
необходимо:
1. Опередить, какие вещества в процессе реакции изменяют свои
степени
окисления![]()
2. Определить окислитель и восстановитель, составить схему про-
цессов восстановления и окисления.
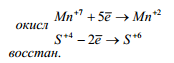
3. Исходя из положения, что количество отданных электронов e
должно быть равно количеству присоединяемых, найти наименьшее крат-
ное и определить дополнительные множители для окислителя и восстано-
вителя.
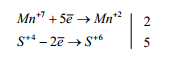
4. Эти дополнительные множители расставить в уравнение реакции
как основные коэффициенты перед окислителем и продуктом его восста-
новления и восстановителем и продуктом его окисления:
![]()
5. Рассмотреть процесс солеобразования и определить количество
кислоты,
а по водоводу - количество воды.
![]()
6. По кислороду окончательно проверить правильность расстановки
коэффициентов Количество атомов кислорода в правой и левой частях
уравнения должно быть одинаково.
Метод полуреакций
Метод полуреакций предусматривает раздельное составление ион-
ных уравнений для процессов окисления и восстановления с последую-
щим их суммированием в общее ионное уравнение. Преимущество этого
метода состоит в том, что при составлении полуреакций рассматривают-
ся реально существующие в растворах ионы и, кроме того, учитывается
влияние среды на характер протекания окислительно-восстановительного
процесса.
Например, восстановление перманганата калия нитритом натрия в
нейтральной
среде идет по схеме:
![]()
Для расстановки коэффициентов в этом уравнение методом полуре-
акций следует:
1. Написать схему реакции в ионной форме. Ее
легко получить, исключив, из полного ионного уравнения ионы, не изме-
нившие
в результате взаимодействия состава и
заряда.
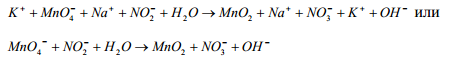
2Выписать частицы, изменившие состав и заряд
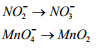
3. Составить полуреакции окисления и восстановления. При состав-
ление полуреакции следует учитывать следующее:
a) если исходное вещество содержит больше кислорода, чем про-
дукт реакции, то освободившийся кислород в форме
O
связывается в кислых растворах ионами
Н+ в воду
![]()
а
в нейтральных растворах – молекулами
воды в гидроксид – ионы![]()
поэтому в рассматриваемом примере:
![]()
б) если исходное вещество содержит меньше атомов кислорода, чем
продукт реакции то недостаток их восполняется в кислых и нейтральных
растворах за счет воды, а в щелочных – за чет гидроксид-ионов. В данном
примере:
![]()
с учетом сказанного следует записать:
![]()
Чтобы стрелку заменить на знак равенства, необходимо уравнять и
заряды. В первом уравнение слева суммарный заряд равен -3 , а справа -1.
Следовательно, из левой части уравнения надо вычесть два электрона. К
левой части второго уравнения надо прибавить три электрона.
Полуреакция
окисления:
![]()
Полуреакция
восстановления:
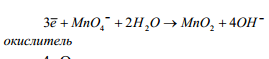
4. Определить дополнительные множители к полуреакциям, исходя
из того, что количество электронов, отданных восстановителем, должно
быть
равно количеству электронов, присоединенных
окислителем.
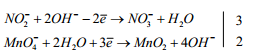
5. Составить общее ионное уравнение, просуммировав полуреакции
с
учётом дополнительных множителей:
![]()
После
приведения подобных членов получится:
![]()
6.
Записать молекулярное уравнение:
![]()
Факторы, определяющие направление и глубину протекания окислительно-восстановительных процессов
К ним относятся:
1. Природа реагирующих веществ.
2. Активность (концентрация) всех веществ, присутствующих в системе.
3. Температура раствора.
4. Кислотность раствора (pH).
5. Образование малорастворимых веществ.
6. Образование комплексных соединений.
7. Природа растворителей.
Характер взаимодействия между одними и теми же веществами мо-
жет изменяться в зависимости от pH среды. Это наглядно проявляется в реакциях восстановления перманганата калия одним и тем же восстановителем, например, сульфитом натрия.
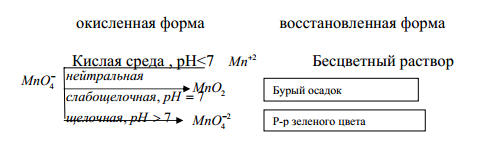

Во многих случаях продукты окислительно-восстановительных процессов можно определить экспериментально по наблюдениям, если продукты реакции имеют характерную окраску, выпадают в осадок, выделяются в виде газа, имеют специфический запах. В тех случаях, когда реакция не сопровождается видимыми изменениями, необходимо прибегнуть к логическому рассуждению.
Количественной характеристикой самопроизвольного протекания окислительно – восстановительной реакции является расчетное значение ∆φ0 реакции, которое определяется как разность между потенциалами окислителя и восстановителя. Окислительно – восстановительная реакция
протекает самопроизвольно, если разность потенциалов является положительной величиной. Сущность этого заключается в следующем: если мысленно обособить процессы окисления и восстановления, т.е. “составить” гальванический элемент, то в нем будет совершаться электрическая работа за счет протекания химической реакции. Для обратимого процесса справедливо: А (максимально полезная)=А (электрическая), но

22
Количественные характеристики окислительно - восстановительных реакций.
Электродные потенциалы. Гальванические элементы. Ряд активности (натяжений) металлов. Стандартные окислительно-восстановительные потенциалы.
Уравнение Нернста. Электродвижущая сила (Э.Д.С). гальванического элемента
Количественные характеристики окислительно - восстановительных реакций


Электродные потенциалы
Если же процессы окисления и восстановления пространственно разделить, то любую окислительно-восстановительную реакцию можно использовать для получения электрической энергии. Такие устройства называют химическими источниками тока (ХИТ). Простейший ХИТ – гальваническая ячейка (рис. 7.1) – представляет собой сосуды, в которых два электрода, помещенные в раствор соответствующих электролитов, соединены солевым мостиком (проводником второго рода *), представляющим собой стеклянную трубку, заполненную раствором такого электролита, катионы и анионы которого характеризуются одинаковой подвижностью. При замыкании внешней цепи проводником первого рода начинается окислительно-восстановительная реакция, о чем свидетельствует возникновение электродвижущей силы (ЭДС).
*) В проводниках второго рода носителями заряда служат ионы, в отличие от электронов в проводниках первого рода.
Реакция CuSO4 + Zn = Cu + ZnSO4 в электрохимическом варианте является основой гальванического элемента Даниэля–Якоби, схема которого
|
|
|
отражает современную систему обозначений для гальванических элементов. Слева записывается анод Zn¦Zn2+, на котором возникает избыток электронов и происходит процесс окисления – отрицательный полюс (–). Справа – катод Cu2+¦Cu – электрод с недостатком электронов, положительный полюс (+). Одна вертикальная черта изображает фазовый раздел между металлом и раствором электролита. Двойная вертикальная линия отделяет анодное пространство от катодного.
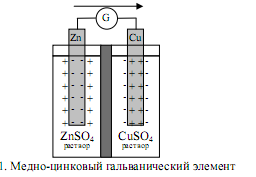
Электроны по внешнему участку цепи, металлическому проводнику, переходят от отрицательного полюса к положительному. Внешнюю цепь на схеме не изображают. В круглых скобках знаками плюс и минус обозначают полюсы электродов.
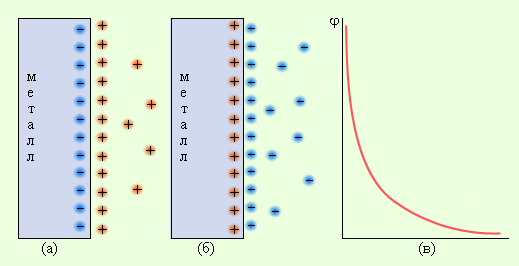
Рассмотрим системы металл–растворитель и металл–электролит. В этих гетерогенных системах в зависимости от природы металла и электролита возможен переход ионов металла в раствор или ионов металла из раствора на поверхность металла. Эти процессы определяются отношением энтальпии отрыва иона от кристаллической решетки металла (ΔHреш) и энтальпии сольватации этого иона Mn+ ∙ solv(ΔHsolv).
В результате на фазовой границе металл–электролит устанавливается равновесие:
|
|
|
Если концентрация ионов металла в растворе меньше равновесной, то при погружении металла в раствор равновесие смещается вправо, что приводит к отрицательному заряду на металле по отношению к раствору. Если малоактивный металл погружен в раствор соли с концентрацией больше равновесной, то происходит переход ионов из раствора на металл, заряженный положительно (рис. 7.2). В любом случае возникает двойной электрический слой, и появляется разность электрических потенциалов, или гальвани-потенциал.
Система, состоящая из металла, погруженного в раствор электролита, называется электродом, то есть электроды в электрохимии – это системы из двух токопроводящих тел: проводников 1 и 2 рода. Абсолютное значение разности потенциалов на границе двух фаз разной природы металл│электролит измерить нельзя, однако можно измерить разность потенциалов двух различных электродов.
|
Рисунок 7.2 Схема двойного электрического слоя (а) и (б); распределение заряда в объеме электролита (в) |
Значения электродных потенциалов определяются относительно некоторого электрода, потенциал которого условно принят за нулевой. Таким эталонным электродом выбран водородный в стандартных условиях. Его устройство таково: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль∙л–1, обдувается струей газообразного водорода под давлением 100 кПа; при этих условиях и при T = 298 K
|
|
|
Платиновая чернь адсорбирует водород, который электрохимически взаимодействует с H+ по уравнению
|
|
|
Для гальванического элемента
|
(–)Pt, H2¦2H+||Mn+¦M(+), |
|
в котором протекает окислительно-восстановительная реакция
|
|
|
запишем уравнение изотермы
|
|
|
Учитывая, что для стандартного водородного электрода активности ионов H+ и газа H2 равны 1, а ΔG = –nFE, после преобразования получим уравнение Нернста для электродного процесса:
|
|
|
В этом
уравнении ![]() –
ЭДС реакции, n –
число электронов, участвующих в
электронной реакции, F – числоФарадея.
–
ЭДС реакции, n –
число электронов, участвующих в
электронной реакции, F – числоФарадея.
Уравнение (7.1) выражает зависимость электродного потенциала от концентрации (активности) ионов и температуры и называется уравнением Нернста для отдельного электрода.
Отметив,
что ![]() –
активность окисленной формы реагента
(оф), aM –
активность его восстановленной формы
(вф), уравнение Нернста можно записать
в следующем виде:
–
активность окисленной формы реагента
(оф), aM –
активность его восстановленной формы
(вф), уравнение Нернста можно записать
в следующем виде:
|
|
|
Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, получим удобную для расчетов форму уравнения Нернста:
|
|
|
Активность твердого вещества (aтв) принимается равной единице, поэтому в случае рассматриваемого нами металлического электрода (aM) уравнение Нернста упрощается:
|
|
|
Потенциал
электрода, как видно из этого уравнения,
зависит от активности ионов ![]() которые
являются потенциалопределяющими.
Разность потенциалов стандартного
водородного электрода и какого-нибудь
другого электрода, измеренная при
стандартных условиях, называется
стандартным электродным потенциалом
и обозначаетсяE°.
которые
являются потенциалопределяющими.
Разность потенциалов стандартного
водородного электрода и какого-нибудь
другого электрода, измеренная при
стандартных условиях, называется
стандартным электродным потенциалом
и обозначаетсяE°.
Следует подчеркнуть, что:
Уравнение Нернста отдельного электрода условились писать для процесса восстановления независимо от того, в какую сторону сдвинуто равновесие, то есть под знаком логарифма в уравнении Нернста в числителе стоит окисленная форма реагента, в знаменателе – восстановленная.
В дробном индексе при E и E° над чертой ставится окисленная форма полуэлемента, под чертой – восстановленная.
Активности твердых веществ в уравнение Нернста не входят.
Значения некоторых стандартных окислительно-восстановительных потенциалов гальванических элементов, расположенных в порядке их возрастания, представлены в Табл Стандартных окислительно-восстановительные потенциалов Положительный окислительно-восстановительный потенциал электрода Cu2+│Cu (E° = +0,34 B) показывает, что в стандартных условиях водород окисляется ионами меди, медный электрод по отношению к водороду является катодом, электроны по внешней цепи переходят от водорода к меди:
|
|
|
Отрицательный потенциал Zn2+│Zn (E° = –0,76 B) означает, что в стандартных условиях цинковый электрод может быть только анодом, его окислительные функции по отношению к водородному электроду 2H+│H2 отрицательные. Цинк здесь восстанавливает катионы водорода, электроны во внешней цепи перетекают от цинка к водороду:
|
|
|
Суммируя эти реакции, получим
|
|
|
то есть электрод с более положительным значением стандартного электродного потенциала является окислителем по отношению к электроду с менее положительным значением E°.
Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента. ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода.
Рассмотрим расчёт ЭДС элемента Даниэля – Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
![]() (III.41)
(III.41)
![]() (III.42)
(III.42)
![]() (III.43)
(III.43)
![]() (III.44)
(III.44)
![]() (III.45)
(III.45)
Как видно из уравнения (III.45), ЭДС элемента Даниэля – Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
![]() (III.46)
(III.46)
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается. Отношение концентраций ионов меди и цинка постоянно уменьшается и логарифм этого отношения при [Сu2+] < [Zn2+] становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. εк = εа) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) объясняет также и работоспособность т.н. концентрационных цепей – гальванических элементов, состоящих из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а1 > а2. Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны; для ЭДС концентрационного гальванического элемента получаем:
![]() (III.47)
(III.47)
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Т.о., работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au |
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительных реакциях в водных растворах.
Окислительно-восстановительный потенциал (редокс-потенциал от англ.redox — reduction-oxidation reaction, Eh илиEh) — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода: Pt/Fe3+,Fe2+ Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если полуреакцию восстановления представить уравнением:
Aox + n·e− → Ared,
то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей)реагирующих веществ выражается уравнением Нернста.
Окислительно-восстановительный потенциал определяют электрохимическими методами с использованием стеклянного электрода с red-ox функцией и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартны условиях.
23
Основные представления о комплексных соединеиях (комплексообразователь, лиганды, координационное число комплексообразователя, координационная емкость лигандов, внутренняя сфера, внешняя сфера.. Способ получения. Классификация комплексных соединений. Изомерия комплексных соединений
Комплексные соединения (лат. complexus — сочетание, обхват) иликоординационные соединения (лат.co — «вместе» и ordinatio — «упорядочение») — частицы (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемомукомплексообразователем, нейтральных молекул или других ионов, называемыхлигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером.
Комплексные соединения мало диссоциируют в растворе (в отличие от двойных солей). Комплексные соединения могут содержать комплексный малодиссоциирующий анион ([Fe(CN)6]3−), комплексный катион ([Ag(NH3)2]+), либо вообще не диссоциировать на ионы (соединения типа неэлектролитов, например карбонилы металлов). Комплексные соединения разнообразны и многочисленны.
Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, йода и других элементов, образующих неметаллы. Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературеметаллоцентром; заряд комплексообразователя может быть также отрицательным или равным нулю.
Лиганды — атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH−, Cl−, PO43− и др.), а также катион водорода H+.
Внутренняя сфера комплексного соединения — центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица.
Внешняя сфера комплексного соединения — остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.
Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные (унидентатные) лиганды, связанные с центральным атомом через один из своих атомов, то есть одной ковалентной связью, бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя связями), три- , тетрадентатные и т. д.