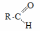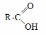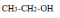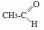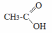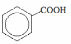- •Теоретическое занятие по теме «Карбоновые кислоты»
- •Актуализация изучаемой темы
- •Классификация и номенклатура карбоновых кислот
- •Систематическая и тривиальная номенклатура некоторых карбоновых кислот
- •Систематическая номенклатура ацильных и ацилатных остатков карбоновых кислот
- •Изомерия карбоновых кислот
- •Физические свойства карбоновых кислот
- •Химические свойства карбоновых кислот
- •Обоснование реакционной способности:
- •Кислотные свойства
- •Реакции с участием углеводородного радикала
- •Декарбоксилирование карбоновых кислот
- •Качественные реакции карбоновых кислот
- •Способы получения монокарбоновых и дикарбоновых кислот
Декарбоксилирование карбоновых кислот
Реакции декарбоксилирования сопровождаются отщеплением молекулы углекислого газа CO2:
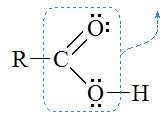
Незамещенные монокарбоновые кислоты декарбоксилируют в жестких условиях.
![]()
Дикарбоновые кислоты декарбоксилируют легче:
НООС-СООН → СО2↑ + НСООН
Процесс протекает при нагревании до 160-180°С.
В живых организмах процессы декарбоксилирования протекают при участии специфических ферментов – декарбоксилаз.
Качественные реакции карбоновых кислот
Качественная реакция на уксусную кислоту и ее соли:
СН3СООН + NaOH → CH3COONa + H2O
При взаимодействии с раствором хлорида железа (III) появляется желто-красное окрашивание за счет образования ацетата железа (III):
3CH3COONa + FeCl3 → (CH3COO)3Fe + 3NaCl
желто-красное окрашивание
Последующее нагревание приводит к образованию красно-бурого осадка и бесцветного, прозрачного раствора над осадком:
(CH3COO)3Fe + H2O → FeOH(CH3COO)2↓+ CH3COOH
Качественная реакция на бензойную кислоту и ее соли:
С6Н5СООН + NaOH → С6Н5COONa + H2O
При взаимодействии с раствором хлорида железа (III) образуется розовато-желтый осадок бензоата железа (III):
3 С6Н5COONa + FeCl3 → (С6Н5COO)3Fe↓ + 3NaCl
Качественная реакция на муравьиную кислоту:
Аналогично альдегидам муравьиная кислота дает реакцию серебряного зеркала.
Качественная реакция на щавелевую кислоту:
При взаимодействии с солями кальция дает нерастворимый оксалат, кристаллы которого имеют характерную октаэдрическую форму:
Способы получения монокарбоновых и дикарбоновых кислот
Атом углерода в карбоксильной группе находится в более окисленном состоянии, чем в углеводородах, спиртах, альдегидах, поэтому для получения карбоновых кислот используют реакции окисления соединений перечисленных классов.
Получение из первичных спиртов и альдегидов:
спирт |
[O] → |
альдегид |
[O] → |
карбоновая кислота |
В качестве окислителей используют перманганат калия KMnO4 или дихромат калия K2Cr2O7, азотную кислоту и другие окисляющие реагенты. Окисление протекает в сравнительно мягких условиях. Например, при окислении этанола последовательно можно получить уксусный альдегид и уксусную кислоту:
этанол |
KMnO4 → |
этаналь |
KMnO4 → |
этановая кислота |
Получение из гомологов бензола:
толуол |
KMnO4;
KOH;
100° С
|
бензойная кислота |
Моноалкил производные бензола (с одним углеводородным радикалом) окисляются до бензойной кислоты. В лабораторных условиях в этих целях используют перманганат или дихромат калия, в промышленности – кислород воздуха.
Получение из алканов:
Предельные углеводороды окисляются кислородом воздуха в присутствии катализаторов с образованием смеси карбоновых кислот:
![]()
Получение из нитрилов:
Алкил- и арилнитрилы (цианиды) гидролизуются в кислой или щелочной среде с образованием карбоновых кислот:
R-C≡N + 2H2O → R-COOH + NH3
Получение из полигалогенопроизводных:
В результате щелочного гидролиза тригалогеноалканов образуются соответствующие карбоновые кислоты:
R-CCl3 + 3NaOH → R-COOH + 3NaCl + H2O
Получение из сложных эфиров карбоновых кислот:
R1-СOO-R2 + H2O → R1-COOH + R2OH
В результате кислотного гидролиза сложных эфиров карбоновых кислот можно получить соответствующие карбоновые кислоты и спирты.
Получение в результате карбоксилирования металлорганических соединений:
![]()
![]()