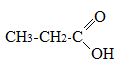
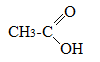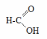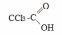- •Теоретическое занятие по теме «Карбоновые кислоты»
- •Актуализация изучаемой темы
- •Классификация и номенклатура карбоновых кислот
- •Систематическая и тривиальная номенклатура некоторых карбоновых кислот
- •Систематическая номенклатура ацильных и ацилатных остатков карбоновых кислот
- •Изомерия карбоновых кислот
- •Физические свойства карбоновых кислот
- •Химические свойства карбоновых кислот
- •Обоснование реакционной способности:
- •Кислотные свойства
- •Реакции с участием углеводородного радикала
- •Декарбоксилирование карбоновых кислот
- •Качественные реакции карбоновых кислот
- •Способы получения монокарбоновых и дикарбоновых кислот
Кислотные свойства
Строением карбоксильной группы и, в частности, поляризацией связи О–Н обусловлены кислотные свойства карбоновых кислот.
Следует отметить, что на легкость отщепления протона, т.е. на проявление кислотных свойств, существенное влияние оказывает природа углеводородного радикала, связанного с карбоксильной группой. Так, например, алкильные радикалы, обладающие электронодонорными свойствами, уменьшают силу кислот, и в гомологическом ряду предельных одноосновных карбоновых кислот наиболее сильной является муравьиная кислота.
|
< |
|
< |
|
Сила кислот увеличивается, если углеводородный радикал содержит электроноакцепторные заместители, например, галогены.
|
< |
|
< |
|
Карбоновые кислоты при реакции с металлами, их оксидами или их осно́вными гидроксидами соли соответствующих металлов:
2RCOOH + Mg → (RCOO)2Mg + H2↑
2RCOOH + CaO → (RCOO)2Са + H2О
2RCOOH + NaOH → RCOONa + H2O
Реакции нуклеофильного замещения
В общем виде механизм SN можно представить следующим образом:
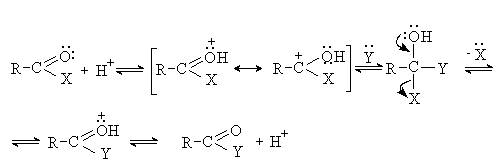
Различные случаи реакций нуклеофильного замещения.
Образование сложных эфиров
Протекает при взаимодействии карбоновых кислот со спиртами (этерификация) в условиях кислотного катализа. При этом в молекуле карбоновой кислоты гидроксильная группа -ОН замещается на группу -OR' от молекулы спирта R'OH.
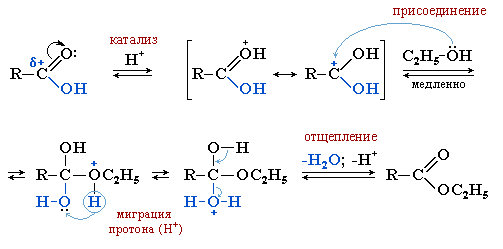
Сложные эфиры гидролизуются с образованием карбоновых кислот под действием кислот или щелочей.
Кислотный гидролиз сложных эфиров – это реакция обратная этерификации.
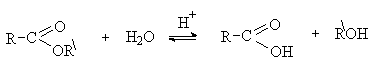
Механизм кислотного гидролиза включает те же стадии, что и процесс этерификации, но в обратной последовательности.
Щелочной гидролиз сложных эфиров требует эквимолярных количеств щелочи и протекает необратимо. Суть щелочного катализа состоит в использовании вместо слабого нуклеофила – воды, более сильного нуклеофила – гидроксид-иона.

Образование амидов
Механизм реакции аналогичен механизму реакции этерификации. В качестве реагентов используются аммиак или соответствующие амины.
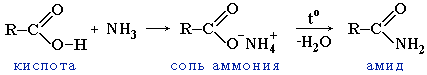
Вместо карбоновых кислот чаще используют их галогенангидриды:

Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
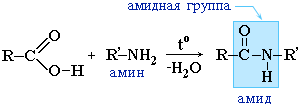
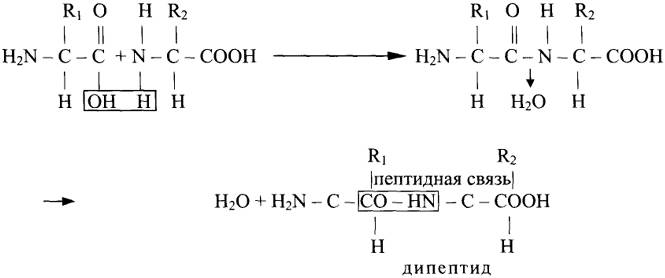
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из α-аминокислот с участием амидных групп – пептидных связей:
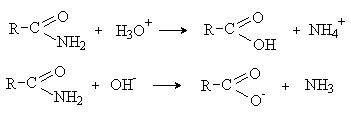
Амиды карбоновых кислот также подвержены гидролизу в кислой или щелочной среде.
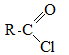
Получение галогеноангидридов:
При использование специфических реагентов – сульфонилхлорида или хлоридов фосфора можно получить еще один ряд производных – галогеноангидриды:

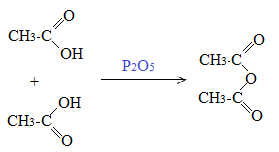
Получение ангидридов карбоновых кислот:
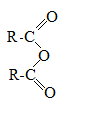
Под воздействием водоотнимающих агентов, например P2O5 можно получить ангидриды карбоновых кислот (дословно безводные):
Реакции с участием углеводородного радикала
Карбоновые кислоты, содержащие a -водородные атомы, взаимодействуют с бромом в присутствии фосфора с образованием исключительно α-бромпроизводных (реакция Гелля – Форгальда - Зелинского)
![]()