
- •Теоретическое занятие по теме «Карбоновые кислоты»
- •Актуализация изучаемой темы
- •Классификация и номенклатура карбоновых кислот
- •Систематическая и тривиальная номенклатура некоторых карбоновых кислот
- •Систематическая номенклатура ацильных и ацилатных остатков карбоновых кислот
- •Изомерия карбоновых кислот
- •Физические свойства карбоновых кислот
- •Химические свойства карбоновых кислот
- •Обоснование реакционной способности:
- •Кислотные свойства
- •Реакции с участием углеводородного радикала
- •Декарбоксилирование карбоновых кислот
- •Качественные реакции карбоновых кислот
- •Способы получения монокарбоновых и дикарбоновых кислот
Физические свойства карбоновых кислот
Низшие карбоновые кислоты (С1-С9) представляют собой бесцветные жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается.
Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
Высшие кислоты, начиная с пеларгоновой (н-нонановой) и ароматические карбоновые кислоты – это твердые вещества, нерастворимые в воде.
На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты в отличие от спиртов, образуют более прочные водородные связи.
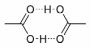
В связи с этим, карбоновые кислоты в твердом и жидком состояниях существуют в основном в виде циклических димеров:
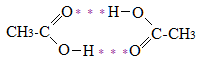
Химические свойства карбоновых кислот
Обоснование реакционной способности:
Для карбоновых кислот характерными будут химические реакции, протекающие по карбоксильной группе, а также реакции с участием углеводородного радикала.
Рассмотрим строение карбоксильной группы: формально, она состоит из двух функциональных групп – карбонильной (это функциональная группа альдегидов и кетонов) и гидроксильной группы (характерной для класса спиртов).
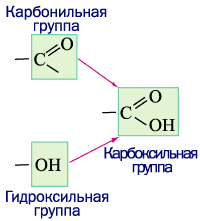
Таким образом, можно было бы предположить наличие свойств, обусловленных этими функциональными группами и характерных для спиртов и карбонильных соединений. Однако карбонильная и гидроксильная группа расположены настолько близко, что в значительной степени изменяют свойства друг друга. Смещение электронной плотности по всей карбоксильной группе происходит следующим образом:

Под влиянием карбонильной группы увеличивается поляризация связи О–Н, что приводит к усилению кислотных свойств по сравнению со спиртами. Кроме того, образующийся анион отличается более высокой стабильностью, что обусловлено наличием сопряжения (р,π-сопряжение):
За счет положительного мезомерного эффекта (π-р сопряжения) атома кислорода гидроксильной группы величина частичного положительного заряда на атоме углерода в карбоксильной группе уменьшается (по сравнению с альдегидами и кетонами). Это обуславливает менее активное поведение карбоновых кислот в реакциях с нуклеофилами.
По сравнению с альдегидами и кетонами в структуре карбоксильной группы появляется хорошо уходящая группировка, которую можно заместить, поэтому становятся возможными реакции нуклеофильного замещения (SN).
Сама карбоксильная группа оказывает заметное влияние на связанный с ней углеводородный радикал. Так, в случае алифатических карбоновых кислот активным становится α-водородный атом (аналогично альдегидам),

в молекулах ароматических кислот карбоксильная группа приводит к дезактивации бензольного кольца.
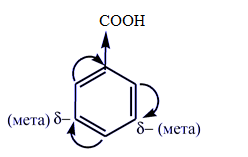
Таким образом, важнейшие свойства карбоновых кислот обусловлены возможностью диссоциации карбоксильной группы и возможностью нуклеофильной атаки по карбоксильному атому углерода с последующим замещением гидроксо-группы.
