
1 курс / все Тесты химия КТ
.docxВопрос: Для некоторой реакции ΔG0р < 0. Какие из приведенных утверждений правильны? (Ответ может быть не единственным) 1. Константа равновесия (Кр) > 1 2. К р < 1 3. В равновесной смеси преобладают исходные вещества 4. В равновесной смеси преобладают продукты реакции Ответ: 1, 4 Правильно!
Вопрос: Для некоторой реакции при 293 К константа равновесия К р = 5·10–5, а при 1000 К составляет К р = 2·10–6. Укажите из вариантов ответов знак ΔH0 этой реакции 1. ΔH0 > 0 2. ΔH0 < 0 3. ΔH0 = 0 4. ΔH0 = ΔG0р Ответ: 2 Правильно!
Вопрос:
На
основании стандартных теплот образования
и абсолютных энтропий соответствующих
веществ вычислите ΔG0 реакции,
протекающей по уравнению
С2Н4(г)
+ 3О2(г)
= 2СО2(г)
+ 2Н2О(ж).
Возможна
ли эта реакция при стандартных
условиях?
 1.
1331,4 Дж; невозможна
2.
–177,9 кДж; возможна
3.
–1331,4 кДж; возможна
4.
–177,9 кДж; невозможна
Ответ: 2
Неправильно!
1.
1331,4 Дж; невозможна
2.
–177,9 кДж; возможна
3.
–1331,4 кДж; возможна
4.
–177,9 кДж; невозможна
Ответ: 2
Неправильно!
Вопрос: Определить концентрацию ионов: а) водорода и б) SO42– в (моль/л и г/л) в 0,1 н растворе серной кислоты, если степень диссоциации H2SO4 равна 70%. 1. а) 0,07 моль/л или 0,07 г/л б) 0,035 моль/л или 3,36 г/л 2. а)0,2 моль/л или 0,2 г/л, б) 0,1 моль/л или 0,5 г/л 3. а) 0,05 моль/л или 0,2 г/л, б) 0,1 моль/л или 4,9 г/л 4. а) 0,2 моль/л или 0,1 г/л, б) 0,05 моль/л или 9,6 г/л Ответ: 1 Правильно!
Вопрос: Степень диссоциации угольной кислоты Н2СО3 по первой ступени в 0,1 н. растворе равна 2,11∙10–3. Вычислить К1дис 1. 4,45∙10–4 2. 4,45∙10–7 3. 4,45∙10–5 4. 4,45∙10–6 Ответ: 2 Правильно!
Вопрос: При какой концентрации (моль/л) раствора азотистой кислоты (К = 4·10–4), степень ее диссоциации будет равна 0,3? 1. 4,5∙10–3 2. 4,5∙10–4 3. 0,04 4. 0,30 Ответ: 2 Правильно!
Вопрос: Чему равна концентрация ионов водорода Н+ (моль/л) в водном растворе 0,3 М муравьиной кислоты, если α = 0,03? 1. 4,5∙10–4 2. 4,5∙10–3 3. 9,0∙10–3 4. 6,0∙10–4 Ответ: 3 Правильно!
Вопрос: При какой концентрации (в моль/л) уксусной кислоты в растворе: а) степень ее диссоциации составит 0,01; б) при какой концентрации степень диссоциации будет в 2 раза больше ? (К = 1,8·10–5). 1. а) 0,018; б) 0,044 2. а) 0,125; б) 0,022 3. а) 0,044; б) 0,022 4. а) 0,18; б) 0,045 Ответ: 4 Правильно!
Вопрос:
1-й
закон Рауля для неэлектролитов выражается
формулой….
1. ![]() 2.
Δtкип =
Kэб m
3.
Δtзам =
Kкр m
4.
Pосм =
CRT
Ответ: 1
Правильно!
2.
Δtкип =
Kэб m
3.
Δtзам =
Kкр m
4.
Pосм =
CRT
Ответ: 1
Правильно!
Вопрос:
Укажите
уравнение закона Вант-Гоффа, применимого
для растворов электролитов:
1. ![]() 2.
P = CМRT
3.
Росм. = iСМRТ
4.
Δtкип. =
iKэбСm
Ответ: 3
Правильно!
2.
P = CМRT
3.
Росм. = iСМRТ
4.
Δtкип. =
iKэбСm
Ответ: 3
Правильно!
Вопрос: Определите осмотическое давление (в кПа) раствора, содержащего 12 г уксусной кислоты (М=60) в 200 мл его раствора при 27°С 1. 498,9 2. 2239 3. 249,3 4. 2493 Ответ: 1 Неправильно!
Вопрос:
Укажите
формулу закона разбавления
Оствальда
1. 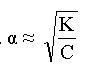 2.
2.  3.
3.  4.
4. 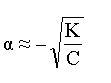 Ответ: 1
Правильно!
Ответ: 1
Правильно!
Вопрос:
2-й
закон Рауля для неэлектролитов выражается
формулой….
1.  2.
Δtкип =
Kэб Сm
3.
Pосм = iCRT
4.
Pосм =
CRT
Ответ: 2
Правильно!
2.
Δtкип =
Kэб Сm
3.
Pосм = iCRT
4.
Pосм =
CRT
Ответ: 2
Правильно!
Вопрос: Чему равна ионная сила растворов, содержащих в 1 л раствора: а) 0,1 моль КСl; б) 0,1 моль К2SО4: 1. а) 0,1; б) 0,3 2. а) 0,3; б) 0,1 3. а) 0,2; б) 0,5 4. а) 0,1; б) 0,2 Ответ: 1 Правильно!
Вопрос: Чему равна ионная сила раствора, содержащего в 1 л раствора 0,1 моль МgSО4: 1. 0,3 2. 0,5 3. 0,6 4. 0,4 Ответ: 4 Правильно!
Вопрос: Чему равна ионная сила раствора, содержащего в 1 л раствора 0,1 моль АlСl3 1. 0,4 2. 0,5 3. 0,6 4. 0,3 Ответ: 3 Правильно!
Вопрос: Чему равна ионная сила раствора, содержащего в 1 л раствора 0,01 моль К2SО4 + 0,01 моль Al2(SО4)3: 1. 0,32 2. 0,18 3. 0,25 4. 0,40 Ответ: 2 Правильно!
Вопрос:
Чему
равны активности Са2+ и
Сl– -ионов
в 0,02 н растворе СаСl2?
 1.
0,0039 и 0,0160
2.
0,0540 и 0,0152
3.
0,0054 и 0,1072
4.
0,0048 и 0,0175
Ответ: 1
Правильно!
1.
0,0039 и 0,0160
2.
0,0540 и 0,0152
3.
0,0054 и 0,1072
4.
0,0048 и 0,0175
Ответ: 1
Правильно!
Вопрос: При 100°С давление пара раствора, содержащего 0,05 моля сульфата натрия в 450 г воды, равно 100,8 кПа. Определите кажущуюся степень диссоциации Na2SO4. 1. 0,75 2. 0,90 3. 0,38 4. 0,65 Ответ: 1 Правильно!
Вопрос: Каково будет при 100°С давление пара раствора, содержащего 2,5 г гидроксида натрия в 90 г воды, если кажущаяся степень диссоциации NaОН в этом растворе равна 80%? 1. 49,4 2. 90,0 3. 75,5 4. 98,8 Ответ: 4 Правильно!
Вопрос: Давление пара раствора, содержащего 16,76 г Са(NO3)2 в 250 г воды, составляет 1,90 кПа при 17°С. Вычислить степень диссоциации соли (в %), если известно, что давление пара воды при той же температуре составляет 1,93 кПа. 1. 0,33 2. 0,29 3. 33 4. 19 Ответ: 2 Неправильно!
Вопрос: Вычислите давление пара 10%-ного раствора нитрата бария при 28°С. Давление пара воды при той же температуре составляет 3,77 кПа. Степень диссоциации соли 0,575. 1. 2.95 2. 3,71 3. 3,77 4. 2,25 Ответ: 2 Правильно!
Вопрос: Давление (в кПа) насыщенного пара над 10%-ным раствором карбамида СО(NН2)2 при 100°С составляет: 1. 75 2. 98 3. 101 4. 86 Ответ: 2 Правильно!
Вопрос: Температура кипения раствора, содержащего 9,09 г KNO3 (М=101,1) в 100 г воды, равна 100,8°С. Вычислите кажущуюся степень диссоциации нитрата калия в этом растворе. 1. 0,36 2. 0,89 3. 0,71 4. 0,58 Ответ: 3 Правильно!
Вопрос: Раствор, содержащий 0,53 г карбоната натрия в 200 г воды, замерзает при – 0,13°С. Вычислите кажущуюся степень диссоциации Na2CO3 в этом растворе. (М(Na2CO3) = 106) 1. 0,775 2. 77,5 3. 0,694 4. 0,895 Ответ: 4 Правильно!
Вопрос: Вычислите температуру кипения 3,38%-ного раствора нитрата кальция (М- 164,1), если соль диссоциирована на 65% 1. 100,255 2. 0,255 3. 100,55 4. 101,35 Ответ: 1 Правильно!
Вопрос: Раствор, содержащий 1,23 г нитрата цинка (М=189,4) в 100 г воды, кипит при 100,090°С. Вычислите степень диссоциации соли в растворе. 1. 0,77 2. 0,83 3. 0,69 4. 0,90 Ответ: 2 Правильно!
Вопрос: Раствор, содержащий 1,005 моля азотной кислоты в 10 л воды, замерзает при – 0,350°С. Вычислите степень диссоциации HNO3 в растворе. 1. 0,77 2. 0,87 3. 0,69 4. 77.1 Ответ: 2 Правильно!
Вопрос: Вычислите осмотическое давление (в кПа) раствора, в 5 л которого содержится 62,4 г CuSO4 · 5H2O (М=249,69) при 18,5°С. Кажущаяся степень диссоциации соли в растворе составляет 0,38. 1. 167 2. 183 3. 128 4. 155 Ответ: 1 Правильно!
Вопрос: Вычислите степень диссоциации соли , если в 0,01 н растворе KNO3 при 37°C осмотическое давление составляет 48,8 кПа. 1. 90,0 2. 0,78 3. 78,0 4. 0,90 Ответ: 4 Правильно!
Вопрос: Вычислите осмотическое давление (в кПа) 0,04%-ного раствора НCl при 37°С, при полной диссоциации НCl. Плотность раствора принять равной единице. 1. 78,2 2. 59,6 3. 69,5 4. 82,1 Ответ: 2 Правильно!
Вопрос: Вычислите (в кПа) осмотическое давление при 17,5°С раствора, в 500 мл которого содержится 5,35 г KIO3. Вычислите изотонический коэффициент и кажущуюся степень диссоциации соли в растворе. 1. 2,23; 0,83 2. 1,83; 0,72 3. 1,83; 0,83 4. 1,94; 0,72 Ответ: 3 Правильно!
Вопрос: Вычислить концентрацию [ОH–], если [H+] в моль/л, равна: а) 10–8; б) 2·10–4; в) 0,4·10–11; 1. а) 1·10–6; б) 5·10–8; в) 2,5·10–3 2. а) 1·10–5; б) 5·10–11; в) 2,5·10–4 3. а) 1·10–6; б) 5·10–8; в) 2,5·10–3 4. а) 1·10–6; б) 5·10–11; в) 2,5·10–3 Ответ: 4 Правильно!
Вопрос: Исходя из константы диссоциации слабого электролита, вычислить рН 0,25 н раствора СН3СООН, К = 1,8·10–5; 1. 2,67 2. 3,21 3. 4,05 4. 5,10 Ответ: 1 Правильно!
Вопрос: Определите рН раствора, полученного при смешивании равных объемов 0,02 М раствора КОН и 0,1 М раствора NH4OH (К = 1,8·10–5). 1. 9,5 2. 12 3. 8,9 4. 10,3 Ответ: 2 Правильно!
Вопрос: Вычислить рН 0,1 н раствора HCN (К = 7,2·10–10), к 1 л которого прибавили 0,1 моля KCN, диссоциирующего при этом на 90%. 1. 8,5 2. 6,3 3. 5,5 4. 9,1 Ответ: 4 Правильно!
Вопрос: Определить концентрацию ионов водорода (моль/л) в растворе, рН которого равна 4,60. 1. 6,31·10–4 2. 3,25·10–3 3. 6,31·10–3 4. 1,25·10–4 Ответ: 2 Неправильно!
Вопрос: Определите рН раствора, полученного при смешивании равных объемов 0,02 М раствора КОН и 0,1 М раствора NH4OH (K = 1,8·10–5). 1. 10,65 2. 4,35 3. 12 4. 8,65 Ответ: 3 Правильно!
Вопрос: Вычислите произведение растворимости Fe(OH)2, если в100 мл его насыщенного раствора содержится 9,6·10–5 г этого гидроксида. 1. 8,79·10–5 2. 1,2·10–3 3. 4,5·10–8 4. 4,76·10–15 Ответ: 4 Правильно!
Вопрос: Вычислите произведение растворимости PbI2, если в100 мл его насыщенного раствора содержится 0,0268 г ионов свинца. 1. 8,79·10–9 2. 8,79·10–5 3. 1,2·10–3 4. 4,5·10–8 Ответ: 1 Правильно!
Вопрос: Вычислите растворимость АgI в моль/л и г/л, если ПРAgI =1,5·10–16. 1. 4,5·10–8 и 1,05·10–6 2. 1,2·10–8 и 2,8·10–6 3. 2,76·10–8 и 6,3·10–6 4. 8,79·10–7 и 2,1·10–5 Ответ: 2 Правильно!
Вопрос: Образуется ли осадок иодида серебра, если смешать равные объемы 0,002 н растворов KI AgClO4? (ПРAgI =1,5·10–16). 1. частично 2. нет 3. да 4. нет условий для образования осадка Ответ: 3 Правильно!
Вопрос: Вычислите концентрацию ионов бария после прибавления к 1 л насыщенного раствора BaSO4 0,1 моля H2SO4 . Степень диссоциации кислоты α = 0,6, (ПРBaSO4 = 1,1·10–10). 1. 1,8·10–9 2. 8,79·10–5 3. 1,2·10–3 4. 4,5·10–8 Ответ: 1 Правильно! Вопрос: Укажите квантовое число, имеющее буквенные обозначения s, p, d, f: 1. главное 2. орбитальное 3. магнитное 4. спиновое Ответ: 2 Правильно!
Вопрос: Укажите максимальное количество электронов на внешнем энергетическом уровне атома: 1. 50 2. 6 3. 8 4. 18 5. 32 Ответ: 3 Правильно!
Вопрос: Укажите последовательность заполнения следующих подуровней 4p 4d 4f 5s 5p 5d: 1. 4p 4d 4f 5s 5p 5d 2. 4p 5s 4f 5p 4d 5d 3. 4p 5s 4d 5p 4f 5d 4. 5s 4p 5p 4d 5d 4f 5. 4p 4d 5s 4f 5p 5d Ответ: 3 Правильно!
Вопрос: Укажите электронную формулу, соответствующую атому в возбужденном состоянии: 1. 1s22s22p4 2. …3s23p64s23d5 3. …3s13p3 4. …4s23d104p2 5. …6s24f145d4 Ответ: 4 Неправильно!
Вопрос: Укажите положение ( № группы, подгруппу и № периода) в таблице Д.И.Менделеева элемента, у которого на 4р-подуровне есть 2 неспаренных электрона: 1. Ш период IVА группа 2. IV период VIA группа 3. V период IVА группа 4. III период IVВ группа 5. V период IVВ группа Ответ: 2 Правильно!
Вопрос: Для веществ, образованных металлической связью, характерно ____ 1. теплоизоляция 2. диссоциация в расплавах 3. электропроводность 4. летучесть Ответ: 3 Правильно!
Вопрос: В молекуле______ образуются σ - связи путем перекрывания s - и p- орбиталей 1. SiCl4 2. BF3 3. SF6 4. H2S Ответ: 2 Неправильно!
Вопрос: Расположите связи в порядке возрастания их полярности: а) H-Br, б) H-I, в) H-F, г) H-Cl 1. а, б, в, г 2. б, а, г, в 3. в, г, а, б 4. г, в, а, б Ответ: 2 Правильно!
Вопрос: Дипольный момент молекулы ______ равен нулю 1. BeO 2. SiCl4 3. PCl3 4. HI Ответ: 2 Правильно!
Вопрос: В молекуле __________угол между связями равен 120°: 1. PCl5 2. CCl4 3. SnCl2 4. BCl3 Ответ: 1 Неправильно!
Вопрос: sp3-гибридизация в молекуле 1. C2H4 2. CH4 3. PH3 4. CO2 Ответ: 2 Правильно!
Вопрос: Наибольшей степенью ионности обладает связь ______ 1. Na-O 2. Na-Cl 3. Na-S 4. Na-F Ответ: 4 Правильно!
Вопрос: Атомную кристаллическую решетку образует 1. алмаз 2. кобальт 3. СО2 4. хлорид меди CuCl2 Ответ: 1 Правильно!
Вопрос: Элементы в низшей степени окисления в ОВР ________ электроны 1. могут и отдавать и принимать 2. только принимают 3. только отдают Ответ: 3 Правильно!
Вопрос: С увеличением потенциала ионизации металлические свойства __________ 1. ослабевают 2. усиливаются 3. не изменяются Ответ: 1 Правильно!
Вопрос: Из приведенных примеров наиболее сильным восстановителем является 1. Cu 2. Mg 3. Si 4. Pb 5. S Ответ: 2 Правильно!
Вопрос: Ионы MnO4- в ОВР могут быть ________ 1. и окислителями и восстановителями 2. только восстановителями 3. только окислителями Ответ: 3 Правильно!
Вопрос: Превращение _________ соответствует процессу окисления 1. MnO4- → Mn2+ 2. SO42- → S2- 3. NO3- → NO2- 4. CrO42- → CrO2- 5. I- → I2 Ответ: 5 Правильно!
Вопрос: В реакции MnSO4 + NaClO + H2O → MnO2 + Cl- продуктом окисления является ________ 1. MnSO4 2. NaClO 3. H2O 4. MnO2 5. Cl- Ответ: 1 Неправильно!
Вопрос: Окислительно-восстановительная реакция HgO → Hg + O2 относится к типу _______ 1. внутримолекулярного ОВ 2. диспропорционирования 3. межмолекулярного ОВР Ответ: 1 Правильно!
Вопрос: В реакции W + KNO3 + KOH → WO42- + NO2- участвует ______ электронов 1. 8 2. 6 3. 4 4. 3 5. 2 Ответ: 2 Правильно!
Вопрос: Осадок не образуется при добавлении раствора AgNO3 к раствору 1. [Cr(H2O)6]Cl3 2. [Cr(H2O)5Cl]Cl2 3. [Cr(H2O)4Cl2]Cl 4. [Cr(H2O)3Cl3] Ответ: 4 Правильно!
Вопрос: Величина и знак заряда комплексного иона [Cr+3(H2O)2(OH)2Br2] равны 1. 1+ 2. 1- 3. 3+ 4. 3- Ответ: 3 Неправильно!
Вопрос: Соединение [Cu(NH3)4](OH)2 относится к классу 1. кислот 2. солей 3. оснований 4. аммиакатов Ответ: 4, 3 Правильно!
Вопрос: Из соединений [Zn(NH3)4]SO4 или ZnSO4 большая степень гидролиза характерна для 1. [Zn(NH3)4]SO4 2. ZnSO4 3. одинакова 4. обе соли не гидролизуются Ответ: 3 Неправильно!
Вопрос: Самым устойчивым комплексным ионом из представленных является 1. [Cd(NH3)4]2+, Kн ≈ 10-8 2. [CdCl4]2-, Kн ≈ 10-3 3. [Cd(CN)4]2-, Kн ≈ 10-17 4. [CdI4]2-, Kн ≈ 10-7 Ответ: 3 Правильно!
Вопрос: Образование комплексного иона [Au(CN)2]- описывается по методу ВС ______ типом гибридизации 1. sp 2. sp2 3. sp3 4. sp3d2 Ответ: 1 Правильно!
Вопрос: Концентрация ионов золота в 1 моль/л растворе соли K[Au(CN)2], если Кн = 1•10-39, составляет_______ 1. 2,9•10-12 2. 6,3•10-14 3. 2,2•10-16 4. 5,8•10-10 Ответ: 2 Правильно!
Вопрос: На аноде протекает процесс 1. нейтрализации 2. окислительно-восстановительный 3. окисления 4. восстановления Ответ: 3 Правильно!
Вопрос: Электродный потенциал цинка, опущенного в 0,01М раствор его соли, равен ______ В 1. −0,59 2. +0,819 3. −0,819 4. +0,30 Ответ: 3 Правильно!
Вопрос: При замене 0,1М раствора на 0,01М в гальваническом элементе Ag/AgNO3(0,01M)//AgNO3(0,1M)/Ag величина ЭДС_________ 1. не изменится 2. упадет до нуля 3. уменьшится в 2 раза 4. увеличится в 2 раза Ответ: 2 Правильно!
Вопрос: В гальваническом элементе _____ никель является катодом: 1. Ni/NiCl2//SnCl2/Sn 2. Ni/NiSO4//CuSO4/Cu 3. Ni/Ni(NO3)2//AgNO3/Ag 4. Ni/NiCl2//MgCl2/Mg Ответ: 4 Правильно!
Вопрос: Реакция MnO4− + Fe2+ ↔ MnO2 +Fe3+ в нейтральном водном растворе___ 1. протекает в прямом направлении 2. протекает в обратном направлении 3. находится в состоянии равновесия 4. невозможна ни при каких условиях Ответ: 2 Правильно!
Вопрос: Катодным по отношению к покрываемому металлу является покрытие 1. железо покрыто никелем 2. золото – медью 3. олово – хромом 4. железо- цинком Ответ: 1 Правильно!
Вопрос: Уравнения процессов электрохимической коррозии железа в контакте с никелем в нейтральной среде в присутствии кислорода____ 1. Fe – 2ē → Fe2+ 2H2O + O2 + 4ē → 4ОH− 2. Ni – 2ē → Ni2+ 2H2O + 2ē → H2 + 2OH− 3. Ni2+ + 2ē → Ni Fe2+ + 2ē → Fe 4. Ni – 2ē → Ni2+ 2H2O + O2 + 4ē → 4ОH− Ответ: 2 Неправильно!
Вопрос: Нельзя получить ________ электролизом водного раствора его соли 1. Mg 2. Mn 3. Hg 4. Sn Ответ: 1 Правильно!
Вопрос: При электролизе водного раствора CuSO4 на катоде протекает процесс _______ 1. 2H2O + 2ē → H2 + 2OH- 2. Cu − 2ē → Cu2+ 3. Cu2+ + 2ē → Cu 4. 2H+ + 2ē → H2 и Cu2+ + 2ē → Cu Ответ: 2 Неправильно!
Вопрос: Для полного разложения 1 моля воды током силой 1А потребуется _______ час 1. 10,7 2. 26,8 3. 107,2 4. 53,6 Ответ: 4 Правильно!
Вопрос: Какое из соединений алюминия в акустоэлектронике известно под названием «сапфир» 1. Al2O3 2. AlN 3. Al2O3 + Cr 4. Al2O3 + Ti Ответ: 1 Неправильно!
