
- •1 Мета:
- •2 Матеріально-технічне та навчально-методичне забезпечення:
- •3 Теоретичні відомості:
- •4 Хід роботи:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 3
- •4 Хід роботи:
- •5 Висновки
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 4
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 5
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 6
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 7
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 8
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 9
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
- •Інструкція для виконання лабораторної роботи № 10
- •4 Хід роботи:
- •5 Висновки:
- •6 Контрольні питання:
4 Хід роботи:
4.1 Відношення крохмалю до води (розчинність, створення клейстеру).
Ознайомтеся з кольором крохмалю, його характерним хрускотом під час розтирання між пальцями. У пробірку з водою об'ємом 1 мл помістіть скляну лопаточку крохмалю. Вміст пробірки збовтайте. Чи розчинився крохмаль у воді? Підігрійте в іншій пробірці воду об'ємом 5 мл і, перемішуючи, вилийте в гарячу воду вміст першої пробірки. Спостерігайте утворення крохмального клейстеру.
Увага! Для розчинення в гарячій воді не слід нагрівати отриману в попередньому досліді суміш крохмалю з водою, оскільки щільний шар крохмального осаду на дні пробірки спричиняє перегрівання скла. Тож пробірка може тріснути.
4.2 Взаємодія крохмалю з йодом.
У пробірку з крохмальним клейстером добавте краплю спиртового розчину йоду. Що спостерігаєте?
За допомогою якісної реакції можна виявити крохмаль у багатьох харчових продуктах і не лише в них.
4.3 Кислотний гідроліз крохмалю.
В конічну колбу налити крохмальний клейстер об’ємом 40 мл і додати 10% розчин сульфатної кислоти об’ємом 5-10 мл. Колбу нагріти.
У вісім пробірок налити дуже розведений розчин йоду в калій йодиді, пробірки пронумерувати і поставити в штатив. В першу пробірку внести одну краплю розчину крохмалю. Відмітити забарвлення. Потім колбу нагріти на азбестовій сітці невеликим полум’ям пальника. Після початку кипіння піпеткою відібрати другу пробу розчину, яку внести у другу пробірку з розчином йоду, після струшування відмітити колір розчину.
Наступні проби відбирати через одну хвилину і вносити їх у пробірки з розчином йоду до того поки реакційна суміш перестане давати забарвлення з йодом. Записати схему гідролізу крохмалю.
5 Висновки:
6 Контрольні питання:
6.1 Наведіть приклади рослин, багатих на крохмаль.
6.2 Поясніть, чому: а) якщо довго жувати шматочок хліба, ви відчуваєте солодкий смак; б) борошнистий смак насіння під час проростання змінюється на солодкуватий.
6.3 У промисловості гідроліз крохмалю здійснюють нагріванням з розбавленою сульфатною кислотою. Висловіть припущення, для чого після закінчення гідролізу до розчину добавляють надлишок крейди, підтвердьте свої міркування рівнянням реакції.
6.4 Топінамбур (земляна груша) не містить крохмалю, хоча страви з нього зовні й на смак нагадують картопляні. Запропонуйте, як хімічним шляхом розрізнити варені бульбу й топінамбур.
6.5 Поясніть, чому слід ретельно очищати зуби від залишків їжі, яка містить цукор і крохмаль.
Література
1 Потапов В.М., Татаринчик С.Н. Органическая химия, учебник для учащихся химических и химико-технологических специальностей техникумов. -Москва: «Химия», 1989.
2 Буринська Н.М., Величко Л.П. Хімія . Підручник 10 клас для загальноосвітніх навчальних закладів.- Київ: «Перун», 2002.
Інструкція для виконання лабораторної роботи № 9
Тема: Вивчення властивостей глюкози.
1 Мета:
1.1Єксперементально ознайомитися із властивостями моносахаридів на прикладі глюкози.
1.2 Ознайомитися на практиці зі здатністю моносахаридів до окислення і взаємодії з лугами.
1.3 Закріпити теоретичні знання на практиці.
2 Матеріально-технічне та навчально-методичне забезпечення:
2.1Пробірки.
2.2 Реактиви: розчину їдкого натру, аміачного розчину оксиду срібла, розчину глюкози, розчину сульфату міді .
2.3 Водяна баня.
3 Теоретичні відомості:
Глюко́за (від грец. γλυκύς — солодкий) (виноградний цукор, декстроза), С6Н12О6 — важливий моносахарид; білі кристали солодкі на смак, легко розчиняються у воді.Знаходиться в соку винограду, в багатьох фруктах, а також у крові тварин і людей. М'язова робота виконується головним чином за рахунок енергії, яка виділяється при окисленні глюкози.
Глюкоза отримується при гідролізі полісахаридів крохмалю і целюлози (під дією ферментів або мінеральних кислот).
Використовується як засіб посиленого харчування, або як лікарська речовина, при обробці тканини.
Природна кристалічна глюкоза (виноградний цукор) представляє собою циклічну альфа-формулу. При розчиненні в воді вона переходить в ланцюгову, а через неї в бета-форму; при цьому установлюється динамічна рівновага між усіма формами.
Бета-форма також може бути виділена в кристалічному вигляді; у водному розчині вона утворює рівноважну систему з іншими формами.
Ланцюгова форма існує лише в розчинах, причому в дуже невеликій кількості, а в вільному вигляді не виділена.
Ізомерні форми сполук, які здатні переходити одна в одну називають таутомерними формами, чи таутомерами. Явище таутомерії дуже розповсюджене серед органічних сполук.
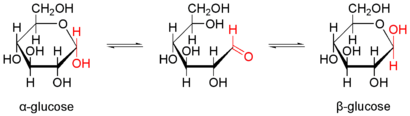

Як видно зі структурної формули, глюкоза є одночасно багато-атомним спиртом і альдегідом, тобто альдегідоспіртом. Оскільки в молекулі глюкози С6Н12О6 шість атомів вуглецю, то вона є представником гексоз.
Хімічні властивості.
Як альдегід дає такі реакції:а) окислюється аміачним розчином Аg2О (реакція «срібного дзеркала»);
СН2ОН-(СНОН)4-СОН + Аg2О→СН2ОН-(СНОН)4-СООН+2Аg↓
Реакції за участю гідроксильних груп.
б) із купрум(II) гідроксидом без нагрівання глюкоза реагує як багатоатомний спирт і дає характерне синє забарвлення. (свіжо добутим: NaOH+CuSO4);
СН2ОН-(СНОН)4-СОН + 2СиОН2→ СН2ОН-(СНОН)4-СООН +Си2О+2Н2О
Це якісна реакція на глюкозу
в) відновлюється до шестиатомного спирту
СН2ОН-(СНОН)4-СОН+ Н2→ СН2ОН-(СНОН)4-СН2ОН (сорбіт)
2 Специфічні властивості.
а)Поступове окиснення в організмах з повільним виділенням енергії:
С6Н12О6+6О2→6СО2↑+6Н2О
б)Молочнокисле та спиртове бродіння під дією бактерій:
C6H12O6 → CH3–CHOH–COOH (молочна кислота)
![]()
в)маслянокисле бродіння:
![]()
